腦梗死大鼠缺血腦組織中Slit2蛋白的表達及與血管新生的關系
劉海燕,婁季宇,白宏英,曾志磊,閆瑩瑩,樂 婷
鄭州大學第二附屬醫院神經內科鄭州450014
缺血性腦血管病作為威脅人類健康的三大疾病之一,具有高發病率、高致殘率和高病死率的特點,給社會和家庭帶來極大負擔。腦梗死后的血管新生能為組織細胞供血供氧,縮小梗死灶,減少神經缺損,并能有效幫助神經功能恢復[1]。然而,血管生成涉及多種血管生成因子、調節因子及相關的胞內通路,是一個多重交叉、輻射狀聯系的過程。Slit/Robo 信號通路能排斥性導向神經細胞的遷移[2],參與環路的形成,并能減輕炎癥反應,發揮神經保護作用[3]。在血管形成過程中,Slit/Robo 通路可能通過導向血管內皮頂端細胞的遷移而影響新生血管的分支和延伸。作者對缺血性卒中大鼠缺血腦組織中軸突導向因子Slit2 蛋白的表達情況進行了檢測,同時檢測了微血管密度(microvessel density,MVD)和Robo1、血管內皮生長因子(vascular endothelial growth factor,VEGF)mRNA 的表達,探討Slit2 在血管新生過程中的作用及可能的作用機制。
1 材料與方法
1.1 實驗動物及試劑 成年健康雄性SD 大鼠48只,體重250~300 g,由鄭州大學實驗動物中心提供,合格證號SCXK(豫)2010-0002。抗Slit2 兔多抗和抗Robo1 兔多抗購自Santa Cruz 公司。抗CD105 小鼠單抗購自Abcam 公司。RT-PCR 試劑盒購自Transgene 公司,引物由上海生工生物工程有限公司合成。
1.2 模型制備方法 采用改良Longa 等[4]方法建立永久性大腦中動脈梗死(permanent middle cerebral artery occlusion,pMCAO)大鼠模型。大鼠稱重后用水合氯醛溶液腹腔注射完成麻醉,固定后沿頸部正中切口逐層鈍性分離至頸前肌肉,在頸總動脈(CCA)搏動最清晰處剝開頸動脈鞘,分離出CCA,再依次分離出頸外動脈(ECA)、頸內動脈(ICA),夾閉ICA,再依次結扎ECA、CCA。在頸動脈分叉處下方置一手術縫線并打活結。在CCA 結扎線和活結之間剪一斜形小口,沿ICA 插入線栓,直至輕插遇阻力且標記處距分叉約2 mm 處,固定線栓至皮下后縫合。術后保暖至麻醉蘇醒。術后2 h 觀察大鼠神經行為學表現,并根據Longa 等[4]神經功能評分標準進行評分。評分達1~3 分且排除其他因素的動物納入研究,剔除評分為0 和4 分者,并采用相同造模方法予以補充。
1.3 實驗分組 將大鼠隨機分為假手術組和模型1、3、7天組,每組12只。假手術組不結扎不插線栓,余步驟同1.2。余3組按1.2 方法造模,并分別于術后第1、3、7天處死取材,進行相關指標的檢測。
1.4 標本采集和切片制作 ①新鮮腦組織標本:將大鼠深度麻醉后,置于冰塊上,30 s 內斷頭取腦,4℃冰生理鹽水沖洗后投液氮中迅速冷凍,并于-80℃冰箱中保存,用于Western blot 和RT-PCR。②石蠟包埋腦組織標本:將大鼠深度麻醉后,經心腔先后灌注生理鹽水和多聚甲醛,至大鼠四肢微顫,全身僵硬,取出大腦,稍加修整后投多聚甲醛液中固定,用于免疫組化染色。切片制作:大鼠腦組織經常規固定、石蠟包埋后,于視交叉后2 mm 內進行連續冠狀切片,片厚4 μm,每隔4 張取1 張切片,水洗漂片。
1.5 缺血腦組織中Slit2 蛋白的檢測 采用Western blot 法檢測缺血腦組織中Slit2 蛋白的表達水平。剪碎組織,加裂解液,勻漿后裂解30 min,4℃離心5 min,取上清。BCA 法檢測蛋白濃度。取80 μL 樣品和20 μL 5 ×SDS 上樣緩沖液混勻后加熱變性,灌膠上樣,每孔上樣量20 μL,進行SDS-PAGE。轉至PVDF 膜上,用50 g/L 脫脂奶粉封閉30 min,加一抗4℃過夜,TBST 漂洗3次后加二抗,漂洗后成像掃描。以GAPDH 為內參。用Bandscan 5.0 軟件進行灰度分析,以目的條帶與GAPDH 條帶灰度值的比值表示目的蛋白的表達水平。
1.6 MVD 的檢測 切片脫蠟水化后,PBS 沖洗(5 min ×3次),抗原熱修復15 min,雙氧水孵育20 min,加抗CD105(一抗)4℃過夜,加生物素標記的二抗室溫孵育20 min,鏈霉菌抗生物素-過氧化物酶溶液室溫孵育20 min。DAB 顯色,蘇木素復染,脫水透明,封片。用德國Leica 顯微照相系統采集圖像。鏡下觀察并參照Weidner 等[5]的方法進行微血管計數:在低倍視野下找到血管密度最高處,再在400 倍視野下,以呈棕色單個內皮細胞或內皮細胞簇且與鄰近的微血管或其他結締組織分開者為一個微血管,在熱點處選取4個不同區域進行微血管計數,計算MVD(單位為個/視野)。
1.7 缺血腦組織中Robo1 和VEGF mRNA 的檢測 采用RT-PCR 法檢測缺血腦組織中Robo1 和VEGF mRNA 的表達水平,以GAPDH 為內參。登錄GenBank 獲得Robo1 和VEGF 序列,設計特異性引物。Robo1 上游引物序列為5'-GGAGGAGTTCAGT GAAGAA-3',下游引物序列為 5'-TGGTG GCATCTAGGTTTTG-3',擴增產物長度309 bp。VEGF 上游引物序列為5'-CGGATCAAACCTCAC CAA-3',下游引物序列為 5'-TCTCCGCTCTGAA CAAGG-3',擴增產物長度201 bp。取約100 mg 腦組織,勻漿后加入Trizol 和氯仿提取總RNA,全程避免RNase 污染,逆轉錄合成cDNA,然后進行PCR 擴增。PCR 反應條件:94℃預變性2 min;94℃變性30 s,55℃退火30 s,72℃延伸2 min,共約35個循環;72℃總延伸6 min。產物經20 g/L 瓊脂糖凝膠電泳,并用凝膠成像分析系統進行分析,以目的條帶與GAPDH 條帶灰度值的比值表示目的基因mRNA的表達水平。
1.8 統計學處理 采用SPSS 17.0 處理數據。4組大鼠Slit2 蛋白、MVD、Robo1 和VEGF mRNA 表達水平的比較采用單因素方差分析和LSD-t 檢驗;采用Pearson 相關分析對模型組大鼠Slit2 蛋白表達與VEGF、MVD 的相關性進行分析。檢驗水準α=0.05。
2 結果
2.1 4組大鼠缺血腦組織中Slit2 蛋白的表達 模型1、3、7天組Slit2 蛋白表達均較假手術組升高,且呈逐漸升高趨勢。見圖1 及表1。
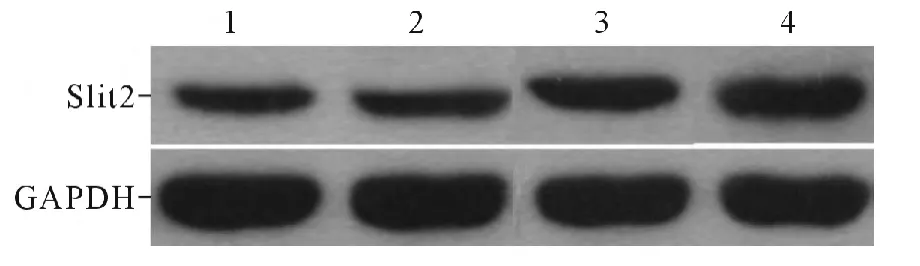
圖1 4組大鼠缺血腦組織中Slit2 蛋白的表達
2.2 4組大鼠缺血腦組織中MVD 的比較 模型1、3、7天組大鼠MVD 明顯高于假手術組,且呈逐漸升高趨勢。見表1。
2.3 4組大鼠缺血腦組織中Robo1 和VEGF mRNA 表達水平的比較 見圖2、3 和表1。與假手術組比較,模型1天組Robo1 mRNA 急劇降低,模型3、7天組有所回升,但模型7天組仍低于假手術組。模型組VEGF mRNA 的表達均高于假手術組,且逐漸升高。
2.4 模型組大鼠Slit2 蛋白和血管新生的相關性分析 Pearson 相關分析結果顯示,模型組大鼠Slit2蛋白表達與VEGF mRNA 表達水平及MVD 呈顯著正相關(r=0.974,0.926,P<0.001)。
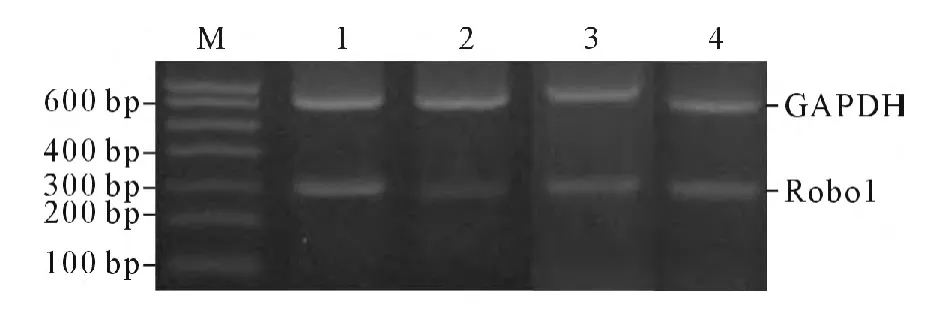
圖2 4組大鼠缺血腦組織中Robo1 mRNA 的表達

圖3 4組大鼠大鼠缺血腦組織中VEGF mRNA 的表達
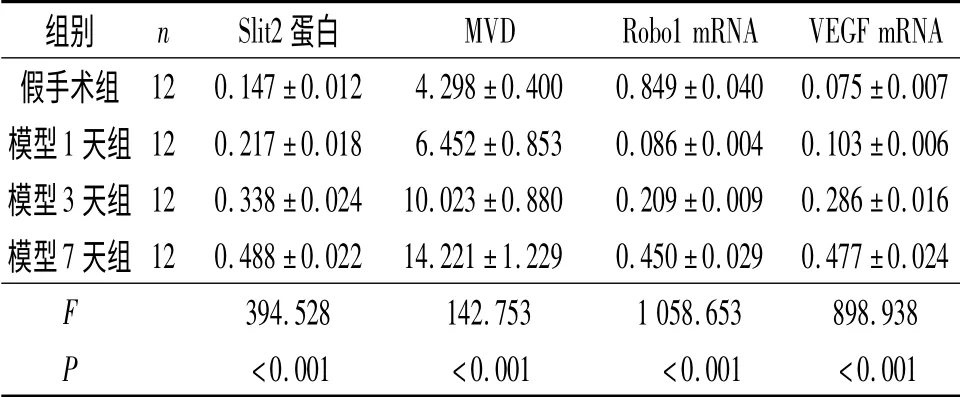
表1 4組大鼠缺血腦組織中各項指標的比較
3 討論
Slit2 蛋白是大腦中線細胞分泌的一類可擴散性的大分子信號蛋白,具有排斥性導向神經生長錐、誘導細胞遷移、促進軸突生長和突觸重塑的作用。Slit2 作為智障相關因子,在中樞神經生長發育過程中發揮重要作用,且在外周神經系統中,通過結合受體Robo1,激活下游信號分子,促進軸突再生[1-3]。Tanno 等[6]發現在坐骨神經橫斷術后,Slit2 mRNA表達上調并促進了損傷外周神經的修復。
與調控軸突再生類似,在調控血管生長方面,Slit/Robo 通路相關因子濃度的變化可刺激血管內皮頂端細胞,引起胞內骨架蛋白的變化,最終導致血管的延伸和分支。Wang 等[7]報道Slit2 能濃度依賴性地促進腫瘤血管的新生,從而為腫瘤的生長和轉移提供血氧供應。Wang 等[8]研究也發現Slit2 高表達于口腔癌和頰囊癌腫瘤黏膜,且與腫瘤生長和MVD 相關,抗體R5 可以阻斷Slit2 的這種作用。Huang 等[9]發現敲除小鼠視網膜上皮細胞Robo1 和Robo4 基因后,血管的形成和成管過程被干擾。上述研究結果均提示Slit/Robo 通路在血管新生過程中發揮重要作用。Han 等[10]成功構建了Slit2 轉基因小鼠,而該小鼠大腦血管密度和滲透性均顯著增加,提示干預Slit/Robo 通路有可能改善大腦循環狀態。
該研究結果顯示,大鼠腦梗死發生后,腦組織中Slit2 蛋白表達持續升高;Robo1 mRNA 表達先急劇降低,后逐漸升高,但在7 d 后仍低于正常水平;VEGF mRNA 表達和MVD 均逐漸升高;研究還發現Slit2 蛋白的表達與VEGF mRNA 表達水平和MVD顯著正相關;提示Slit2 很可能協同VEGF 在血管新生的過程中發揮重要作用,或Slit2 蛋白通過升高VEGF mRNA 的表達來介導促血管新生作用,但具體機制仍需進一步研究。Robo1 mRNA 表達水平在梗死后早期急劇下降,考慮這與細胞受損應激和Robo1 介導的炎癥細胞趨化黏附有關[11],而隨著缺血大腦炎癥反應的緩和,同時受逐漸升高的Slit2 蛋白的刺激,Robo1 mRNA 表達逐漸升高,通過增加跨膜受體Robo1 來發揮Slit2 介導的促血管新生作用。
綜上所述,Slit2/Robo 通路在大鼠局灶性腦梗死后血管新生中發揮了重要作用,如何通過及時增強或削減Slit/Robo 信號改善缺血病灶的微循環,還需要深入探討。
[1]Krupinski J,Kaluza J,Kumar P,et al.Role of angiogenesis in patients with cerebral ischemic stroke[J].Stroke,1994,25(9):1794
[2]Yeh ML,Gonda Y,Mommersteeg MT,et al.Robo1 modulates proliferation and neurogenesis in the developing neocortex[J].J Neurosci,2014,34(16):5717
[3]Altay T,Mclaughlin B,Wu JY,et al.Slit modulates cerebrovascular inflammation and mediates neuroprotection against global cerebral ischemia[J].Exp Neurol,2007,207(2):186
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84
[5]Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma[J].J Natl Cancer Inst,1992,84(24):1875
[6]Tanno T,Fujiwara A,Takenaka S,et al.Expression of a chemorepellent factor,Slit2,in peripheral nerve regeneration[J].Biosci Biotechnol Biochem,2005,69(12):2431
[7]Wang B,Xiao Y,Ding BB,et al.Induction of tumor angiogenesis by Slit-Robo signaling and inhibition of cancer growth by blocking Robo activity[J].Cancer Cell,2003,4(1):19
[8]Wang LJ,Zhao Y,Han B,et al.Targeting Slit-Roundabout signaling inhibits tumor angiogenesis in chemical-induced squamous cell carcinogenesis[J].Cancer Sci,2008,99(3):510
[9]Huang LZ,Yu WZ,Li XX,et al.Robo1/Robo4:different expression patterns in retinal development[J].Exp Eye Res,2009,88(3):583
[10]Han HX,Geng JG.Over-expression of Slit2 induces vessel formation and changes blood vessel permeability in mouse brain[J].Acta Pharmacol Sin,2011,32(11):1327
[11]Gangaraju S,Sultan K,Whitehead SN,et al.Cerebral endothelial expression of Robo1 affects brain infiltration of polymorphonuclear neutrophils during mouse stroke recovery[J].Neurobiol Dis,2013,54:24

