培哚普利對心肌肥厚大鼠心肌組織中肌細胞增強因子2A表達的影響
琚肖肖,趙玉蘭,董 靜,黃亞萍
鄭州大學第二附屬醫(yī)院心內科鄭州450014
目前,舒張性心力衰竭的發(fā)病率、病死率不斷上升,已成為心血管病研究的熱點。而心肌肥厚是舒張性心力衰竭的主要病因,是心臟為適應血流動力學超負荷而發(fā)生的增生。雖然心肌肥厚早期改變對于維持正常心功能有一定的代償意義,但它本身也會增加心肌耗氧量,降低心肌順應性,長期心肌肥厚會導致心力衰竭并增加猝死發(fā)生率[1]。心肌肥厚是心肌細胞對多種刺激因素產(chǎn)生的適應性反應,是一個復雜的病理反應過程。肌細胞增強因子2A(myocyte enhancer factor 2A,MEF2A)是MEF2 家族中的重要一員,在骨骼肌、心肌、平滑肌的分化及血管的發(fā)育中起著重要作用[2-3]。該研究旨在通過建立大鼠心肌肥厚模型,觀察MEF2A 在正常大鼠、心肌肥厚大鼠、藥物干預大鼠心肌組織中的表達情況,了解MEF2A 影響心肌肥厚發(fā)生發(fā)展的機制及培哚普利對其影響。
1 材料與方法
1.1 實驗動物及試劑 健康雄性SPF 級Wistar 大鼠30只,體重300~350 g,由山東魯抗醫(yī)藥股份有限公司實驗動物室提供。鹽酸異丙腎上腺素(ISO)注射液,2 g/L,上海合豐制藥有限公司生產(chǎn);培哚普利,8 mg/片,施維雅制藥有限公司生產(chǎn)。RT-PCR試劑盒(Transgene 公司),瓊脂糖(西班牙生化試劑公司),PCR 引物(北京博大泰克公司),SP 試劑盒(北京中杉金橋生物技術有限公司),MEF2A 抗體(北京博奧森生物技術有限公司)。
1.2 動物模型制備 30只Wistar 大鼠應用隨機數(shù)字表法分為3組,每組10只。①模型組:大鼠皮下注射ISO 3 mg/(kg·d)。②藥物干預組:大鼠皮下注射ISO 3 mg/(kg·d),培哚普利1 mg/(kg·d)溶于2 mL 飲用水中灌胃。③對照組:大鼠皮下注射與ISO 等劑量的生理鹽水,灌胃與培哚普利等劑量的生理鹽水。各組均連續(xù)處理10 d。
1.3 心臟重量參數(shù)測定 10 d 后,測量3組大鼠的體重,麻醉后開胸取出心臟,剪去心臟周圍的血管及組織,用預冷的生理鹽水沖洗,濾紙吸干水分,然后稱全心重量,沿冠狀溝剪去左心房,再沿室間溝剪去右室游離壁,稱左心室重量,計算全心重量/體重比(HW/BW)、左心室重量/體重比(LVW/BW);將左心室心肌組織分為兩部分,一部分放入液氮中儲存,另一部分放入40 g/L 多聚甲醛中固定24 h。
1.4 心肌組織的HE 染色 將多聚甲醛固定的心肌組織石蠟包埋,4 μm 厚切片,脫蠟后行常規(guī)HE染色,鏡下觀察各組心肌組織的形態(tài)學變化。
1.5 RT-PCR 檢測心肌組織中MEF2A mRNA 的表達 以GAPDH 為內參,上游引物5'-CGGCAAGT TCAACGGCACGC-3',下游引物5'-GCCTGCTTCAC CACCTTCTT-3',擴增片段大小636 bp;MEF2A 上游引物5'-TTCACTCGTGTCACCGTCTT-3',下游引物5'-TCTGGTTTCCGACTGTTCAT-3',擴增片段大小333 bp。提取心肌組織總RNA,按說明書步驟進行逆轉錄反應。PCR 擴增條件為:94℃預變性2 min;94℃變性30 s,58℃退火30 s,72℃延伸2 min,共35個循環(huán);72℃延伸6 min,55℃退火15 s。取5 μL擴增產(chǎn)物與緩沖液混合后加入瓊脂糖凝膠的加樣孔中,進行電泳。EB 染色后,在紫外線投射儀下觀察電泳條帶,用D-140 圖像記錄分析系統(tǒng)進行分析,MEF2A mRNA 的相對表達量以MEF2A 和GAPDH條帶灰度值的比值表示。
1.6 免疫組化檢測心肌組織中MEF2A 蛋白的表達 采用免疫組化SP 法。石蠟切片經(jīng)脫蠟水化、在PBS 溶液中浸泡、修復抗原、加入多克隆抗體、DAB 染色、蘇木素復染等步驟,然后進行分色、洗滌、脫水、透明、封片等,最后用顯微鏡進行觀察,MEF2A 蛋白染色后在心肌細胞中呈棕色顆粒。應用Lecia 圖像采集系統(tǒng),在400 倍視野下進行觀察,選取5個染色較均勻區(qū)域測量陽性細胞的灰度值,結果取平均值。
1.7 統(tǒng)計學處理 采用SPSS 17.0 進行數(shù)據(jù)分析。3組間HW/BW、LVW/BW、MEF2A 蛋白及mRNA相對表達量的比較均采用單因素方差分析,兩兩比較采用LSD-t 檢驗。檢驗水準α=0.05。
2 結果
2.1 3組大鼠HW/BW 和LVW/BW 的比較 結果見表1。
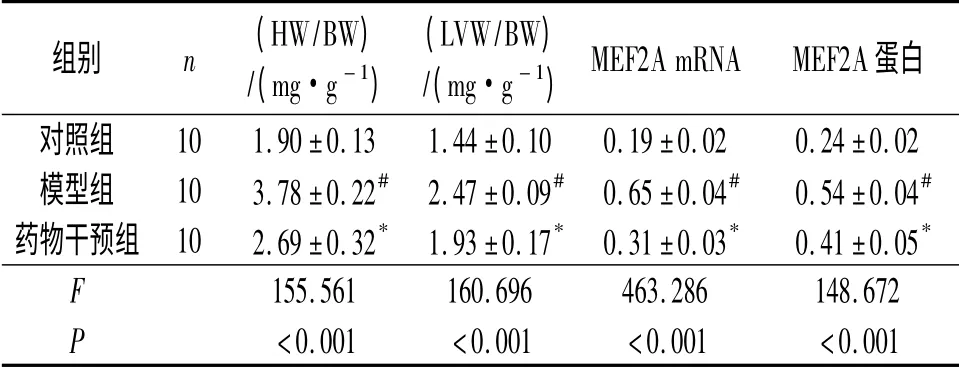
表1 3組大鼠HW/BW、LVW/BW、MEF2A mRNA 及蛋白相對表達量的比較
2.2 3組大鼠心肌組織的病理學變化 對照組大鼠心肌細胞無明顯改變,細胞核居中,心肌細胞排列整齊;模型組可見心肌細胞明顯肥大,排列紊亂,間質纖維結締組織增生明顯;藥物干預組心肌細胞較模型組稍小,間質纖維結締組織增生較少。見圖1。
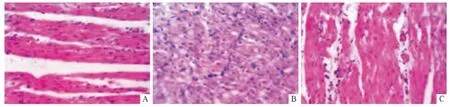
圖1 3組大鼠心肌組織HE 染色結果(×400)
2.3 3組大鼠心肌組織中MEF2A mRNA 的表達RT-PCR 檢測3組大鼠心肌組織中MEF2A mRNA的相對表達量,結果為:模型組>藥物干預組>對照組。見圖2 和表1。
2.4 3組大鼠心肌組織中MEF2A 蛋白的表達MEF2A 蛋白在心肌細胞中表現(xiàn)為棕色顆粒。對照組心肌細胞中可見少量棕色顆粒;模型組中可見大量棕色顆粒;藥物干預組中可見部分棕色顆粒,較模型組少。見圖3 和表1。
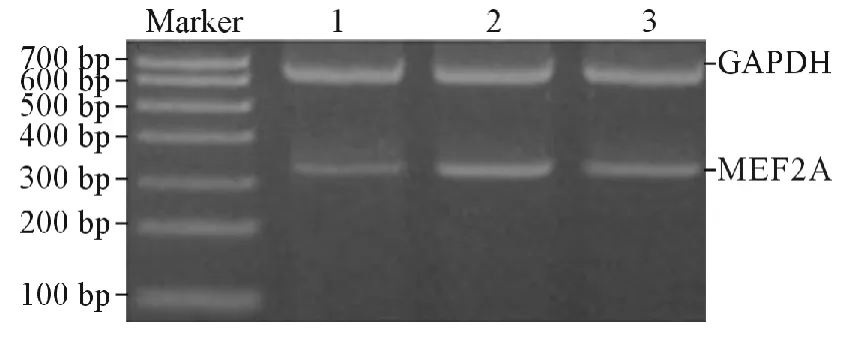
圖2 3組大鼠心肌組織中MEF2A mRNA 的表達
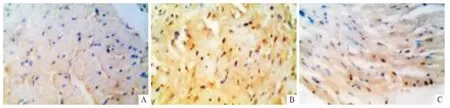
圖3 3組大鼠心肌組織中MEF2A 蛋白免疫組化染色結果(SP,×400)
3 討論
心肌肥厚是一種以心臟質量增加為特征的病理生理改變,可繼發(fā)于多種心血管疾病,最常見的是高血壓病。在高血壓的初期,心臟后負荷增加導致心臟泵血阻力增加,心臟代償性肥厚以克服增加的壓力負荷,但是持續(xù)的壓力超負荷引起心肌肥厚失代償,進而出現(xiàn)猝死、心律失常、心力衰竭等心血管意外[4]。血管緊張素Ⅱ、內皮素以及TGF-β 等因子通過多條通路誘導心肌蛋白合成,使心肌細胞增大,促進心肌肥厚的發(fā)生[5-6]。MEF2A 是p38MAPK 信號通路下游的重要調節(jié)因子,在信號傳導、肌肉組織中結構蛋白的形成中發(fā)揮重要的作用[7-8]。該研究通過免疫組化及RT-PCR 的方法分別檢測MEF2A 蛋白及mRNA 的表達情況,發(fā)現(xiàn)MEF2A 蛋白及mRNA 在模型組的表達均高于對照組,說明MEF2A 可能通過p38MAPK 信號通路介導心肌肥厚的發(fā)生發(fā)展[9]。
該研究通過比較3組大鼠HW/BW、LVW/BW、MEF2A mRNA 及蛋白相對表達量發(fā)現(xiàn),培哚普利干預后,HW/BW、LVW/BW 及MEF2A mRNA 和蛋白的相對表達量均低于模型組,提示MEF2A 在心肌肥厚的發(fā)生發(fā)展中起著促進作用,同時說明培哚普利可抑制MEF2A 的表達,進而抑制心肌肥厚的發(fā)生。
綜上所述,培哚普利可減輕肥厚心肌組織的病理改變,通過調控MEF2A 的表達發(fā)揮抑制心肌肥厚的作用。
[1]Berenji K,Drazner MH,Rothermel BA,et al.Does load-induced ventricular hypertrophy progress to systolic heart failure?[J].Am J Physiol Heart Circ Physiol,2005,289(1):H8
[2]Wang BW,Chang H,Kuan P,et al.Angiotensin Ⅱactivates myostatin expression in cultured rat neonatal cardiomyocytes via p38 MAP kinase and myocyte enhance factor 2 pathway[J].J Endocrinol,2008,197(1):85
[3]Dionyssiou MG,Nowacki NB,Hashemi S,et al.Cross-talk between glycogen synthase kinase 3β (GSK3β) and p38MAPK regulates myocyte enhancer factor 2(MEF2)activity in skeletal and cardiac muscle[J].J Mol Cell Cardiol,2013,54(7):35
[4]司林杰,許晶,易晨龍,等.積雪草酸抑制小鼠主動脈縮窄術后心肌肥厚形成[J].南京醫(yī)科大學學報:自然科學版,2014,34(9):1168
[5]Yu M,Zheng Y,Sun HX,et al.Inhibitory effects of enalaprilat on rat cardiac fibroblast proliferation via ROS/P38MAPK/TGF-β1 signaling pathway[J].Molecules,2012,17(3):2738
[6]王蒙,陳紹良.P38MAPK 信號通路與心血管疾病關系的研究進展[J].現(xiàn)代生物醫(yī)學進展,2012,12(30):5968
[7]Ye J,Cardona M,Llovera M,et al.Translation of myocyte enhancer factor-2 is induced by hypertrophic stimuli in car-diomyocytes through a calcineurin-dependent pathway[J].J Mol Cell Cardiol,2012,53(4):578
[8]Potthoff MJ,Olson EN.MEF2:a central regulator of diverse developmental programs[J].Development,2007,134(23):4131
[9]盛紅專,楊笛,張寄南.培哚普利對腎血管性高血壓大鼠心肌鈣調神經(jīng)磷酸酶及絲裂原活化蛋白激酶的影響[J].中華心血管病雜志,2004,32(11):999

