腫瘤浸潤T淋巴細胞在乳腺癌原發灶中的表達與預后的關系
蔣正華 韓旭
1.浙江金華廣福醫院十二病區腹部腫瘤外科,浙江金華321000;2.湖州師范學院附屬第一醫院胸外科,浙江湖州313000
腫瘤浸潤T淋巴細胞在乳腺癌原發灶中的表達與預后的關系
蔣正華1韓旭2
1.浙江金華廣福醫院十二病區腹部腫瘤外科,浙江金華321000;2.湖州師范學院附屬第一醫院胸外科,浙江湖州313000
目的研究腫瘤浸潤T淋巴細胞在乳腺癌原發灶中的表達及其與預后的關系。方法回顧性收集乳腺癌患者105例臨床資料、病理資料和石蠟包埋病理標本,采用免疫組化檢測CD3+T淋巴細胞、CD4+T淋巴細胞、CD8+T淋巴細胞在乳腺癌原發灶的表達,采用COX單因素和多因素分析無病生存率(DFS)和總生存率(OS)相關因素。結果105例患者乳腺癌原發灶CD3+陽性101例(96.19%),CD4+陽性55例(52.38%),CD8+陽性71例(67.62%),CD3+T淋巴細胞浸潤與年齡、腫瘤直徑、臨床分期、SBR分級、ER表達、PR表達、HER-2表達、淋巴結狀態無關,CD4+T淋巴細胞浸潤與SBR分級、HER-2表達有關(P<0.05),CD8+T淋巴細胞浸潤與SBR分級有關(P<0.05)。單因素分析顯示,臨床分期、SBR分級、HER-2陽性、淋巴結轉移、CD4+T淋巴細胞浸潤、CD8+T淋巴細胞浸潤與DFS有關(P<0.05);臨床分期、SBR分級、HER-2陽性、淋巴結轉移、CD4+浸潤、CD8+浸潤與OS有關(P<0.05);多因素分析顯示,CD4+T淋巴細胞浸潤、CD8+T淋巴細胞浸潤是DFS的保護因素(HR=0.655、0.534,P<0.05);CD4+T淋巴細胞浸潤、CD8+T淋巴細胞浸潤是OS的保護因素(HR=0.525、0.628,P<0.05)。結論乳腺癌原發灶普遍存在CD3+T淋巴細胞浸潤,CD4+T淋巴細胞、CD8+T淋巴細胞浸潤與病變程度有關,兩者均與乳腺癌較好預后有關。
乳腺癌;腫瘤浸潤T淋巴細胞;CD4+T淋巴細胞;CD8+T細胞;生存率
腫瘤浸潤淋巴細胞(TILs)是一類特殊淋巴細胞,在腫瘤免疫機制中處于免疫應答和調控作用前沿,在體內局部抗腫瘤過程中發揮重要作用,包括T淋巴細胞、B淋巴細胞、NK狀細胞等在乳腺癌病變區聚集浸潤,不同來源的TILs對腫瘤細胞作用不盡相同,有研究認為TILs與治療效果和生存率相關[1,2]。可通過早
期檢測評估和制定治療方案,提高治療針對性,降低復發率,改善患者預后。T淋巴細胞是機體重要的抗腫瘤免疫應答細胞,主要介導細胞免疫抑制或殺傷腫瘤細胞,CD3+是T淋巴細胞主要表面標志物,CD4+、CD8+T淋巴細胞是T淋巴細胞主要的兩種亞型,CD4+T淋巴細胞對體液免疫和細胞免疫有調節作用,分泌細胞因子激活CD8+T淋巴細胞,CD8+T淋巴細胞則具有細胞毒性作用,直接殺傷腫瘤細胞。以往研究對不同來源T淋巴細胞浸潤強度及其對預后的影響存在差異。本研究對乳腺癌原發灶組織中CD3+、CD4+、CD8+T淋巴細胞表達及其對患者無病生存率(DFS)和總生存率(OS)的影響進行分析。現報道如下。
1 資料與方法
1.1 一般資料
回顧性收集2008年6月~2012年5月在我院手術治療的乳腺癌患者105例臨床資料、病理資料和石蠟包埋病理標本,患者均為女性,年齡34~69歲,平均(52.34±4.37)歲,納入標準:均經術后病理證實為原發乳腺癌,TNM臨床分期Ⅰ~Ⅲ期[3],術前未進行放療、化療、靶向治療、免疫調節劑治療等,均順利完成乳腺癌根治術,臨床資料、病理資料、病理標本及術后隨訪資料完整。其中浸潤性導管癌76例,乳腺髓樣癌29例,TNM臨床分期Ⅰ期23例,Ⅱ期49例,Ⅲ期33例,淋巴結轉移35例,ER陽性78例,PR陽性62例,HER-2陽性23例,術后輔助化療91例,輔助放療33例,同步放化療18例,內分泌治療58例,均未行手術去勢。術后隨訪截止期為2014年6月,共25~70個月,中位隨訪時間46個月。
1.2 免疫組化
所有石蠟樣本連續切4 μm厚薄片,取其中病灶特征明顯切片進行烘烤、甲苯脫蠟、梯度酒精水化、高壓修復、3%H2O2孵育滅活內源性過氧化物酶、封閉非特異性抗原位點等預處理,加入鼠抗人CD3+、CD4+、CD8+單克隆抗體(均購自福建邁新公司)作為一抗,4℃孵育過夜,漂洗、復溫37℃,加生物素標記二抗工作液37℃孵育30 min,PBS緩沖液漂洗、DAB顯色、蘇木素復染,高倍顯微鏡下鏡檢,PBS替代一抗作陰性對照。
1.3 結果判定
高倍視野(×400倍)在病灶隨機選擇5個視野,應使所選視野分布于病灶各部位,CD3+、CD4+、CD8+染色均定位于淋巴細胞胞膜。觀察顯色強度:無顯色計0分,黃色或淺棕色計1分,棕色計2分,深棕色計3分;觀察顯色面積:進行視野淋巴細胞計數,<5%淋巴細胞著色計0分,<25%淋巴細胞著色計1分,25%~50%淋巴細胞著色計2分,>50%淋巴細胞著色計3分;顯色強度和顯色面積得分相乘,<2分為陰性(-),≥2分為陽性[2]。
1.4 統計學方法
采用SPSS19.0統計學進行分析,計量資料以(x±s)表示,等級資料采用軟件Kruskal-Wallis秩和檢驗,分類變量與連續變量的相關性采用Spearman秩相關性分析,生存分析采用Kaplan-Meier法,相關因素分析采用COX風險比例模型進行單因素和多因素分析,單因素分析P<0.1的因素可為納入多因素分析。α=0.05為檢驗水準,P<0.05為差異有統計學意義。
2 結果
2.1 CD3+、CD4+、CD8+在乳腺癌原發灶的表達與病理特征的關系
105例患者乳腺癌原發灶CD3+陽性101例(96.19%),CD4+陽性55例(52.38%),CD8+陽性71例(67.62%),CD3+T淋巴細胞浸潤與年齡、腫瘤直徑、臨床分期、SBR分級、ER表達、PR表達、HER-2表達、淋巴結狀態無關,CD4+T淋巴細胞浸潤與SBR分級、HER-2表達有關(P<0.05),CD8+T淋巴細胞浸潤與SBR分級有關(P<0.05),見表1。
2.2 乳腺癌DFS和OS影響因素COX單因素分析
隨訪期間復發或遠處轉移13例,死亡9例,經Kaplan-Meier法分析,2年無病生存率85.45%,生存率93.23%,3年無病生存率81.23%,生存率89.93%,5年無病生存率76.23%,生存率84.92%。將臨床及病理相關因素帶入COX模型為自變量,分別以無病生存率(DFS)和總生存率(OS)為因變量,單因素分析示,臨床分期、SBR分級、HER-2陽性、淋巴結轉移是DFS危險因素(HR=2.351、2.936、3.025、2.105,P<0.05),CD4+T淋巴細胞浸潤、CD8+T淋巴細胞浸潤對DFS有保護作用(HR=0.636、0.513,P<0.05);臨床分期、SBR分級、HER-2陽性、淋巴結轉移是OS危險因素(HR=3.251、3.562、4.251、3.024,P<0.05),CD4+T淋巴細胞浸潤、CD8+T淋巴細胞浸潤對OS有保護作用(HR=0.622、0.565,P<0.05),見表2。
2.3 乳腺癌DFS和OS影響因素COX多因素分析
單因素分析P<0.05的因素帶入多因素分析,SBR分級、淋巴結轉移是DFS的獨立危險因素(HR=2.526、2.415,P<0.05),CD4+T淋巴細胞浸潤、CD8+T淋巴細胞浸潤是DFS的保護因素(HR=0.655、0.534,P<0.05);淋巴結轉移是OS的獨立危險因素(HR=2.065,P<0.05),CD4+T淋巴細胞浸潤、CD8+T淋巴細胞浸潤是OS的保護因素(HR=0.525、0.628,P<0.05),見表3。
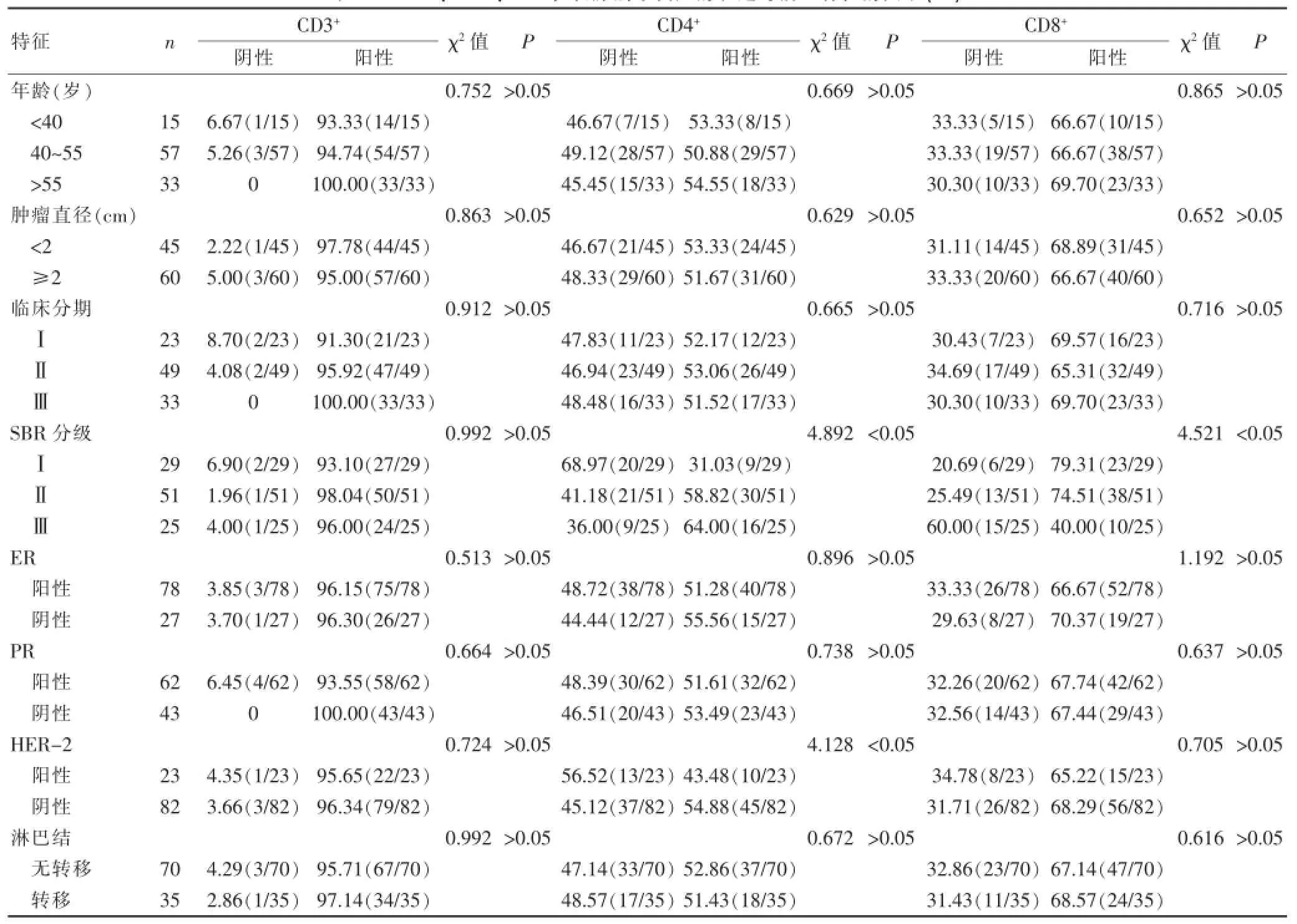
表1CD3+、CD4+、CD8+在乳腺癌原發灶的表達與病理特征的關系(%)
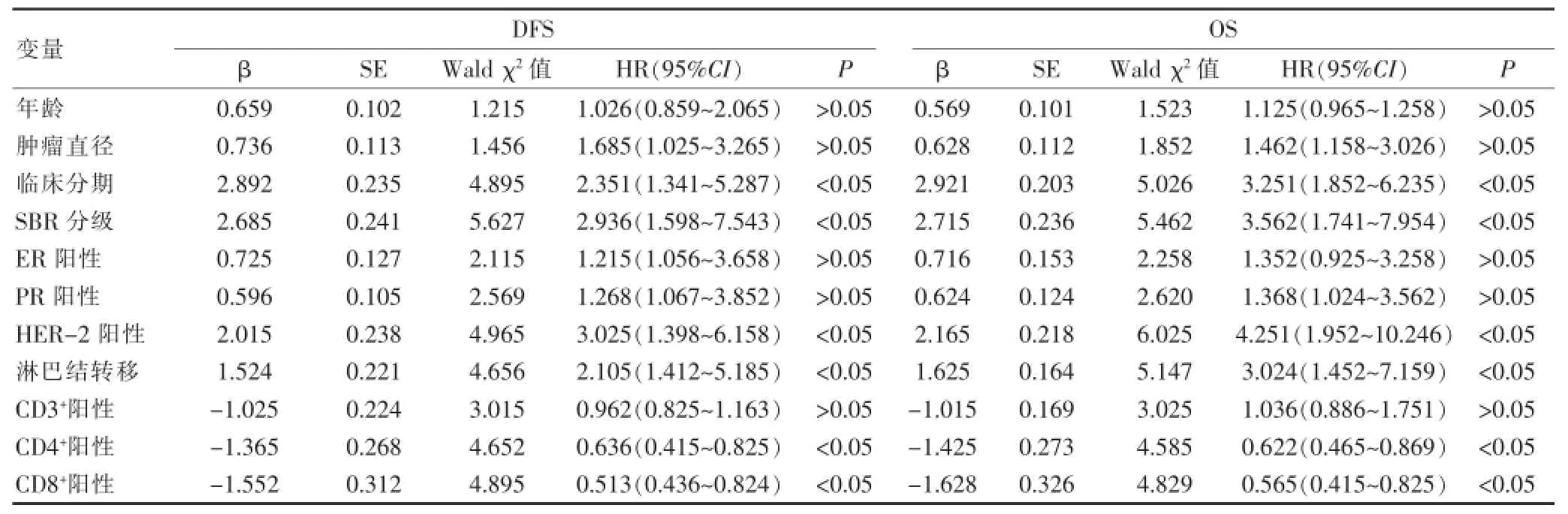
表2乳腺癌DFS和OS影響因素COX單因素分析
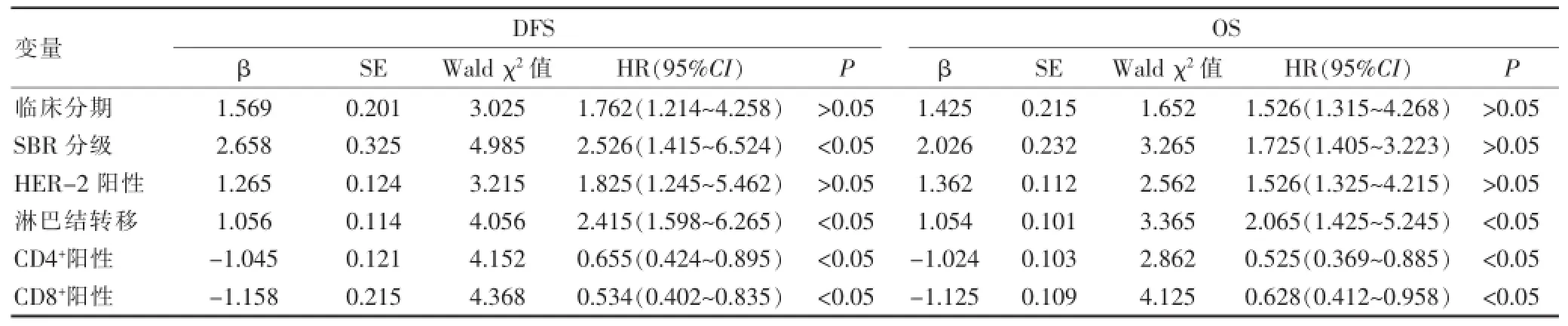
表3乳腺癌DFS和OS影響因素COX多因素分析
3 討論
T淋巴細胞是由重要的TILs組成,并且各亞群在腫瘤免疫中都發揮著重要作用,本組浸潤性導管癌76例,乳腺髓樣癌29例,原發灶CD3+陽性101例(96.19%)反映了乳腺癌癌巢內普遍存在T淋巴細胞浸潤,有研究發現腫瘤細胞間質也存在大量的T淋巴
細胞浸潤,但與生存率的關系并不明確[4,5]。張同先等[6]研究中128例患者浸潤性導管癌和髓樣癌組織中均呈CD3+陽性,而CD3+T淋巴細胞浸潤程度與分化程度、淋巴結轉移有關,分化越低表達強度越低,有淋巴結轉移的表達強度明顯低于無轉移。CD4+T淋巴細胞調節Th1和Th2平衡,介導腫瘤免疫,與腫瘤細胞相互作用而參與抗腫瘤和免疫逃逸過程,在腫瘤組織中表達并不高[7],本組CD4+陽性55例(52.38%),CD8+T淋巴細胞是腫瘤組織中主要的浸潤T淋巴細胞亞型,本組CD8+陽性71例(67.62%),與文獻報道相似。CD4+T淋巴細胞浸潤與SBR分級、HER-2相關,SBR分級越嚴重CD4+陽性率越高,HER-2陽性則CD4+陽性率更高,CD8+T淋巴細胞浸潤與SBR分級相關,SBR分級越嚴重CD8+陽性率越高,均顯示CD4+T淋巴細胞、CD8+T淋巴細胞浸潤可能與乳腺癌生物學特征及惡性程度有關[8]。
本組乳腺癌患者隨訪時間25~70個月,中位隨訪時間46個月,復發或遠處轉移13例,死亡9例,2年無病生存率85.45%,生存率93.23%,3年無病生存率81.23%,生存率89.93%,5年無病生存率76.23%,生存率84.92%,術后存在較高的復發或遠處轉移風險,分析腫瘤浸潤T淋巴細胞表達及其他臨床資料與預后的關系有助于為臨床干預提供參考指標。在COX單因素分析顯示,臨床分期、SBR分級、HER-2陽性、淋巴結轉移均可提高復發風險(HR=2.351、2.936、3.025、2.105),同時也是OS危險因素(HR=3.251、3.562、4.251、3.024),而原發灶組織中CD4+T淋巴細胞、CD8+T淋巴細胞浸潤則對DFS和OS有一定保護作用。腫瘤預后受到多種因素共同影響,而本研究反映出的危險因素均與腫瘤生物學特征和病情嚴重程度有關,與以往多項流行病學調查結果相似[9,10],本研究提示CD4+T淋巴細胞、CD8+T淋巴細胞浸潤機體免疫機制在腫瘤灶內主要發揮抗腫瘤免疫作用。盡管CD4+T淋巴細胞存在多種亞群并通過多種細胞因子發揮不同免疫功能,腫瘤細胞可自行分泌免疫抑制細胞因子干擾腫瘤免疫,或通過分泌TGF-β選擇性抑制CD4+T淋巴細胞,CD4+T淋巴細胞調節使Th1/Th2平衡向Th2漂移則參與腫瘤免疫逃逸[11,12],研究結果則顯示,在乳腺癌原發灶內的免疫調節可能是有利于細胞免疫對腫瘤的殺傷。并且多因素分析也證實,CD4+細胞是DFS和OS的獨立影響因素,與更好的預后有關。本研究納入病理為浸潤性導管癌和乳腺髓樣癌,在以往的研究中這兩種類型的CD4+細胞表達較其他類型乳腺癌更高[13],因此,CD4+T淋巴細胞浸潤對其他類型乳腺癌的影響仍需進一步研究。
CD8+T淋巴細胞可直接溶解和殺死異體細胞、微生物及腫瘤細胞,是機體細胞免疫的主要力量,其受到CD4+T淋巴細胞的調控,以上結果提示CD4+T淋巴細胞在乳腺癌灶內的作用有利于抗腫瘤免疫,與CD8+T淋巴細胞高表達相符,在大腸癌組織中CD8+T淋巴細胞浸潤與臨床分期、組織分型等有關,惡性程度越高CD8+細胞表達越高,而CD8+T淋巴細胞浸潤程度越高預后越好[14],在本研究中也部分體現了這種情況,提示機體在對抗惡性腫瘤細胞時調動細胞免疫的能力可能受到腫瘤細胞生物學特征的影響,而CD8+T淋巴細胞浸潤則反映機體免疫反應強度,存在個體化因素影響。同時也支持對于患者免疫功能的調節可能有利于提高患者預后的觀點[15],而激發CD8+T淋巴細胞活性可能是干預的作用點。本研究顯示CD8+T淋巴細胞浸潤是DFS和OS的獨立影響因素,與更好的預后有關。
綜上所述,乳腺癌原發灶組織中普遍存在CD3+T淋巴細胞浸潤,CD4+T淋巴細胞、CD8+T淋巴細胞浸潤與病變程度有關,兩者均與乳腺癌較好預后有關。
[1]曹林林,劉穎男,鄭德明,等.乳腺癌患者手術前后T淋巴細胞亞群變化的實驗研究[J].中國實驗診斷學,2013,17(1):113-114.
[2]Meyerhuber P,Conrad H,Starck L,et al.Targeting the epidermal growth factor receptor(HER)family by T cell receptor gene-modified T lymphocytes[J].Journal of molecular medicine,2010,88(11):1113-1121.
[3]James A,Thompson Minu K,Srivastava Jacobus J,et al.The absence of invariant chain in MHC II cancer vaccines enhances the activation of tumor-reactive type 1 CD4+T lymphocytes[J].Cancer immunology,immunotherapy:CII,2008,57(3):389-398.
[4]林澤偉,駱必偉,袁曉東,等.原發性肝癌患者腫瘤浸潤T淋巴細胞亞群分析[J].中國現代普通外科進展,2013,16(7):523-526,541.
[5]何建明,黃湛,吳家豪.CD8+腫瘤浸潤淋巴細胞與乳腺癌預后的關系[J].中國普通外科雜志,2013,22(11):1475-1478.
[6]張同先,張巍,劉芬,等.CD20+B和CD3+T淋巴細胞在乳腺浸潤性導管癌和髓樣癌中的表達及與預后的關系[J].腫瘤防治研究,2013,40(5):463-467.
[7]于海明,焦順昌,楊俊蘭,等.乳腺癌原發灶T淋巴細胞浸潤與預后的關系[J].中國醫學科學院學報,2013,35(2):199-206.
[8]張宗勤,張小峰.淋巴細胞浸潤腫瘤的調節機制[J].中國腫瘤生物治療雜志,2013,20(3):372-375.[9]王鴻雁,史秦峰,孫穎,等.人乳腺癌組織及局部引流淋巴結中調節性T細胞分析[J].中華病理學雜志,2013,42(2):95-100.
[10]曲嬋娟,易玲,張洪濤.腫瘤免疫治療熱點及肺癌疫苗研究近況[J].中華腫瘤雜志,2013,35(6):401-404.
[11]Janneh O,Chandler B Hartkoorn.Intracellular accumulation of efavirenz and nevirapine is independent of P-glycoprotein activity in cultured CD4 T cells and primary human lymphocytes[J].The Journal of Antimicrobial Chemotherapy,2009,64(5):1002-1007.
[12]Yuan H,Hsiao YH,Zhang Y,et al.Destructive impact of T-lymphocytes,NK and Mast cells on basal cell layers: Implications for tumor invasion[J].BMC Cancer,2013,13(6):258.
[13]Zhao S,Yang X,Lu N,et al.The amount of surface HLA-I on T lymphocytes decreases in breast infiltrating ductal carcinoma patients[J].The Journal of international medical research,2011,39(2):508-513.
[14]翟志偉,王振軍.腫瘤浸潤淋巴細胞在結直腸癌中的研究進展[J].中華胃腸外科雜志,2013,16(8):797-800.
[15]Matkowski R,Gisterek I,Halon A.The prognostic role of tumor-infiltrating CD4 and CD8 T lymphocytes in breast cancer[J].Anticancer Research,2009,29(7):2445-2451.
Tumor-infiltrating T lymphocytes relationship with prognosis in primary tumors in breast cancer
JIANG Zhenghua1HAN Xu2
1.No.12 Ward of Abdominal Tumor Surgery,Guangfu Hospital of Jinhua City in Zhejiang Province,Jinhua321000,China;2.Department of Thoracic Surgery,the First Affiliated Hospital of Huzhou Teachers College,Huzhou313000,China
Objective To research tumor-infiltrating T lymphocytes in breast primary tumor expression and the relationship with prognosis.Methods Retrospectively collected clinical data of 105 cases of breast cancer patients,pathological data and paraffin-embedded pathological specimens,using immunohistochemical detection of CD3+T cells,CD4+T cells,CD8+T cells in primary tumors in breast cancer,used univariate and multivariate COX factor analysis of diseasefree survival(DFS),overall survival(OS)related factors.Results The primary tumor CD3+positive 101 cases(96.19%), in 105 cases with breast cancer CD4+positive 55 cases(52.38%),CD8+positive 71 cases(67.62%),CD3+T cells infiltration with age,tumor size,clinical stage,differentiation degree,SBR grade,ER expression,PR expression,HER-2 expression and lymph node status were independent,CD4+T cells infiltration were related to SBR grade,HER-2(P< 0.05),CD8+T cells infiltration were related to cell differentiation and SBR grade(P<0.05).Univariate analysis showed that clinical stage,degree of differentiation,SBR grade,HER-2 positive,lymph node metastasis,CD4+T cells infiltration,CD8+T cells infiltration were related to DFS(P<0.05);clinical stage,SBR grade,HER-2-positive,lymph node transfer,CD4+T cells infiltration,CD8+infiltration were related to OS(P<0.05);multivariate analysis shows,CD4+T cells infiltration,CD8+T cells infiltration were protective factor for DFS(HR=0.655,0.534,P<0.05);CD4+T cells infiltration, CD8+T cells infiltration were protective factor for OS(HR=0.525,0.628,P<0.05).Conclusion The prevalence of breast cancer primary tumor infiltration of CD3+T cells,CD4+T cells,CD8+T cells infiltration and related lesions,both with better prognosis in breast cancer.
Breast cancer;Tumor-infiltrating T lymphocytes;CD4+T cells;CD8+T cells;Survival
R737.9
A
1673-9701(2015)06-0013-04
2014-09-25)
國家醫學教育發展中心課題項目(2012-03-07-143)

