自噬
——細胞與腫瘤細胞的維生途徑
徐艷
大連市金州區第一人民醫院病理科,遼寧大連116100
自噬
——細胞與腫瘤細胞的維生途徑
徐艷
大連市金州區第一人民醫院病理科,遼寧大連116100
細胞自噬,又被稱為Ⅱ型細胞程序性死亡,發現于上世紀50年代,因其與凋亡以及腫瘤的關系而再次成為研究熱點。但是研究人員更傾向于把自噬視為一種細胞維持生存的途經,當然這一作用也應該同樣適用于腫瘤細胞。倘若如此,自噬在腫瘤的治療研究中將前景無限。
自噬;腫瘤形成;凋亡;放療;化療
自噬(autophagy)是細胞為擺脫饑餓狀態而通過溶酶體將胞質內的部分蛋白質(包括受損和錯誤折疊的蛋白質、大分子、老化和機能障礙的細胞器以及蛋白質聚集物)消化分解為氨基酸用于供能和生物合成的生物學現象。這種細胞結構的再循環現象普遍存在于大部分真核細胞中,是其在長期進化過程中形成的一種生存機制,它是細胞在惡劣條件下自我保護的基本應激反應,屬于一種微觀細胞事件,幾乎不受神經、體液調節。按照胞內物質轉運的方式,可分為巨自噬(macroautophagy)、微自噬(microautophagy)、分子伴侶介導的自噬(chaperone-mediated autophagy,CMA)三種,其中后兩種較為少見。
1 自噬的過程及分子機制
自從上世紀90年代自噬相關基因[1](autophagy related gene,Atg)被發現后,自噬過程的神秘面紗逐漸被揭開,即細胞接受自噬誘導信號后,啟始序列室區(initial sequestering compartment)出現很多Atg蛋白,在胞漿的某處形成一個雙層膜的前自噬體(phagophore);其不斷延伸,將胞漿中的成分(胞質成分和某些細胞器等)攬入、“收口”,成為密閉球型的自噬體(autophagosome),進而形成自噬性溶酶體(autolysosome)。
其中,形成前自噬體涉及到ULK(mTORCl的一個下游分子)、Atg9及Atg18(Vps34-vps15-Beclinl激酶復合物)。其中Atg18通過運送At99和脂質參與前自噬體的形成[2],后者的延伸過程受Atg5-Atg12-Atg16、LC3-PE兩個泛素樣連接系統不斷調控,最終形成自噬體[3]。自噬體的半衰期很短,只有8 min左右。與泛素-蛋白酶體介導的短壽命蛋白降解不同,自噬是溶酶體介導的長壽命蛋白或細胞器的降解。
目前,參與自噬過程的分子調控機制非常復雜,至今尚未被完全闡明。已知相關的調控通路主要包括:mTOR(雷帕霉素靶標)信號通路、AMPK(AMP活化蛋白激酶)通路、PI3K(Ⅰ型磷脂酰肌醇,3-羥激酶)途徑等。
2 自噬的生理作用及其能力變化對細胞的影響
在營養充足條件下,細胞保持基本自噬(basal autophagy)[4]水平,維持細胞內的穩態。氨基酸一旦缺乏,自噬隨之啟動,滿足細胞自身能量代謝的需要,由于其作用底物是內源性的,自噬在消化、分解、自然更替一些細胞內的結構上起著“垃圾處理廠”或“清道夫”的作用。當細胞受到藥物、射線或機械損傷時,自噬性溶酶體的數量明顯增多;在病變細胞中也常可見到。另外,細胞內長壽蛋白、過氧化物以及線粒體的代謝更新,還有內質網的形態變化,都與自噬有關。
細胞自噬功能缺陷,生存能力則大大降低。研究發現,剛出生的某些自噬基因被敲除的小鼠活不過
1 d[5];小鼠在被特異性敲除某些Atg基因后,其心肌、肝臟、神經、胰腺和肌肉組織的細胞內出現泛素蛋白的病理性沉積,從而引發相應的功能障礙。
持續性的自噬可以引起細胞死亡(Ⅱ型程序性細胞死亡),形態學上不見染色質固縮,伴隨胞質內出現大量自噬性空泡,即自噬性細胞死亡(autophagic cell death,ACD),但目前研究認為,自噬作用并不是細胞的一種死亡機制,而認為其在細胞維持生存、逃避死亡方面具有重要作用[6]。
3 自噬與凋亡的關系
自噬與凋亡關系十分復雜,至今成謎。眾所周知,自噬與凋亡分別作為Ⅱ型和Ⅰ型程序性細胞死亡共存于細胞內,盡管死亡是細胞凋亡的唯一結局,自噬則有助于細胞維生的意義。甚至有研究認為,細胞自噬導致的細胞死亡過程反倒有一些顯著的細胞凋亡的特點。據報道[7],Atg1高表達所誘導的細胞自噬可使細胞體積變小、生長受控,故推測自噬所誘導的細胞死亡可能與凋亡有關。有時抑制細胞凋亡能導致自噬,而抑制細胞自噬也能觸發凋亡。Luo等[8]研究發現凋亡能夠抑制自噬,由Bax引起的凋亡能夠通過增加對有caspase-3依賴的Beclin1的裂解來減少自噬,而當BCL-2高表達、凋亡受抑制時,Bax又可以通過阻斷BCL-2/BCL-XL與Beclin1間的相互作用來增加自噬。更有研究發現,Atg與Beclinl蛋白均具有促凋亡作用[9];而凋亡相關蛋白如Bcl-2能與Beclinl結合進而抑制自噬[10]。在某些條件下,自噬對于凋亡是必需的;自噬也可延緩凋亡的發生,從而避免細胞死亡。研究證實[11]自噬和凋亡彼此的通路間存在交叉反應,受某些相同因子的作用,且具有相似的調控途徑,兩者之間可彼此影響。
4 自噬與腫瘤
4.1 自噬與腫瘤的發生
自噬與細胞穩態乃至其基因組完整性的維持密切相關,倘若改變其自噬水平或許能導致基因組完整性破壞,引起腫瘤的發生。研究發現在自噬缺陷的細胞內,促癌蛋白p62/SQSTM、內質網分子伴侶、受損的線粒體以及活性氧(ROSI)增多,這些都是造成破壞細胞內環境穩定、引起DNA損傷突變、導致腫瘤發生的因素[12];研究發現腫瘤細胞中自噬性降解的量要低于正常細胞中的基礎水平[13],說明自噬抑制或許與腫瘤的發生存在某種關聯,在有自噬功能障礙的環境下可能有利于腫瘤細胞的轉化。據報道鼠胰腺細胞的自噬能力在癌變前強于癌變之后[14]。由此可見,自噬作用的存在可能會抑制腫瘤的發生。在一定條件下作為一種細胞內溶酶體途經的蛋白質降解方式,還可補充和替代另一種由蛋白酶體介導的降解途經[15];已有研究證明,蛋白酶體降解與腫瘤發生相關。還有報道稱,自噬基因Beclin1是一種單倍劑量不足性的腫瘤抑制基因,提示自噬作用是阻止細胞轉化的非常重要的途經[16]。當然也有例外,在宮頸癌HeLa細胞、肺癌細胞以及大腸癌細胞內的自噬活性是升高的[17]。研究發現在腫瘤的發生過程中,自噬作用的異常可能與自噬相關蛋白的參與有關,Beclin 1、PTEN、roTOR、p53[18]等抑癌基因發生失活或表達下降從而誘導自噬作用;也包括PI3K、bcl-2、AKT等癌基因活性增強或表達升高進而對自噬作用形成抑制。由此也相繼衍生出作用于分子靶點的藥物用于腫瘤的治療。
4.2 腫瘤組織中的自噬
自噬作為一種進化上非常古老和保守的代謝途徑,有利于細胞內穩態的維持,不僅對正常細胞、病變損傷的細胞,當然也應包括腫瘤細胞。在腫瘤發展過程中,腫瘤細胞逐漸通過上調自噬來應對環境中的各種壓力,從而促進腫瘤的生存和發展。這也許是環境選擇使然,高自噬活性使腫瘤細胞能夠抵御惡劣環境進而生存下去。研究發現,在無法大規模增殖的腫瘤微環境下,卵巢腫瘤細胞可以激活自噬以介導休眠[19]。自噬作用能幫助代謝旺盛的腫瘤細胞適應缺氧、代謝應激等生存環境。研究發現在胰腺癌這種血供差的腫瘤中,抑制其自噬作用會加劇活性氧自由基對DNA的損傷,并且會造成代謝活動的改變[20],說明當快速生長的腫瘤細胞缺乏營養時,自噬幫助腫瘤細胞進行適應,使其能繼續生存下去。在腫瘤的轉移過程中,自噬對于腫瘤細胞脫離胞外基質后的成活具有顯著促進作用[21]。自噬可抑制腫瘤細胞自周圍組織脫離出來后產生的失巢性凋亡并提高失巢細胞的適應能力,研究發現原本表達量很高的失巢內皮細胞,在干擾其自噬調節因子的表達后發生凋亡,還發現失巢的上皮細胞也有自噬的表達,在敲除自噬相關基因后,自噬受抑,凋亡增強,克隆生存能力降低[22]。當然腫瘤細胞抗失巢性凋亡的機制除與自噬有關外,還與一些抗凋亡因子的過度激活等有關[23]。此外,自噬與腫瘤患者的預后也有一定關系。Geng等[24]發現Beclin 1在胃癌的發生中起到一定的作用,并可能成為預測胃癌淋巴結轉移患者預后的一個生物指標;Jo等[25]發現,自噬相
關基因Atg10與腫瘤患者的生存預后有關,表達Atg10的腫瘤患者的5年無病生存期及總生存期比不表達患者明顯要長。
不僅如此,隨著抗癌治療的進行,腫瘤細胞的自噬水平也會隨之提高,增強對電離輻射以及化療藥物的適應性。通常放療和化療會破壞腫瘤細胞的結構和功能,使細胞中積累大量的受損DNA、蛋白質、細胞器和細胞毒性物質,此時腫瘤細胞通過誘導自噬來清除受損物質,降低細胞毒性損害。已發現誘導自噬使膠質瘤干細胞對放療產生耐受[26],而抑制自噬后細胞對輻射的敏感性增加。Chaachouay等[27]用LC3-Ⅱ/LC3-Ⅰ的比值來衡量自噬的表達水平,放療耐受的乳腺癌細胞被輻射后,自噬水平顯著提高;Zheng等[28]發現,自噬不僅能促進而且能抑制腫瘤細胞的生存,但會隨著腫瘤細胞中對輻射敏感度有重要影響的p53狀態而發生改變,在不同p53狀態下的腫瘤細胞自噬對輻射的反應會有所不同;Yang等[29]發現,耐藥食道癌細胞通過誘導自噬來促進自身的生存和化療后的恢復,而敲除自噬相關基因則能增強食道癌細胞的化療效果;在某些人膠質母細胞瘤的細胞系中,因添加順鉑而誘發的自噬明顯抑制瘤細胞凋亡,而干擾自噬的形成則導致瘤細胞大量死亡[30]。
研究者認為[31],通過誘導氧化應激和腫瘤間質的自噬或線粒體自噬的方法能夠推動癌細胞的侵襲和轉移,借此癌細胞可以直接從基質來源的必需營養素、基礎化合物(氨基酸、核苷酸)和具有高能量的代謝產物(谷氨酰胺、丙酮酸、酮等)中攝取足夠的營養以推動腫瘤進展和轉移進程,這種能量實際上是通過自噬或線粒體自噬從癌相關的成纖維細胞中攝取獲得的。因此,有研究者提出癌細胞通過氧化應激誘導腫瘤微環境即腫瘤間質發生自噬[32];這種具有自噬性的腫瘤基質所再生的營養物質,可以被癌細胞用以合成自身的基礎化合物;這一模式導致凈能量從腫瘤基質向癌細胞單向的失衡性的傳遞,意味著腫瘤基質與癌細胞之間形成一個真正的宿主-寄生關系。自噬在這里作為獨立于血管形成供養模式的存在為腫瘤的生長,進展和轉移提供能量。但是,機體對自噬的系統性誘導會阻礙癌細胞對再生營養的利用,而機體對自噬的系統性抑制則會阻止腫瘤基質細胞繼續生產回收性的營養物質從而餓死癌細胞。腫瘤細胞可能通過上調天然內源性腫瘤細胞自噬抑制劑來抵抗系統性的自噬誘導作用。另一方面,腫瘤細胞通過基因沉默/刪除pro-autophagic分子(如Beclin1),來抵抗系統性的自噬誘導。如果自噬抑制作用在腫瘤細胞內發展下去,那么引起這一作用的系統性自噬抑制則對這一類型的耐藥反應提供了一種治療方案,因為系統性自噬抑制的目標在腫瘤間質。他們認為這一模式的提出可以解釋一些自噬相關的耐藥現象,提出交替使用的抗癌療法相結合的自噬促進劑和自噬抑制劑可能會防止耐藥性的發生。
5 結語與展望
美國有研究人員發現鍛煉身體的奇妙作用在于促進細胞自噬,說明自噬對于生命維持的重要性。在對于自噬的眾多研究中,它與凋亡的關系似乎是個關鍵,在與腫瘤的相關研究中也離不開對于二者關系的分析。由于能夠影響腫瘤細胞抵抗放療和化療的獨特作用,自噬被視為一種治療指標,它對于腫瘤的作用已被集中深入的研究。筆者認為自噬與凋亡可能是同屬于一個生命過程的兩個階段——前者負責維持一種生存平衡,一旦此平衡不能維持下去,則自動進入一個不可逆的死亡程序。這也許就能夠解釋為什么兩者的相關蛋白會有某些結構相似性,為什么凋亡活動的調節因子亦可在自噬活動中起調節作用,為什么同一個信號通路會對自噬和凋亡均有作用,為什么自噬本身和抑制自噬均可以促進凋亡發生,為什么自噬誘發的細胞死亡具有明顯凋亡特征。自噬在一定程度上似乎可以抑制腫瘤的發生,同時它也是腫瘤細胞的一種維生途經,也會因作為腫瘤治療研究的切入點而在今后大有作為。
[1]Bursch W,Grasl-Kraupp B,Ellinger A,et al.Active cell death:Roleinhepatocarcinogenesisandsubtypes[J].Biochem Cell Biol,1994,72(11-12):669-675.
[2]Burman C,Ktistakis NT.Autophagosome formation in mammalian cells[J].Semin Immunopathol,2010,32(4):397-413.
[3]Zhou ST,Zhao LJ,Kuang MC,et al.Autophagy in tumorigenesis and cancer therapy:Dr.Jekyll or Mr.Hyde?[J].Cancer Lett,2012,323(2):115-127.
[4]Mathew R,Karantza-Wadsworth V,White E,et al.Role of autophagy in cancer[J].Nat Rev Cancer,2007,7(12):961-967.
[5]Kuma A,Mizushima N.Physiological role of autophagy as all intracellular recycling system:With an emphasis on nutrient metabolism[J].Semin Cell Dev Biol,2010,21(7):
683-690.
[6]Giusti C,Tresse E,Luciani MF,et al.Autophagic cell death:Analysis in Dictyostelium[J].Biochim Biophys Acta,2009,1793(9):1422-1431.
[7]Neufeld TP.Contribution of Atg1-dependent autophagy to TOR-mediated cell growth and survival[J].Autophagy,2007,3(5):477-479.
[8]Luo S,Rubinsztein DC.Apoptosis blocks Beclin 1-dependent autophagosome synthesis:An effect rescued by BclxL[J].Cell Death Differ,2010,17(2):268-277.
[9]Zakeri Z,Melendez A,Lockshin RA.Detection of autophagy in cell death[J].Methods Enzymol,2008,442:289-306.
[10]Kang R,Zeh HJ,Lotze MT,et al.The Beclin 1 network regulates autophagy and apoptosis[J].Cell Death Differ,2011,18(4):571-580.
[11]Amelio I,Melino G,Knight RA.Cell death pathology:Cross-talk with autophagy and its clinical implications[J].Biochem Biophys Res Commun,2011,414(2):277-281.
[12]武玉,賈雪梅,戴輝華.細胞自噬與卵巢癌的關系[J].醫學綜述,2014,20(19):3510-3513.
[13]Chen Z,Li YC,Zhang C,et al.Downregulation of Beclin 1 and impairment of autophagy in a small population of colorectal cancer[J].Dig Dis Sci,2013,58(10):2887-2894.
[14]Tóth S,Krisztina Nagy,Palfia Z,et al.Changes in cellular autophagic capacity during azaserine-initiated pancreatic carcinogenesis[J].Acta Biol Hung,2001,52(4):393-401.
[15]White E.Deconvoluting the context—dependent role for autophagy in cancer[J].Nat Rev Cancer,2012,12(6):401-410.
[16]Edinger AL,Thompson CB.Defective autophagy leads to cancer[J].Cancer Cell,2003,4(6):422-424.
[17]邱冬梅,陳莉.細胞自噬:病理學研究的新熱點[J].臨床與實驗病理學雜志,2012,28(3):309-312.
[18]Chen N,Dcbnath J.Autophagy and tumorigenesis[J].FEBS Lett,2010,584(7):1427-1435.
[19]Lu Z,Luo RZ,Lu Y,et al.The tumor suppressor gene ARHI regulates autophagy and tumor dormancy in hu man ovarian cancer cells[J].J Clin Invest,2008,118(12):3917-3929.
[20]Ropolo A,Bagnes CI,Molejon MI,et al.Chemotherapy and autophagy-mediated cell death in pancreatic cancer cells[J].Pancreatology,2012,12(1):1-7.
[21]Buchheit CL,Rayavarapu RR,Schafer ZT.The regulation of cancer cell death and metabolism by extracellular matrix attachment[J].Semin Cell Dev Biol,2012,23(4):402-411.
[22]Fung C,Lock R,Gao S,et al.Induction of autophagy during extracellular matrix detachment promotes cell survival[J].Mol Biol Cell,2008,19(3):797-806.
[23]Zhang J,Yang Z,Xie L,et al.Statins,autophagy and cancer metastasis[J].Int J Biochem Cell Biol,2013,45(3):745-752.
[24]Geng QR,Xu DZ,He LJ,et al.Beclin-1 expression is a significant predictor of survival in patients with lymph node-positive gastric cancer[J].PLoS One,2012,7(9):e45968.
[25]Jo YK,Kim SC,Park IJ,et al.Increased expression of ATGl0 in colorectal cancer is associated with lymphovascular invasion and lymph node metastasis[J].PLo S One,2012,7(12):e52705.
[26]Zhuang W,Qin Z,Liang Z.The role of autophagy in sensitizing malignant glioma cells to radiation therapy[J].Acta Biochim Biophys Sin(Shanghai),2009,41(5):341-351.
[27]Chaachouay H,Ohneseit P,Toulany M,et al.Autophagy contributes to resistance of tulnor cells to ionizing radiation[J].RadiotherOncol,2011,99(3):287-292.
[28]Zheng R,Yao Q,Du S,et al.The status of p53 in cancer cells affects the role of autophagy in tumor radiosensitisation[J].J Buon,2014,19(2):336-341.
[29]Yang ZJ,Chee CE,Huang S,et al.The role of autophagy in cancer:Therapeutic implications.[J].Mol Cancer Ther,2011,10(9):1533-1541.
[30]Arhaji-Trajkovic L,Vilimanovich U,Kravic-Stevovic et al.AMPK-mediated autophagy inhibits apoptosis in cisplatin-treated tumour cells[J].J Cell Mol Med,2009,13(9B):3644-3654.
[31]Pavlides S,Tsirigos A,Migneco G,et al.The autophagic tumor stroma model of cancer:Role of oxidative stress and ketone production in fueling tumor cell metabolism[J].Cell Cycle,2010,9(17):3485-3505.
[32]Martinez-Outschoorn UE,Whitaker-Menezes D,Pavlides S,et al.The autophagic tumor stroma model of cancer or“battery-operated tumor growth”:A simple solution to the autophagy paradox[J].Cell Cycle,2010,9(21):4297-4306.
Autophagy:A way for cells and cancer cells to survive
XU Yan
Department of Pathology,the Jinzhou District First People’s Hospital of Dalian,Dalian116100,China
Cell autophagy,also known asⅡtype of programmed cell death,which is found in the 1950 s,once again becomes a hot research topic because of its relationship with apoptosis and tumor.But the researchers are more inclined to view the autophagy as a kind of cells to survive through.Of course,this should also apply to tumor cells.If so, the autophagy in tumor therapy research is bright.
Autophagy;Neoplasia;Apoptosis;Radiotherapy;Chemotherapy
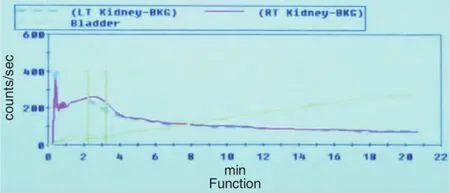
圖1 正常對照者腎功能曲線(見內文第2頁)
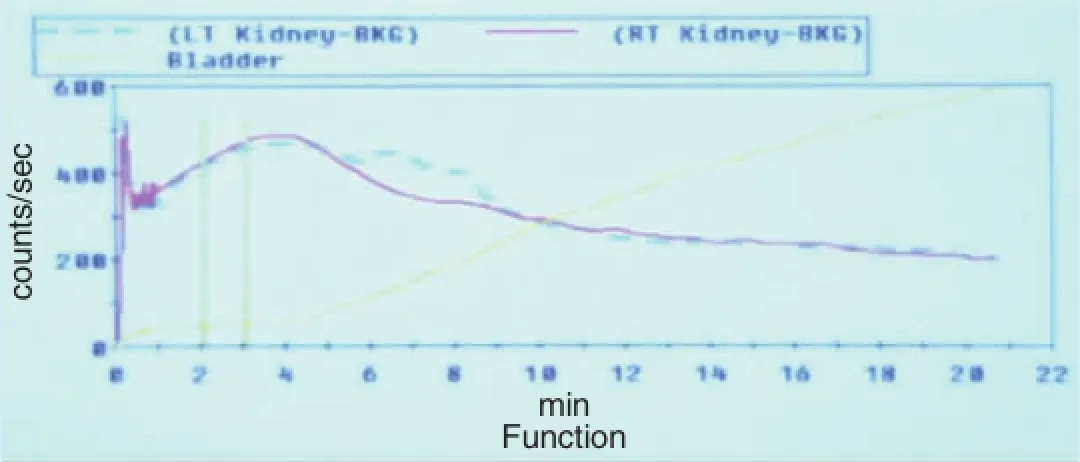
圖2 糖尿病無白蛋白尿腎功能曲線(見內文第2頁)
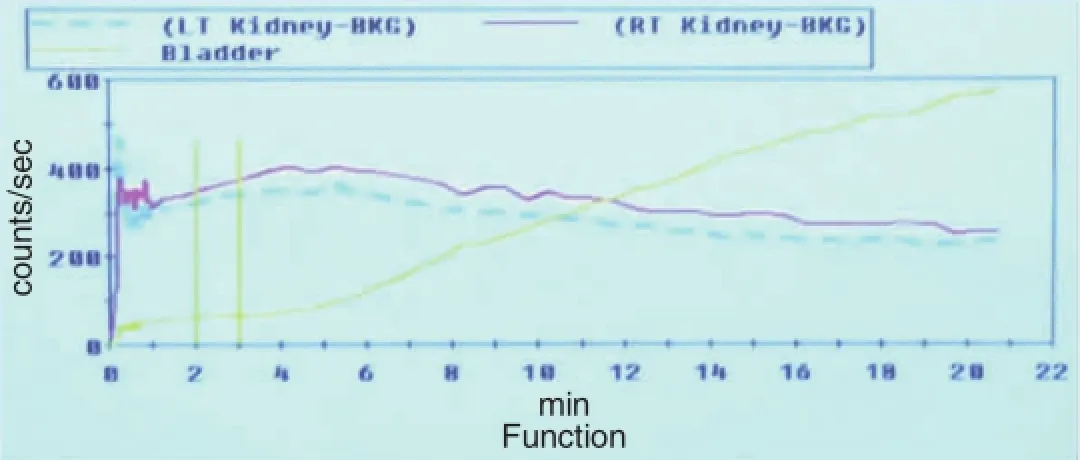
圖3 糖尿病伴微量白蛋白尿腎功能曲線(見內文第2頁)
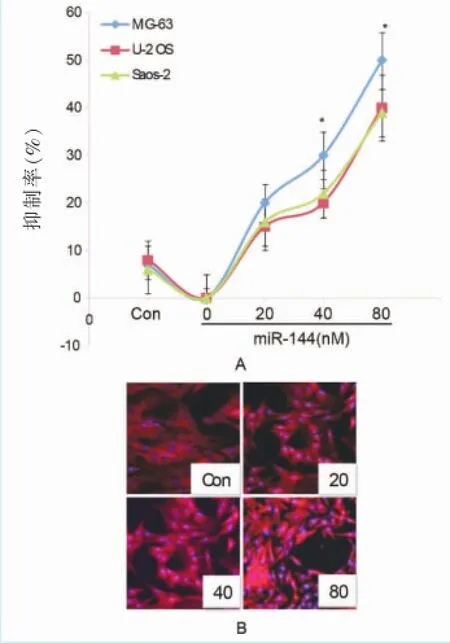
圖4 A.MTT檢測miR-144類似物轉染48 h后對3種骨肉瘤細胞株的抑制效果(n=3)*P<0.05,與對照組抑制率相比,差異具有統計學意義;B.200倍放大下,轉染MG-63細胞24 h后miR-144不同濃度組以及陰性對照(Con)的紅色熒光信號強度(見內文第8頁)

圖5 化療后同一肺部腫塊ADC偽彩圖以中間紅色、周圍黃綠色為主(見內文第85頁)
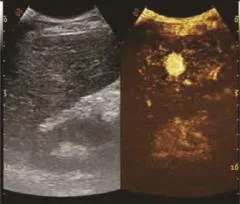
圖6 原發性肝癌動脈期早期(見內文第88頁)
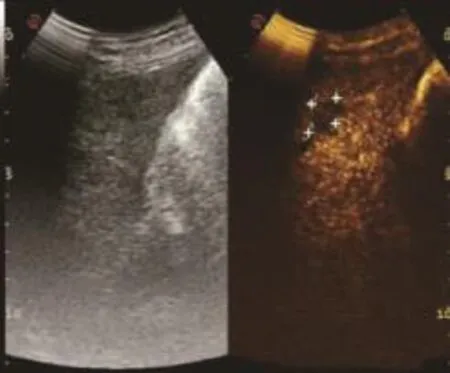
圖7 原發性肝癌門靜脈期(見內文第88頁)
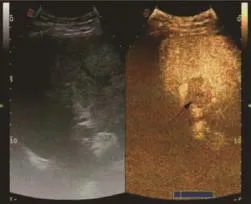
圖8 轉移性肝癌動脈期晚期(見內文第88頁)
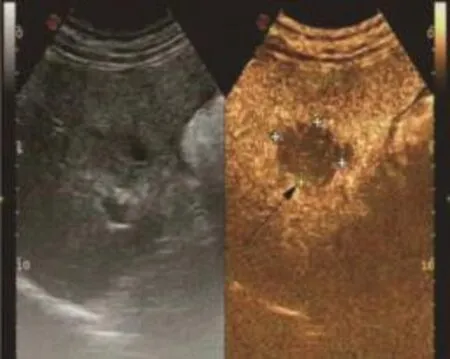
圖9 轉移性肝癌門靜脈期(見內文第88頁)
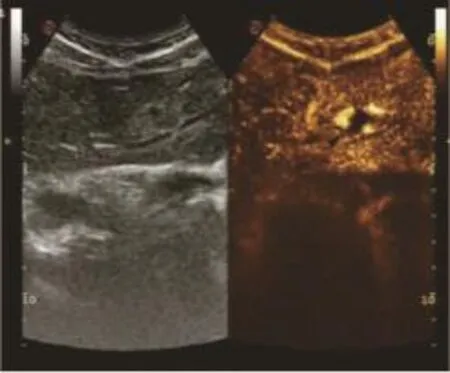
圖10 肝血管瘤動脈晚期(見內文第88頁)
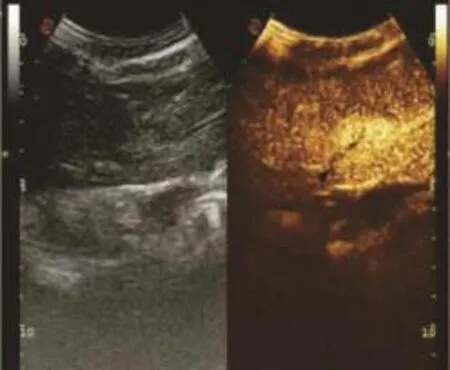
圖11 肝血管瘤門靜脈期(見內文第88頁)
R730.2
A
1673-9701(2015)06-0157-04
2014-09-24)

