缺氧誘導因子-1α在前列腺癌中的表達及意義
鮑小招 范廣民 吳忠明 吳忠標 毛祺琦 曾愛平 屈宏斐
1.溫州醫學院附屬溫嶺市醫院泌尿科,浙江溫嶺317500;2.浙江省臺州市中心醫院病理科,浙江臺州317000;3.浙江大學附屬第一醫院泌尿科,浙江杭州310000;4.溫州醫學院附屬溫嶺市醫院病理科,浙江溫嶺317500
缺氧誘導因子-1α在前列腺癌中的表達及意義
鮑小招1范廣民2吳忠明1吳忠標1毛祺琦3曾愛平4屈宏斐1
1.溫州醫學院附屬溫嶺市醫院泌尿科,浙江溫嶺317500;2.浙江省臺州市中心醫院病理科,浙江臺州317000;3.浙江大學附屬第一醫院泌尿科,浙江杭州310000;4.溫州醫學院附屬溫嶺市醫院病理科,浙江溫嶺317500
目的探討缺氧誘導因子-1α(HIF-1α)在前列腺癌發病機制中的作用。方法各取50例石蠟包埋的前列腺癌組織(前列腺癌組)和良性前列腺增生組織(良性前列腺增生組),采用免疫組化法測定兩組組織中HIF-1α蛋白的表達。結果前列腺癌組HIF-1α蛋白的陽性表達率和陽性表達強度均顯著高于良性前列腺增生組(依次為:74.00%vs 12.00%;OD值為0.17±0.04 vs 0.14±0.03)(P<0.01或P<0.05)。前列腺癌組HIF-1α蛋白的陽性表達率低分化高于高、中分化(87.10%vs 52.63%,P<0.05),在伴有骨/淋巴結轉移高于不伴有轉移(81.58%vs 50.00%,P<0.05),而與TNM分期(Ⅲ~Ⅳ期和Ⅰ~Ⅱ期)、年齡(>70歲和≤70歲)間差異無統計學意義(依次為:84.38%vs 66.67%;75.86%vs 71.43%)(P>0.05)。HIF-1α的陽性率在Gleason分級、TNM分期、骨及淋巴結轉移間兩兩呈直線正相關(n=37,r=0.735、0.710、0.734,P<0.01)。結論HIF-1α在前列腺癌組織中表達增強,其可能參與了前列腺癌的形成過程,增強表達的HIF-1α蛋白可能與前列腺癌的惡化有關,預示預后不良。
前列腺癌;前列腺增生;HIF-1α;發病機制
前列腺癌是最普遍的一種男性惡性腫瘤,也是世界上第二種引起男性死亡的癌癥,且不同種族間存在差異,同時受不同文化、社會、心理因素等影響[1]。其發病機制十分復雜,缺氧誘導因子-1α(hypoxia induciblefactor-1α,HIF-1α)是介導細胞對缺氧環境進行適應性反應的關鍵性轉錄調控因子,是血管發生的重要調節劑,在腫瘤的生長和轉錄中起著潛在的作用[2]。目前已發現患前列腺癌的風險與HIF-1α的基因多肽性相關,我國患者在rs11549467基因位點發生轉變,而以色列的前列腺癌患者與C1772T的基因位點突變有關[3,4]。近年來有報道認為HIF-1α可能在前列腺癌的惡變和預后中起關鍵的決定性作用[5,6],但其作用機制如何至今尚未完全闡明。本研究通過觀察HIF-1α在前列腺癌中的表達,探討HIF-1α與前列腺癌生物學特征的相關性,為臨床治療前列腺癌提供理論依據。
1 資料與方法
1.1一般資料
選擇臺州市各醫院2010年5月~2014年2月的前列腺癌住院手術患者50例(前列腺癌組),年齡59~82歲(平均71歲),標本均經術后病理確診。并以良性前列腺增生患者50例(良性前列腺增生組)作對照,年齡53~81歲(平均69歲),均經尿道前列腺電切除術留取增生前列腺組織。兩組組織標本經10%甲醛固定保存,兩組患者年齡比較差異無統計學意義(P>0.05)。
1.2試劑
鼠抗人HIF-1α單克隆抗體(生產批號ZM-0356)和二抗羊抗鼠免疫組化試劑盒及DAB底物顯色劑均購自福州邁新生物技術有限公司。HIF-1α抗體的工作濃度為1∶100。
1.3HIF-1α蛋白的檢測
采用SP法進行檢測,主要步驟如下:標本經10%甲醛固定、濃度梯度的乙醇脫水、石蠟包埋、4 μm厚度切片、脫蠟、抗原修復,3%過氧化氫滅活內源性過氧化物酶,兔血清封閉,滴加一抗4℃過夜、二抗及鏈霉素抗生物素蛋白-過氧化物酶復合物,DAB顯色、復染、封固。PBS代替一抗作為陰性對照。陽性表達細胞為綜黃色,表達定位在細胞漿和(或)細胞核。每張切片于隨機選擇5個視野(200倍),細胞陽性率計數方法為:無著色為(-),<30%記為+,30%~70%記為++,>70%記為+++;并對陽性細胞采用Image Pro-plus 5.1免疫組化圖像分析系統進行灰度掃描來表達其平均吸光強度,取其平均值代表該片的吸光度(OD)值。
1.4統計學處理
應用SPSS 16.0統計學軟件進行數據分析,計量資料以均數±標準差(x±s)表示,采用t檢驗,計數資料采用χ2檢驗,率的相關分析采用Pearson相關分析法,P<0.05為差異有統計學意義。
2 結果
2.1前列腺組織HIF-1α蛋白的表達水平
免疫組化結果顯示,陽性細胞呈棕黃色,主要表達在細胞質和(或)細胞核,兩組均有呈陽性表達的細胞。前列腺癌組HIF-1α蛋白的陽性率和平均吸光強度均顯著高于良性前列腺增生組(表1、圖1)。

表1 前列腺組織HIF-1α蛋白的表達水平

圖1 免疫組化法示HIF-1α蛋白呈陽性表達
2.2HIF-1α表達與前列腺癌臨床病理參數的關系
HIF-1α表達與前列腺癌Gleason分級、骨及淋巴結轉移差異有統計學意義(P<0.05),與年齡、TNM分期差異無統計學意義(P>0.05),見表2。
2.3臨床病理參數間HIF-1α陽性率的相關性
HIF-1α的陽性率在Gleason分級、TNM分期、骨及淋巴結轉移間兩兩呈直線正相關(n=37,r=0.735、0.710、0.734,P<0.01)。
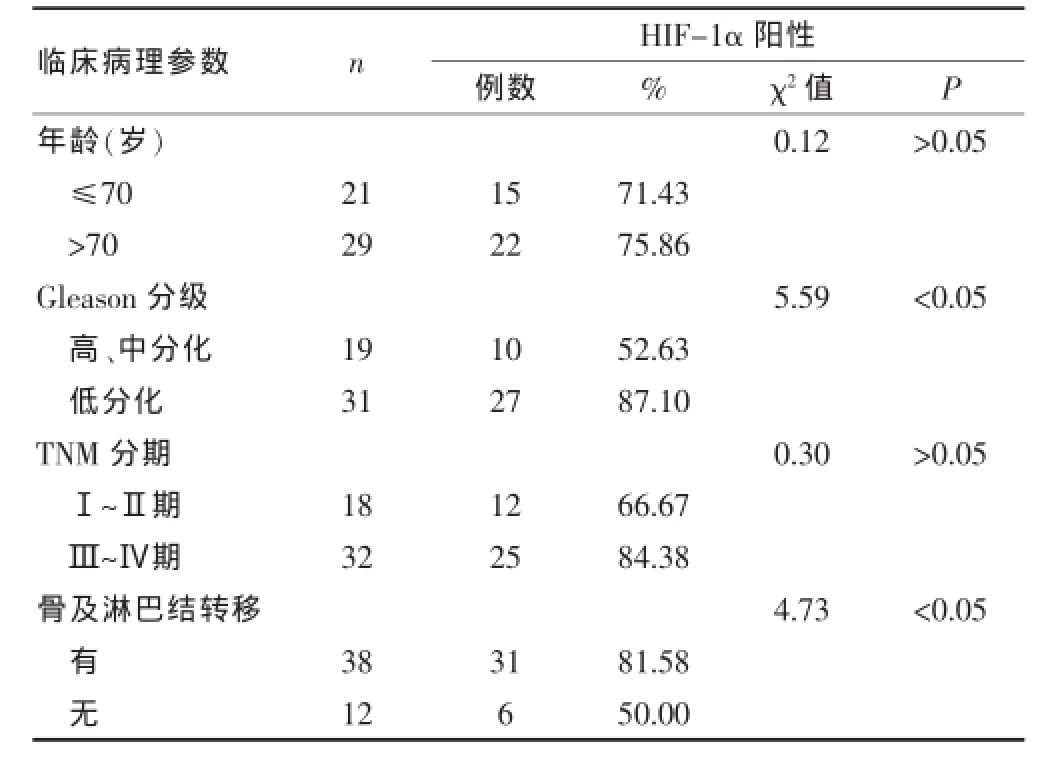
表2 HIF-1α蛋白的表達與前列腺癌臨床病理參數的關系
3 討論
HIF-1是一種轉錄因子,具有調節細胞活力、血管發生、凋亡、黏附和生長的作用。由α和β亞單位組成,其中α作為調節子亞單位,在HIF-1的轉錄活性中作為決定子,它受多種因素調節,包括氧張力、細胞因子和癌基因。HIF-1的蛋白活性與基因對低氧反應相互作用,HIF-1α已在多種癌組織表現為過度表達,通過HIF-1基因對低氧環境中增強癌組織的適應反應。基于HIF-1α和惡性腫瘤表型的相關性,抑制HIF-1α的表達成為一種癌癥重要的治療策略[7]。其治療機制可能是通過PI3K/Akt/TOR、MAPK、鞘氨基醇激酶1信號通路等途經[8,9]。
本研究發現,兩組前列腺組織中HIF-1α都有呈陽性表達的細胞,主要表達在細胞漿和(或)細胞核,增生組織的陽性表達率低,陽性強度也弱。前列腺癌組織的HIF-1α的陽性率高,達74.00%,與齊廣強等[10]的報道相近;HIF-1α的陽性率和陽性強度高于前列腺增生組,提示HIF-1α在前列腺癌組織中過度表達,參與了前列腺增生的癌變過程,推測它可能在前列腺癌發生、發展中起促進作用[11]。
本研究還發現,前列腺癌組HIF-1α的陽性率與Gleason分級、骨/淋巴結轉移相關。低分化前列腺癌HIF-1α的陽性率高于高、中分化,提示分化程度越低其陽性率越高。伴有骨/淋巴結轉移前列腺癌HIF-1α的陽性率高于不伴有癌細胞轉移,提示HIF-1α具有促進癌細胞轉移功能。陽性表達強度也與分化程度有關,高分化的前列腺腫瘤組織中HIF-1α的反應較弱,反之,低分化的前列腺癌組織免疫反應較強。但HIF-1α的陽性率與TNM分期、年齡無關,TNM分期在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期之間及年齡在≤70和>70歲之間HIF-1α的陽性率沒有差異,提示HIF-1α的表達與TNM分期、年齡的生物學特征方面沒有內在聯系。李偉等[12]研究發現,HIF-1α陽性表達率與前列腺癌的Gleason分級、TNM臨床分期、骨/淋巴結轉移有關,而與年齡無關,進一步支持HIF-1α的高表達預示預后不良。Miyazawa K等[13]也發現,HIF-1α在前列腺癌組織中表達陽性,但在增生和正常的腺體中卻呈陰性表達,其陽性表達強度與Gleason分級有關,Gleason分級積分越高表達越強。而另一項在前列腺癌活檢標本的研究發現,其中有32%的病例標本中HIF-1α呈強陽性表達,21%呈弱陽性表達,放療合并化療后HIF-1α表達水平下降,也認為HIF-1α與前列腺癌的預后相關[14]。本研究通過相關分析發現,HIF-1α的陽性率在前列腺癌組織的病理分級、TNM分期、骨/淋巴結轉移的關系中兩兩之間呈現直線正相關,進一步提示HIF-1α的高表達預示前列腺癌變預后不良。
綜上所述,HIF-1α在前列腺癌組織中表達增強,可能在腫瘤生物學行為方面扮演關鍵的角色,包括腫瘤細胞的增殖、移行、預后,抑制HIF-1α通路可能是抑制腫瘤進展的有效策略。
[1]Qinghu Ren,Jiaqian Liang,Jianjun Wei,et al.Epithelial and stromal expression of miRNAs during prostate cancer progression[J].Am J Transl Res,2014,6(4):329-339.
[2]Xu QR,Liu X,Yao YM,et al.Expression of HSP90 and HIF-1α in human colorectal cancer tissue and its significance[J].Asian Pac J Trop Med,2014,7(9):720-724.
[3]Li P,Cao Q,Shao PF,et al.Genetic polymorphisms in HIF1A are associated with prostate cancer risk in a Chinese population[J].Asian J Androl,2012,14(6):864-869.
[4]Vainrib M,Golan M,Amir S,et al.HIF1A C1772T polymorphism leads to HIF-1α mRNA over expression in prostate cancer patients[J].Cancer Biol Ther,2012,13(9):720-726.
[5]Huang X,Zhou J,Liu J,et al.Biological characteristics of prostate cancer cells are regulated by hypoxia-inducible factor 1α[J].Oncol Lett,2014,8(3):1217-1221.
[6]Shang W,Chen X,Nie L,et al.MiR199b Suppresses expression of hypoxia-inducible factor 1α(HIF-1α)in prostate cancer cells[J].Int J Mol Sci,2013,14(4):8422-8436.
[7]Huang X,Zhou J,Liu J,et al.Biological characteristics of prostate cancer cells are regulated by hypoxia-inducible factor 1α[J].Oncol Lett,2014,8(3):1217-1221.
[8]Cho SY,Cho S,Park E,et al.Coumestrol suppresses hypoxia inducible factor 1α by inhibiting ROS mediated sphingosine kinase 1 in hypoxic PC-3 prostate cancer cells[J].Bioorg Med Chem Lett,2014,24(11):2560-2564.
[9]Befani CD,Vlachostergios PJ,Hatzidaki E,et al.Bortezomib represses HIF-1α protein expression and nuclear accumulation by inhibiting both PI3K/Akt/TOR and MAPK pathways in prostate cancer cells[J].J Mol Med(Berl),2012,90(1):45-54.
[10]齊廣強,郝利芬,路喜安.缺氧誘導因子-1αKi-67在前列腺癌中的表達及意義[J].山西醫藥雜志,2007,36(11):973-974.
[11]Shaida N,Chan P,Turley H,et al.Nuclear localization of factor inhibitor hypoxia-inducible factor in prostate cancer is associated with poor prognosis[J].J Urol,2011,185(4):1513-1518.
[12]李偉,張華東,李自強,等.VEGF、HIF-1α在不同前列腺病變組織中的表達及臨床意義[J].解放軍醫藥雜志,2012,24(5):11-13.
[13]Miyazawa K,Tanaka T,Nakai D,et al.Immunohistochemical expression of four different stem cell markers in prostate cancer:High expression of NANOG in conjunction with hypoxia-inducible factor-1α expression is involvedinprostateepithelialmalignancy[J].OncolLett,2014,8(3):985-992.
[14]Al-Ubaidi FL,Schultz N,Egevad L,et al.Castration therapy of prostate cancer results in downregulation of HIF-1α levels[J].Int J Radiat Oncol Biol Phys,2012,82(3):1243-1248.
Expression and significance of hypoxia inducible factor(HIF)-1α in prostatic cancer
BAO Xiaozhao1FAN Guangmin2WU Zhongming1WU Zhongbiao1MAO Qiqi3ZENG Aiping4QU Hongfei1
1.Department of Urology,Wenlin Hospital Affiliated to Wenzhou Medical College,Wenling317500,China;2.Department of Pathology,Taizhou Central Hospital in Zhejiang Province,Taizhou317000,China;3.Department of Urology, the First Affiliated Hospital of Zhejiang University,Hangzhou310000,China;4.Department of Pathology,Wenlin Hospital Affiliated to Wenzhou Medical College,Wenling317500,China
Objective To investigate the potential roles of hypoxia inducible factor(HIF)-1α in the pathogenesis of prostatic cancer.Methods HIF-1α protein were detected by immunohistochemistry techniques and analyzed in each 50 paraffin-embedded prostatic cancer and benign prostatic hyperplasia samples,named prostatic cancer group and benign prostatic hyperplasia group respectively.Results The positive expression rate and expression levels of HIF-1α in prostatic cancer group were significantly higher than those in benign prostatic hyperplasia group(74.00%vs 12.00%;optical density 0.17±0.04 vs 0.14±0.03,respectively)(P<0.01 or P<0.05).Moreover,the positive expression rate of HIF-1α in prostatic cancer group with low differentiation and bone/lymph nodes metastasis were significantly higher than those with high or mode rate differentiation and without bone/lymph nodes metastasis(87.10%vs 52.63%;81.58%vs 50.00%, respectively)(P<0.05).Whereas,there was no statistic significance of HIF-1α positive reaction betweenⅢ-ⅣandⅠ-ⅡTNM grade or between>70 and≤70 age(84.38%vs 66.67%;75.86%vs 71.43%,respectively)(P>0.05).Furthermore,the positive expression rate of HIF-1α in prostatic cancer among Gleason score and TNM grade and bone/lymph nodes metastasis were positive correlated(n=37,r=0.735,0.710,0.734,P<0.01).Conclusion The result shows that levels of HIF-1α expression are elevated at prostatic cancer tissue.These findings indicate that the HIF-1α system changes as prostate tissue progresses from a hyperplasia to a malignant state.Differential expression of certain HIF-1α system components in prostatic cancer may be associated with the malignant phenotype and more aggressive tumor behavior.Hence HIF-1α could serve to predict the harmful outcome of prostatic cancer.
Prostatic cancer;Prostatic hyperplasia;Hypoxia inducible factor-1α;Pathogenesis
R737.25
A
1673-9701(2015)07-0001-03
國家自然科學基金(81101717);浙江省溫嶺市科技計劃項目(2010-1-53)
(2014-09-11)

