血管迷走性暈厥患者的心率減速力和心率變異性特征
孫巍,鄭黎暉,姚焰,翁智遠,喬宇,侯炳波,吳靈敏,郭金銳,張澍
血管迷走性暈厥患者的心率減速力和心率變異性特征
孫巍,鄭黎暉,姚焰,翁智遠,喬宇,侯炳波,吳靈敏,郭金銳,張澍
目的: 通過心率減速力和心率變異性檢測定量評估血管迷走性暈厥患者異常的迷走神經張力。
方法:選取2013-06至2014-08于我科就診的直立傾斜試驗結果為陽性的血管迷走性暈厥患者28例為血管迷走性暈厥組,以30例門診就診的無心血管系統異常的患者為對照組,行心率減速力和心率變異性檢查。
結果:(1)血管迷走性暈厥組患者全天心率減速力[(9.4 ± 2.9) ms]和晝間心率減速力[(8.9 ± 2.9) ms]高于對照組全天心率減速力[(7.5 ± 2.5) ms]和晝間心率減速力[(7.5 ± 2.5) ms],差異有統計學意義(P<0.05);(2)血管迷走性暈厥組晝夜心率減速力比值>1者比例高于對照組(32.1% vs 6.7%,P=0.019);(3) 血管迷走性暈厥組心率變異性指標總體標準差(SDNN)[(139.8 ± 34.0) ms]、差值的標準差(SDSD) [(29.9 ± 15.7) ms]、差值的均方根(rMSSD)[(40.9 ± 18.8) ms]均高于對照組SDNN[(115.5 ± 29.4) ms]、SDSD[(21.8 ± 6.6) ms]、rMSSD[(28.9 ± 8.4) ms],差異有統計學意義(P<0.05);(4) 多元Logistic回歸分析提示,全天心率減速力同暈厥發作呈正相關(比值比=2.045,95%可信區間1.100~3.801,P=0.024)。
結論: 血管迷走性暈厥患者心率減速力和心率變異性指標異常升高,心率減速力是暈厥發作的預測因子。
血管迷走性暈厥;迷走神經;心率減速力;心率變異性
Methods: Our research included 2 groups: VVS group, n=28 patients with positive head-up tilt test treated in our hospital from 2013-06 to 2014-08 and Control group, n=30 patients without cardiovascular disorders. The DC and HRV were examined and compared between 2 groups.
Results: ① The overall deceleration capacity (ODC) (9.4 ± 2.9) ms and daytime deceleration capacity (DDC) (8.9 ± 2.9) ms in VVS group were higher than those in Control group (7.5 ± 2.5) ms and (7.5 ± 2.5) ms respectively, P<0.05.② More patients in VVS group presented daytime-to-nighttime deceleration capacity ratio (DNratio) >1 than those in Control group (9/28, 32.1% vs 2/30, 6.7%), P=0.019. ③ The SDNN (139.8 ± 34.0) ms, SDSD (29.9 ± 15.7) ms and rMSSD (40.9 ± 18.8) ms in VVS group were higher than those in Control group, (115.5 ± 29.4) ms, (21.8 ± 6.6) ms and (28.9 ± 8.4) ms respectively, P<0.05.④ Multivariate Logistic regression analysis indicated that ODC was positively related to vasovagal syncope occurrence (OR=2.045, 95% CI: 1.100-3.801, P=0.024).
Conclusion: VVS patients have abnormally increased indexes of DC and HRV, HDC is the predictor for vasovagal syncope occurrence.
(Chinese Circulation Journal, 2015,30:1067.)
血管迷走性暈厥是最常見的暈厥類型,累及約1%的人群[1,2]。通常由疼痛、恐懼、血管穿刺等因素誘發,患者在短暫的血壓、心率上升之后,由于自身異常的迷走神經過度激活,導致心率減慢、血壓降低,伴有出汗、惡心、嘔吐等,同時由于腦灌注不足引起意識喪失,出現暈厥,因此異常活躍的迷走神經在血管迷走性暈厥的發病機制中扮演著重要角色[3]。心率減速力由Bauer等[4]于2006年首次提出,該檢測通過對長時程竇性R-R間期的分析,借助位相整序信號平均技術,可以定量整體評估支配心臟的迷走神經張力。心率變異性(HRV)是臨床常用于心臟自主神經功能檢查的指標。本研究通過分析血管迷走性暈厥患者的心率減速力和心率變異性,定量評估迷走神經活動異常在血管迷走性暈厥發病機制中的作用。
1 資料與方法
研究對象: 入選2013-06至2014-08于我科就診的直立傾斜試驗結果為陽性的血管迷走性暈厥患者28例為血管迷走性暈厥組,患者在入選前發作暈厥>3次,且半年內至少發作過1次暈厥。直立傾斜試驗陽性診斷標準:(1)收縮壓≤80 mmHg(1 mmHg=0.133 kPa)和(或)舒張壓≤ 50 mmHg,或平均動脈壓下降超過25%;(2)心率< 50 次/min或出現竇性停搏、Ⅱ度及以上房室傳導阻滯、交界性異搏或持續≥3 s的心臟停搏[5]。同時入選30例門診就診的無心血管系統異常及暈厥病史的患者為對照組。排除體位性低血壓、頸動脈竇過敏綜合征、病態竇房結綜合征、主動脈縮窄、肺動脈高壓、肥厚梗阻型心肌病、癲癇、短暫性腦缺血發作、鎖骨下竊血綜合征和藥物誘發性暈厥、6個月內的急性心肌梗死、紐約心臟協會(NYHA)心功能Ⅱ級及以上的心力衰竭和糖尿病患者,以及其他器質性疾病所致的暈厥。
心率減速力檢測:采用心電監測系統(MIC-12H,Jinke Medical,中國),通過位相整序信號平均技術(phase-rectified signal averaging techinique,PRSA)[4]對獲得的患者24小時動態心電圖進行如下分析:(1)將24小時動態心電圖獲得的所有竇性R-R間期依次展開,將R-R間期長于前一個R-R間期者定義為減速周期并作標志;(2)以每一個減速點前15個R-R間期和后15個R-R間期作為固定的心率段,依次確定所有的心率段;(3)將所有的心率段進行疊加,進行信號平均,X0定義為所有中心點的R-R間期的平均值,X1定義為中心點右側的第一個R-R間期的平均值,X-1和X-2定義為中心點左側第一個和第二個R-R間期的平均值;(4)根據公式計算心率減速力,心率減速力=[X0+X1-X-1-X-2]/4,定義5:00至23:00為夜間時間,計算全天心率減速力、晝間心率減速力和夜間心率減速力,并計算晝夜心率減速力比值(晝間心率減速力/夜間心率減速力)。
長時程心率變異性時域分析:使用心電監測系統(MIC-12H,Jinke Medical)采集患者24小時的心電信號,經計算機軟件和人工分析,剔除所有非竇性QRS波成分,再經軟件計算竇性QRS波的總體標準差(SDNN)、差值的均方根(rMSSD)和差值的標準差(SDSD)。
統計學處理:使用SPSS19.0軟件對資料進行統計學分析,計量資料以均數 ± 標準差表示,計數資料以百分率表示。符合正態分布的計量資料使用t檢驗進行組間比較,非正態分布的計量資料使用非參數檢驗進行組間比較,計數資料通過卡方檢驗進行統計分析。暈厥發作的多因素分析采用Logistic回歸分析。P<0.05為差異有統計學意義。
2 結果
2.1 血管迷走性暈厥組患者與對照組患者基線資料分析(表1)
血管迷走性暈厥組患者平均年齡為(37.7 ± 13.9)歲,其中女性占60.7%(17/28)。與對照組相比,血管迷走性暈厥組患者全天心率減速力、晝間心率減速力、SDNN、SDSD和rMSSD均顯著增高,差異有統計學意義(P<0.05);血管迷走性暈厥組患者夜間心率減速力較對照組有增高趨勢[(11.3 ± 4.2 )ms vs (9.5 ± 3.9) ms,P=0.100]。根據晝夜心率減速力比值劃分,晝夜心率減速力比值>1的患者血管迷走性暈厥組[32.1%(9/28)]高于對照組[6.7%(2/30)], 差異有統計學意義(P=0.019)。此外,血管迷走性暈厥組患者基線時最慢心率和收縮壓低于對照組,差異有統計學意義(P<0.05)。兩組患者在性別、年齡、身高、體重、體重指數、最大心率、平均心率、舒張壓、左心房前后徑、左心室舒張末徑、左心室射血分數等組間比較差異無統計學意義 (P>0.05)。
表1 血管迷走性暈厥組和對照組患者基本資料比較

表1 血管迷走性暈厥組和對照組患者基本資料比較
注:1 mmHg=0.133 kPa
?
2.2 暈厥發作相關因素的多因素回歸分析(表2)
兩組患者在性別、年齡、身高、體重、體重指數、最大心率、平均心率、舒張壓、左心房前后徑、左心室舒張末徑、左心室射血分數等指標方面無組間差異,故不進入回歸分析。以暈厥有無發作為因變量,全天心率減速力、晝間心率減速力、晝夜心率減速力比值、SDNN、SDSD、rMSSD、最慢心率、收縮壓等指標經過共線性分析后,以全天心率減速力、SDNN、晝夜心率減速力比值、最慢心率、收縮壓為自變量進行Logistic回歸分析,單變量分析提示全天心率減速力、SDNN、晝夜心率減速力比值、最慢心率與暈厥發作相關(P均<0.05),經多變量分析后,僅全天心率減速力同暈厥發作相關(比值比=2.045,95%可信區間 1.100~3.801,P=0.024),其余變量差異無統計學意義(P>0.05)。
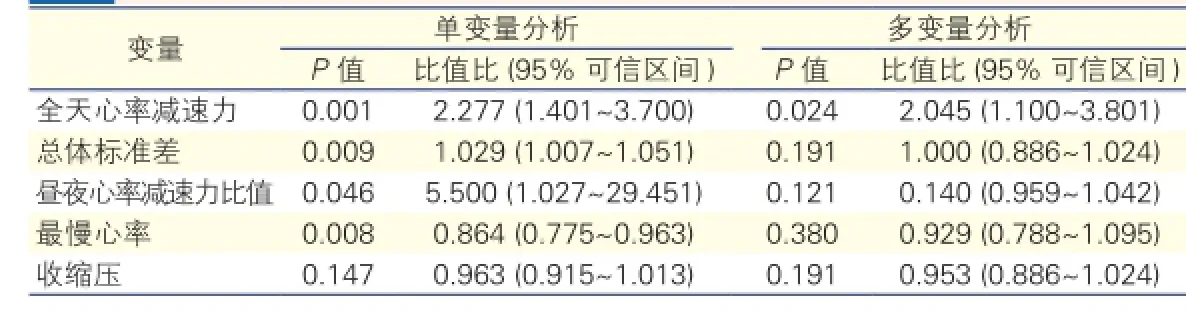
表2 暈厥發作的Logistic回歸分析
3 討論
心臟的神經支配系統包括交感神經和迷走神經,在血管迷走性暈厥患者中,過度激活的迷走神經通過減低周圍血管阻力和對心臟的負性變時、變力、變傳導作用,過度降低患者血壓,當腦灌注壓低于80 mmHg時,即可因腦灌注不足引發黑朦甚至暈厥。根據Kawano等[6]對離體人心臟的解剖研究,心房區域迷走神經纖維和交感神經纖維的分布比為1.3~1.6:1,且迷走神經纖維在心內膜下的分布更加致密。同時,本中心前期采用左心房心內膜下消融迷走神經節叢術式治療血管迷走暈厥,在(30±16)個月的隨訪期內無一例患者再發暈厥[7]。解剖學和臨床研究均提示迷走神經可能在血管迷走性暈厥的發作過程中占主導地位。
直立傾斜試驗在血管迷走性暈厥診斷中有重要作用,但是作為針對不同體位下患者癥狀、血壓、心率的變化來間接反映自主神經調節功能的定性檢查,直立傾斜試驗同時受假陽性率高、重復性差等困擾[8,9]。而且,根據既往的研究結果,直立傾斜試驗診斷血管迷走性暈厥的陽性率也不一致,對于典型血管迷走性暈厥的診斷陽性率為65%到92%不等[10,11],而對于不典型者診斷陽性率可低至47%[12]。此外,直立傾斜試驗診斷血管迷走性暈厥結果還受到年齡和性別的影響[13]。發展新型迷走張力評估指標是進一步完善診斷的需要。
心率減速力指標最早由Schmidt等于2006年報道, 其早期應用于急性心肌梗死患者風險評估,心率減速力越低者,提示迷走神經對于交感神經興奮的調節性越差,患者交感電風暴、室性心動過速、心室顫動等致死性事件發病風險增高[14-16]。隨后心率減速力被迅速應用到多個領域。Schneider等[17]發現暴露于環境污染物中的冠心病患者心率減速力持續性下降,提示其迷走神經調節能力可受環境影響而降低。Graatsma 等[18]則通過測量胚胎的心率減
速力評估其心臟神經系統發育情況,進一步反映胎兒是否有宮內發育受限。在電生理領域,Bauer等[19]曾對接受肺靜脈隔離術式的陣發性心房顫動患者進行減速力測量,基線心率減速力為(5.7±2.1) ms,消融后心率減速力顯著下降至(3.3±1.8)ms,且此迷走神經張力變化可至少維持至術后1年。據我們所知,目前尚未有心率減速力用于血管迷走性暈厥患者評估的研究報道。
本研究中,血管迷走性暈厥患者表現的心率減速力指標(全天心率減速力、晝間心率減速力)均高于對照組患者,首次定量證實了此類患者異常增高
的迷走神經張力。SDNN、rMSSD等觀察心率減慢的心率變異性指標在血管迷走性暈厥患者中也較高,同之前報道的研究相符[20]。此外,正常情況下,夜間應以迷走神經支配為主,迷走神經在夜間的活躍程度應高于白天,但在血管迷走性暈厥群體中,異常的迷走神經調節能力可能打亂常規現象,甚至可能出現晝間迷走神經張力超過夜間張力的情況,而本研究中晝夜心率減速力比值指標在兩組間明確的分布差異(32.1% vs 6.7%,P=0.019)進一步支持了假設,從另一方面支持了血管迷走性暈厥患者中存在迷走神經功能障礙。
綜上所述,血管迷走性暈厥患者心率減速力和心率變異性指標異常增高,心率減速力檢測可定量評估迷走神經張力,異常活躍的迷走神經調節在其發病機制中占主要作用。
[1] Moya A, Sutton R, Ammirati F, et al. Guidelines for the diagnosis and management of syncope (version 2009). Eur Heart J, 2009, 21: 2631-2671.
[2] Grubb BP. Clinical practice. Neurocardiogenic syncope. N Engl J Med, 2005, 10: 1004-1010.
[3] Medow MS, Stewart JM, Sanyal S, et al. Pathophysiology, diagnosis, and treatment of orthostatic hypotension and vasovagal syncope. Cardiol Rev, 2008, 1: 4-20.
[4] Axel Bauer JWK, Bunde A, Barthel P, et al. Phase-rectified signal averaging detects quasi-periodicities in non-stationary data. Physica A, 2006, 423-434.
[5] 任自文, 吳寧, 陳孟揚, 等. 傾斜試驗用于診斷血管迷走性暈厥的建議. 中華心血管病雜志, 1998, 5: 325-327.
[6] Kawano H, Okada R, Yano K. Histological study on the distribution of autonomic nerves in the human heart. Heart Vessels, 2003, 1: 32-39.
[7] Yao Y, Shi R, Wong T, et al. Endocardial autonomic denervation of the left atrium to treat vasovagal syncope: an early experience in humans. Circ Arrhythm Electrophysiol, 2012, 2: 279-286.
[8] Sutton R, Brignole M. Twenty-eight years of research permit reinterpretation of tilt-testing: hypotensive susceptibility rather than diagnosis. Eur Heart J, 2014, 33: 2211-2212.
[9] Sheldon R. Tilt testing for syncope: a reappraisal. Curr Opin Cardiol, 2005, 1: 38-41.
[10] Furukawa T, Maggi R, Solano A, et al. Effect of clinical triggers on positive responses to tilt-table testing potentiated with nitroglycerin or clomipramine. Am J Cardiol, 2011, 11: 1693-1697.
[11] Petix NR, Del Rosso A, Furlan R, et al. Nitrate-potentiated headup tilt testing (HUT) has a low diagnostic yield in patients with likely vasovagal syncope. Pacing Clin Electrophysiol, 2014, 2: 164-172.
[12] Ungar A, Sgobino P, Russo V, et al. Diagnosis of neurally mediated syncope at initial evaluation and with tilt table testing compared with that revealed by prolonged ECG monitoring. An analysis from the Third International Study on Syncope of Uncertain Etiology (ISSUE-3). Heart, 2013, 24: 1825-1831.
[13] 姜雪, 劉悅, 劉俊, 等. 年齡和性別對直立傾斜試驗診斷血管迷走性暈厥結果的影響. 中國循環雜志, 2014, 9: 706-709.
[14] Bauer A, Barthel P, Schneider R, et al. Improved Stratification of Autonomic Regulation for risk prediction in post-infarction patients with preserved left ventricular function (ISAR-Risk). Eur Heart J, 2009, 5: 576-583.
[15] Bauer A, Kantelhardt JW, Barthel P, et al. Deceleration capacity of heart rate as a predictor of mortality after myocardial infarction: cohort study. Lancet, 2006, 9523: 1674-1681.
[16] 盧秋蓓, 王勝煌. 心率減速力檢測及其對心肌梗死后患者猝死風險的預警價值. 中國循環雜志, 2013, 6: 472-474.
[17] Schneider A, Hampel R, Ibald-Mulli A, et al. Changes in deceleration capacity of heart rate and heart rate variability induced by ambient air pollution in individuals with coronary artery disease. Part Fibre Toxicol, 2010, 7: 29.
[18] Graatsma EM, Mulder EJ, Vasak B, et al. Average acceleration and deceleration capacity of fetal heart rate in normal pregnancy and in pregnancies complicated by fetal growth restriction. J Matern Fetal Neonatal Med, 2012, 12: 2517-2522.
[19] Bauer A, Deisenhofer I, Schneider R, et al. Effects of circumferential or segmental pulmonary vein ablation for paroxysmal atrial fibrillation on cardiac autonomic function. Heart Rhythm, 2006, 12: 1428-1435.
[20] Shim SH, Park SY, Moon SN, et al. Baseline heart rate variability in children and adolescents with vasovagal syncope. Korean J Pediatr, 2014, 4: 193-198.
Characteristics of Deceleration Capacity and Heart Rate Variability in Patients With Vasovagal Syncope
SUN Wei, ZHENG Li-hui, YAO Yan, WENG Zhi-yuan, QIAO Yu, HOU Bing-bo, WU Ling-min, GUO Jin-rui, ZHANG Shu.
Center of Arrhythmia, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
Objective: To quantitatively evaluate the abnormal tense of parasympathetic nerve via measuring the heart rate deceleration capacity (DC) and heart rate variability (HRV) in patients with vasovagal syncope (VVS).
Vasovagal syncope; Parasympathetic nerve; Deceleration capacity; Heart rate variability
2015-03-06)
(編輯:漆利萍)
首都臨床特色應用研究 (編號:Z121107001012014)
100037 北京市,北京協和醫學院 中國醫學科學院 國家心血管病中心 阜外醫院 心律失常中心(孫巍、鄭黎暉、姚焰、喬宇、侯炳波、吳靈敏、郭金銳、張澍),福建醫科大學附屬第一醫院 心血管內科(翁智遠)
孫巍 博士研究生 主要研究方向為心律失常疾病診斷及射頻消融治療 Email: sunwei_pumc@hotmail.com 通訊作者:姚焰
Email: ianyao@263.net.cn
R54
A
1000-3614(2015)11-1067-04
10.3969/j.issn.1000-3614.2015.11.009

