原發性肝癌患者外周血輔助性T細胞17及白介素17水平的臨床意義
雷林瑜,陸鵬,解寒冰,余江濤,李道明
(1.河南省鄭州人民醫院普通外科,河南 鄭州,450003;2.鄭州大學第一附屬醫院病理科,河南 鄭州 450052)
·臨床論著·
原發性肝癌患者外周血輔助性T細胞17及白介素17水平的臨床意義
雷林瑜1,陸鵬1,解寒冰1,余江濤1,李道明2
(1.河南省鄭州人民醫院普通外科,河南 鄭州,450003;2.鄭州大學第一附屬醫院病理科,河南 鄭州 450052)
目的觀察原發性肝癌(PHC)患者外周血中輔助性T細胞17(Th17)與細胞因子白介素17(IL-17)的分泌水平,探討Th17細胞及IL-17與PHC病理發展的關系。方法選取PHC患者80例以同期40例健康體檢健康者作為對照組,收集兩組的外周血后采用流式細胞術檢測Th17細胞亞群的比例,ELISA法檢測血清中的IL-17水平,RT-PCR檢測轉錄因子RORγT mRNA水平,并分析RORγT表達水平與PHC臨床病理學特征的關系。結果PHC患者外周血中Th17占CD4+T細胞比例為(4.09±0.33)%,顯著高于對照組(1.38±0.27)%,差異有統計學意義(P<0.05);PHC患者外周血中IL-17水平為(57.73±6.21)pg/ml,顯著高于對照組(33.98±4.47)pg/ml,差異有統計學意義(P<0.05);PHC患者外周血轉錄因子RORγT mRNA水平顯著高于對照組,差異有統計學意義(P<0.001)。肝癌組織中RORγT mRNA的表達水平與肝癌組織Edmondson病理分級顯著相關(r=0.685,P<0.05),且外周血中RORγT mRNA表達水平與HCC分化程度顯著正相關(r=0.603,P<0.05)。結論Th17及IL-17及轉錄因子RORγT mRNA水平在PHC患者外周血表達增加,且RORγT與PHC的病理分級程度明顯相關。
肝癌;RORγT;輔助性T細胞17;白介素17
原發性肝癌(primary hepatic carcinoma,PHC)是世界上最常見的5大惡性腫瘤之一,常發生于肝細胞和肝內膽管上皮細胞,其中90%以上為肝細胞性肝癌(hepatocellular carcinoma,HCC)[1]。由于其手術為主的綜合治療效果不理想,近年來,免疫學治療肝細胞性肝癌越來越受到臨床的重視。
初始CD4+T細胞在不同的抗原作用下可以活化分化為不同的細胞亞型,主要包括Th1、Th2、Th17、Treg等細胞群[2]。其中,輔助性T細胞17(T helper cell17,Th17)是一群以分泌白介素17(interleukin 17,IL-17)為主要特征的細胞,它在類風濕性關節炎、炎性腸病、系統性紅斑狼瘡等疾病中發揮著重要的作用[3-5]。此外,Th17細胞在動脈粥樣硬化、移植排斥反應中亦發揮著極其重要的功能[6-7]。然而,Th17及分泌的IL-17與PHC的關系尚少有研究。因此,本研究旨在觀察PHC患者Th17細胞及其分泌的因子IL-17的水平,探討RORγT在PHC患者的病理中可能發揮的功能。
1 材料與方法
1.1 臨床資料
選擇2010年1月-2013年12月在鄭州人民醫院確診為PHC患者80例為肝癌組,選取同期40例健康體檢健康者作為對照組。研究組中,男43例,女37例,年齡62~76歲,平均(63.13±7.21)歲;對照組男21例,女19例,年齡59~79歲,平均(62.28± 7.85)歲。兩組患者的一般資料如性別、年齡等方面差異無統計學意義(P>0.05),具有可比性。PHC患者術前均未行放射、化療及射頻消融治療,組織標本經術后病理學證實為肝細胞癌。所有標本于術中離體30 min內取材,經10%福爾馬林溶液固定,石蠟包埋、切片備用。PHC組織根據Edmondson標準分級[5]:Ⅰ級16例,Ⅱ級24例,Ⅲ級22例,Ⅳ級18例。
1.2 主要試劑
大鼠抗人CD3e-APC、大鼠抗人CD4-FITC、大鼠抗人IL-17-PE等流式抗體均購自Biolegend公司。破膜固定劑(Fix/Perm Cell Permeabilization Kit)購自上海英駿公司。蛋白質轉運抑制劑(Golgi Stop)購自BD公司。淋巴細胞培養用的不完全1640培養液、胎牛血清以及青霉素-鏈霉素(武漢博士德公司)按照89∶10∶1比例配制成完全1640培養液。RNA提取試劑試劑Trizol購于美國Gibco公司,逆轉錄試劑盒購自Femantes公司。
1.3 方法
分別于清晨抽取PHC患者以及正常對照組人群的空腹血,按以下方法處理:
1.3.1 流式染色Th17細胞:外周血紅細胞裂解后以完全1640培養液調節濃度至1×106細胞/ml。在反應體系中加入0.8μg/ml PMA、40μg/ml離子霉素及1μl/ml Golgistop,置37℃、5%二氧化碳培養箱中培養6 h。然后用3 ml PBS洗1遍并重懸于100μl PBS中,加入CD3e-APC(0.08 mg/ml)和CD4-FITC(0.4 mg/ml)抗體,混勻后置于室溫避光孵育20 min。以3 ml PBS洗1遍,加入100μl Fix/Perm A液并于室溫避光孵育20 min。離心清洗后加入100μl Fix/Perm B液重懸細胞后,再加入抗IL-17-PE(0.1 mg/ml)抗體,置4℃避光孵育30 min。以PBS緩沖液洗1遍后,以500μl PBS緩沖液重懸細胞后用流式細胞儀(FACS Calibur,美國BD公司)檢測。
1.3.2 ELISA及RT-PCR法檢測血清中IL-17水平清晨空腹時抽取各實驗對象外周靜脈血5 ml,加入EDTA抗凝劑,2h內于4℃,4000g,離心20min,離心后提取上層血清備用。IL-17的ELISA試劑盒購自eBioscience公司,檢測流程嚴格按照試劑盒的說明書進行操作。
取約200μl血漿,加入1 ml Trizol(南京生興公司)充分勻漿后,按照說明書的要求抽提總RNA,所得RNA溶于20μl DEPC處理水。提取的總RNA經紫外分光光度計進行定量。進一步采用Femantes逆轉錄試劑盒對所得RNA逆轉錄成cDNA,置于-20℃冰箱冷凍保存備用。采用RT-PCR法檢測外周血中轉錄因子RORγT。PCR反應條件:94℃變性5 min后擴增40個循環,循環參數為:94℃變性30 s,57℃退火30 s,72℃延伸30 s,最后72℃延伸7 min。RORγT引物序列:F:5'-GCAATGGAAGTGGTGCTG GTT-3',R:5'-AGGATGCTTTGGCGATGAGTC-3';內參GAPDH引物序列:F:5'-ATCTGGCACCACACCTT C-3',R:5'-AGCCAGGTCCAGACGCA-3'。采用ABI公司的7900型號Real-Time PCR儀器進行PC分析,結果采用2-ΔΔCt法進行相對定量分析。
1.4 統計學方法
采用SPSS 17.0軟件進行數據分析,計量資料用均數±標準差(±s)表示,組間比較用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 PHC患者與正常人群外周血Th17水平比較
對照組人群中外周血中Th17比例為(1.38± 0.27)%,顯著低于PHC患者的(4.09±0.33)%,差異有統計學意義(t=11.57,P=0.000),提示外周血Th17細胞的增加可作為原發性肝癌患者的預測指標。見圖1A、1B。

圖1 兩組人群外周血Th17細胞比較
2.2 PHC患者與正常人群血清中IL-17水平比較
進一步對Th17分泌的IL-17水平進行檢測,結果發現,對照組外周血中IL-17水平為(33.98± 4.47)pg/ml,顯著低于PHC患者外周血中的(57.73± 6.21)pg/ml,差異有統計學意義(t=21.54,P=0.000),提示IL-17在PHC患者的發病發展中可能發揮重要的作用。見圖2。
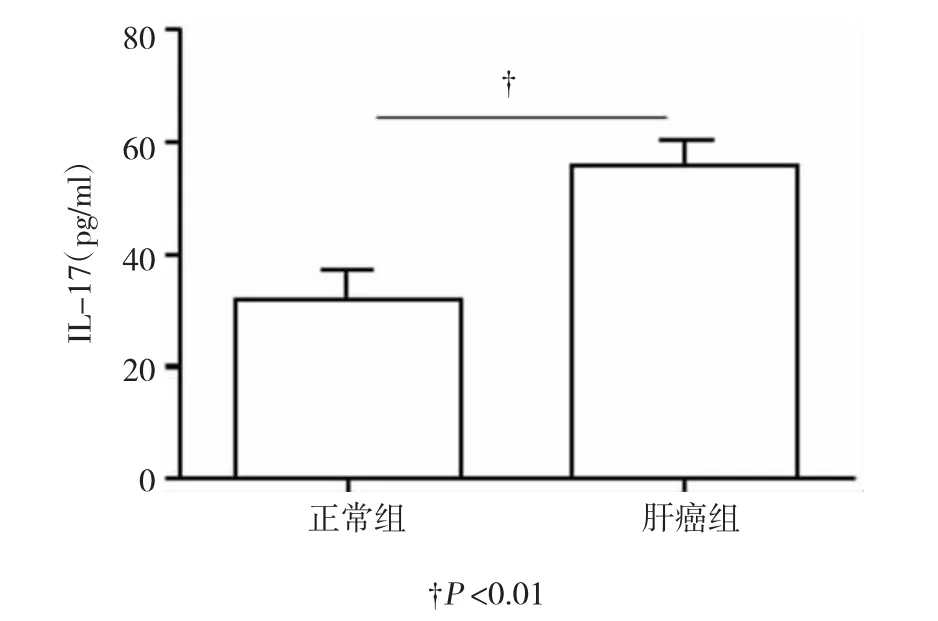
圖2 兩組人群外周血中IL-17的表達水平
2.3 PHC患者與正常人群血中轉錄因子RORγT mRNA水平比較
PHC患者外周血轉錄因子RORγT mRNA水平(4.43±0.89)顯著高于對照組人群(1.23±0.28),差異有統計學意義(t=16.74,P=0.000),表明PHC患者外周血中Th17水平升高可能是由于轉錄因子RORγT mRNA水平增加所致。見圖3。
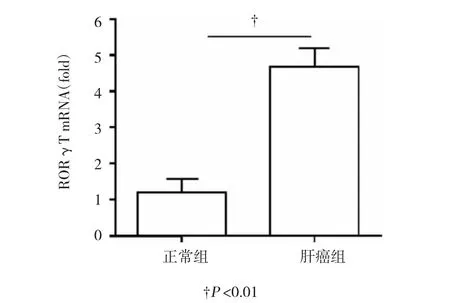
圖3 兩組患者外周血中轉錄因子RORγT mRNA水平
2.4 PHC患者組織及血中轉錄因子RORγT表達水平與肝癌組織病理分級的相關性
相關分析結果顯示肝癌組織中RORγT mRNA表達水平與PHC分化程度正相關(r=0.685,P= 0.02);外周血中RORγT mRNA表達水平亦與HCC分化程度正相關(r=0.603,P=0.03)。見附表。
附表 PHC組織、血漿中RORγT mRNA表達與HCC分化程度的關系(±s)

附表 PHC組織、血漿中RORγT mRNA表達與HCC分化程度的關系(±s)
HCC分級n肝癌組織血漿Ⅰ162.27±1.262.97±1.42Ⅱ243.29±1.353.75±1.48Ⅲ224.49±1.214.49±1.37Ⅳ186.51±1.175.82±1.61
3 討論
原發性肝癌是世界上最常見、惡性程度極高的腫瘤之一。研究認為PHC的發病率在世界上排名第5位,死亡率排在第3位,如果患者得不到有效的治療,生存期一般為3~6個月[8]。肝癌患者體內的細胞免疫功能對控制肝癌的發生和發展有著極其重要的意義[9-10]。Th17細胞是CD4+T細胞中一種重要的亞群,大量的研究表明,Th17在酒精性肝病、非酒精性肝病以及自身免疫性疾病中發揮重要的作用。此外,Th17細胞在腫瘤免疫中的研究亦有報道,在卵巢癌、黑色素瘤患者中Th17細胞顯著增加[11-12],然而,目前關于Th17細胞和肝癌的關系尚少有研究報道。
本研究發現,與正常人群相比較,PHC患者外周血中Th17細胞明顯升高,提示PHC患者的腫瘤微環境可能參與影響Th17細胞的分化及功能。ZHANG等[13]的研究結果發現,Th17細胞在肝癌腫瘤組織中的水平顯著高于癌旁組織,高水平的Th17細胞是肝癌患者預后差的獨立危險因素。此外,腫瘤內的Th17細胞與腫瘤的微血管密度呈正相關,這均提示Th17細胞具有潛在的促進腫瘤進展的功能。IL-17主要由Th17細胞產生,它可以通過與多種細胞表面的IL-17受體結合后激活IL-17信號,從而通過釋放多種細胞因子、趨化因子以及炎性介質,參與機體的免疫調節[14]。本研究發現,PHC患者外周血中IL-17明顯高于正常人群,表明PHC患者的腫瘤微環境可能通過促進Th17細胞分泌IL-17來發揮生物學功能。大量研究發現,RORγT是促進Th17細胞分化的最主要的轉錄因子[15],RORγT的表達依賴于IL-6和TGF-β[16]。本研究結果顯示,PHC患者外周血中RORγT明顯高于正常人群,提示RORγT在PHC發病中可能起到極大的作用。由于原發性肝癌是一種典型的慢性炎癥為主的惡性腫瘤,因此,炎癥因子在其進展中作用極其重要。以往有研究表明,STAT3信號的激活以及炎癥因子IL-23等是Th17細胞分化的關鍵性的因素[17-18]。此外,本研究首次發現肝癌組織中轉錄因子RORγT表達水平與PHC患者組織的分化程度顯著正相關,且外周血中RORγT表達水平亦與HCC分化程度顯著正相關。王維維等[19]從細胞水平層面上認為肝癌病理與外周血中Th17細胞相關,本研究的結果進一步從分子水平發現了Th17相關的轉錄因子RORγT與病理的密切聯系,從而系統地說明了Th17細胞、相關因子及其轉錄因子在原發性肝癌的發生、發展中發揮重要的功能。
綜上所述,PHC患者外周血Th17細胞及其因子IL-17、轉錄因子RORγT的水平均明顯升高,Th17細胞可能在PHC的發生、發展中有重要作用,對PHC治療方法的探討有一定的指導意義。
[1]DHANASEKARAN R,LIMAYE A,CABRERA R.Hepatocellular carcinoma:current trends in worldwide epidemiology,risk factors, diagnosis,and therapeutics[J].Hepat Med,2012,4:19-37.
[2]SALLUSTOF,LANZAVECCHIAA.HeterogeneityofCD4+memory T cells:functional modules for tailored immunity[J].Eur J Immunol,2009,39(8):2076-2082.
[3]ZHAO XF,PAN HF,YUAN H,et al.Increased serum interleukin 17 in patients with systemic lupus erythematosus[J].Mol Biol Rep,2010,37(1):81-85.
[4]WANG W,SHAO S,JIAO Z,et al.The Th17/Treg imbalance and cytokine environment in peripheral blood of patients with rheumatoid arthritis[J].Rheumatol Int,2012,32(4):887-893.
[5]EASTAFF-LEUNG N,MABARRACK N,BARBOUR A,et al. Foxp3+regulatory T cells,Th17 effector cells,and cytokine environment in inflammatory bowel disease[J].J Clin Immunol,2010, 30(1):80-89.
[6]XIE JJ,WANG J,TANG TT,et al.The Th17/Treg functional imbalance during atherogenesis in ApoE(-/-)mice[J].Cytokine, 2010,49(2):185-193.
[7]LOONG CC,HSIEH HG,LUI WY,et al.Evidence for the early involvement of interleukin 17 in human and experimental renal allograft rejection[J].J Pathol,2002,197(3):322-332.
[8]SHARIFF MI,COX IJ,GOMAA AI,et al.Hepatocellular carcinoma:current trends in worldwide epidemiology,risk factors,diagnosis and therapeutics[J].Expert Rev Gastroenterol Hepatol,2009, 3(4):353-367.
[9]XU Y,LI H,GAO RL,et al.Expansion of interferon-gamma-producingmultifunctionalCD4+T-cellsanddysfunctional CD8+T-cells by glypican-3 peptide library in hepatocellular carcinoma patients[J].Clin Immunol,2011,139(3):302-313.
[10]YAN J,LIU XL,XIAO G,et al.Prevalence and clinical relevance of T-helper cells,Th17 and Th1,in hepatitis B virus-related hepatocellular carcinoma[J].PLoS One,2014,9(5):e96080.
[11]MIYAHARA Y,ODUNSI K,CHEN W,et al.Generation and regulation of human CD4+IL-17-producing T cells in ovarian cancer[J].Proc Natl Acad Sci USA,2008,105(40):15505-15510.
[12]ZOU W.Regulatory T cells,tumour immunity and immunotherapy[J].Nat Rev Immunol,2006,6(4):295-307.
[13]ZHANGJP,YANJ,XUJ,etal.Increasedintratumoral IL-17-producing cells correlate with poor survival in hepatocellular carcinoma patients[J].J Hepatol,2009,50(5):980-989.
[14]GU C,WU L,LI X.IL-17 family:cytokines,receptors and signaling[J].Cytokine,2013,64(2):477-485.
[15]ZHANG F,MENG G,STROBER W.Interactions among the transcription factors Runx1,RORgammat and Foxp3 regulate the differentiation of interleukin 17-producing T cells[J].Nat Immunol,2008,9(11):1297-1306.
[16]ZUNIGA LA,JAIN R,HAINES C,et al.Th17 cell development:from the cradle to the grave[J].Immunol Rev,2013,252 (1):78-88.
[17]QI W,HUANG X,WANG J.Correlation between Th17 cells and tumor microenvironment[J].Cell Immunol,2013,285(1-2): 18-22.
[18]RAFA H,SAOULA H,BELKHELFA M,et al.IL-23/IL-17A axis correlates with the nitric oxide pathway in inflammatory bowel disease:immunomodulatory effect of retinoic acid[J].J Interferon Cytokine Res,2013,33(7):355-368.
[19]王維維,王振猛,劉耀陽,等.肝細胞癌患者外周血Th17細胞水平的變化及其與腫瘤進展的關系[J].中華腫瘤雜志,2010,32(10): 757-761.
(張蕾 編輯)
Clinical significance of T helper 17 cells and related IL-17 level in patients with primary liver cancer
Lin-yu LEI1,Peng LU1,Han-bing XIE1,Jiang-tao YU1,Dao-ming LI2
(1.Department of General Surgery,Zhengzhou People's Hospital,Zhengzhou,Henan 450003,P.R.China;2.Department of Pathology,the First Affiliated Hospital, Zhengzhou University,Zhengzhou,Henan 450052,P.R.China)
【Objective】To observe the T helper 17(Th17)cells and interleukin 17(IL-17)level in primary hepatocarcinoma(PHC),and explore the relationship between Th17/IL-17 and pathological development of PHC.【Methods】A total of 80 cases of PHC were collected as study group and 40 cases of healthy sunjects as control group.Th17 cells in peripheral blood were analyzed by flow cytometry.Serum IL-17 level was detected by ELISA,and the transcription factor ROR γ T mRNA level was detected by RT-PCR.The relationship between PHC ROR γ T and clinicopathological features was also analyzed.【Results】The percentage of Th17 cells in peripheral blood of the PHC patients[(4.09±0.33)%]was significantly higher than that in the controls[(1.38±0.27)%],the difference was statistically significant(P<0.05).The IL-17 level in the PHC patients[(57.73±6.21)pg/ml]was also significantly higher than that in the controls[(33.98±4.47)pg/ml,P<0.05].The level of ROR γ T mRNA in peripheral blood of the PHC patients was significantly higher than that of the controls(P<0.001).ROR γ T mRNA expression in the PHC tissue was significantly correlated with the Edmondson pathological grade(r=0.685,P<0.05),and ROR γ T mRNA expression in peripheral blood waspositively correlated with the degree of PHC differentiation(r=0.603,P<0.05).【Conclusions】Th17 cells, IL-17 and ROR γ T mRNA levels are increased in peripheral blood of PHC patients,and ROR γ T mRNA expression is significantly correlated with the pathological grade of PHC,suggesting ROR γ T as latent factor in PHC diagnosis.
hepatocellular carcinoma;ROR γ T;T helper 17 cell;interleukin 17;TGF-β
R735.7
A
1005-8982(2015)30-0040-05
2015-03-05
李道明,E-mail:lidaoming@zzu.edu.cn

