雌激素及其代謝產(chǎn)物對去勢低氧肺動脈高壓大鼠烷烴單加氧酶和低氧誘導(dǎo)因子-1α表達的影響
鄭泉,袁雅冬,趙靖
雌激素及其代謝產(chǎn)物對去勢低氧肺動脈高壓大鼠烷烴單加氧酶和低氧誘導(dǎo)因子-1α表達的影響
鄭泉*,袁雅冬,趙靖
目的:探討17β-雌二醇(E2)及2甲氧基雌二醇(2ME)對去勢低氧肺動脈高壓大鼠模型中烷烴單加氧酶(AlkB)和低氧誘導(dǎo)因子-1α(HIF-1α)的影響。
方法:選6~7周齡雌性SD大鼠60只,去勢手后采用隨機數(shù)字表法將大鼠隨機分為6組:常氧組(n=10),常氧+E2組(n=10),常氧+2ME組(n=10),低氧組(n=10),低氧+E2組(n=10),低氧+2ME組(n=10)。低氧組持續(xù)低氧(24 h,8周);2ME組自造模之日起,每日皮下注射2ME(240 μg /kg);E2組每日皮下注射E2(20 μg/kg)。連續(xù)飼養(yǎng)8周,以建立低氧性肺動脈高壓模型。測量平均肺動脈壓(mPAP)后放血處死大鼠,觀察右心室肥厚指數(shù)(RVHI),蘇木素-伊紅(HE)染色觀察肺小動脈重構(gòu)情況。采用免疫蛋白印跡法、反轉(zhuǎn)錄聚合酶鏈反應(yīng)(RT-PCR)測定AlkB、HIF-1α的表達水平。
結(jié)果:與常氧組比較,低氧組大鼠肺小動脈管壁增厚管腔變窄明顯,mPAP、RVHI均顯著升高,低氧+E2組和低氧+2ME組上述形態(tài)學(xué)改變相對較輕,mPAP、RVHI均顯著高于常氧組,且低氧+E2組和低氧+2ME組間無明顯差異,常氧+E2組和常氧+2ME組肺小血管形態(tài)學(xué)無明顯變化。HIF-1α表達水平在低氧組顯著高于常氧組,低氧+E2組、低氧+2ME組亦升高,升高幅度不及低氧組,常氧+E2組、常氧+2ME組無明顯變化。AlkB表達水平在低氧組顯著低于常氧組,低氧+E2組、低氧+2ME組亦降低,降低幅度不及低氧組,常氧+E2組、常氧+2ME組無明顯變化。
結(jié)論:E2和2ME可能通過上調(diào)低氧性肺動脈高壓大鼠肺組織AlkB的表達,降低HIF-1α表達,進而緩解肺動脈高壓。
肺動脈高壓;缺氧;17β-雌二醇;2甲氧基雌二醇;低氧誘導(dǎo)因子-1α
Methods: A total of 60 healthy female SD rats with castrated surgery were randomly divided into 6 groups: ①Routine oxygen group, ②Routine oxygen + E2 group, the rats received subcutaneous injection of E2 (20 μg/kg·d), ③Routine oxygen + 2ME group, the rats received 2ME (240 μg/kg·d) and④Hypoxia group,⑤Hypoxia + E2 group, ⑥Hypoxia + 2ME group. n=10 in each group and all animals were treated for 8 weeks to establish the hypoxic pulmonary hypertension model. The mean pulmonary artery pressure (mPAP) was measured after bloodletting, right ventricle hypertrophy index (RVHI) was calculated and small pulmonary artery
remodeling was observed by HE staining. The expression level of HIF-1α and AlkB were examined by RT-PCR and Western blot analysis.
Results: Compared with Routine oxygen group, the rats in Hypoxia group had obviously thickened small pulmonary artery wall with narrowed lumen, increased mPAP and RVHI; the above changes in Hypoxia + E2 and Hypoxia + 2ME groups were relatively smaller, their mPAP and RVHI were higher than Routine oxygen group, while mPAP and RVHI were similar between Hypoxia + E2 and Hypoxia + 2ME groups. There were no real morphological changes in small pulmonary vessels in Routine oxygen + E2 and Routine oxygen + 2ME groups. The HIF-1α expression was obviously elevated in Hypoxia group than Routine oxygen group, while the elevation was less in Hypoxia + E2 and Hypoxia + 2ME groups. HIF-1α expression had no real changes in Routine oxygen+E2 and Routine oxygen + 2ME groups. The AlkB expression was obviously reduced in Hypoxia group than Routine oxygen group, while the reduction was less in Hypoxia + E2 and Hypoxia + 2ME groups. AlkB expression had no real changes in Routine oxygen + E2 and Routine oxygen + 2ME groups.
Conclusion: Estradiol E2 and 2ME could remit pulmonary hypertension which might be via up-regulating AlkB expression and down-regulating HIF-1α expression in experimental rats with hypoxic pulmonary hypertension.
(Chinese Circulation Journal, 2015,30:884.)
肺動脈高壓是一組以血管增殖、重構(gòu)、肺血管床進行性閉塞,肺血管阻力進行性增加為特征,常導(dǎo)致右心衰竭。缺氧性肺動脈高壓的形成主要與早期低氧性肺血管收縮和后期肺血管重建有關(guān)。缺氧時,低氧誘導(dǎo)因子-1α(HIF-1α)可激活下游靶基因從而調(diào)節(jié)一系列細(xì)胞因子和生長介質(zhì)的基因表達及蛋白合成,在血管反應(yīng)性、血管重構(gòu)以及細(xì)胞增殖等過程中發(fā)揮著重要作用。17β-雌二醇(E2)的生物活性在體內(nèi)三種天然雌激素中最強,被認(rèn)為起主要生理作用。近年來,雌激素對肺血管保護作用的研究日益增多,既能減輕內(nèi)皮細(xì)胞和平滑肌細(xì)胞的功能損傷,又能舒張血管、改善肺血管重構(gòu),但具體機制尚未完全明了。本實驗建立去勢大鼠低氧性肺動脈高壓模型,探討E2及2甲氧基雌二醇(2ME)對低氧性肺動脈高壓大鼠模型中烷烴單加氧酶(AlkB)和HIF-1α的影響。
1 材料與方法
實驗動物及分組:6~7周雌性SD大鼠60只(河北醫(yī)科大學(xué)實驗動物中心提供,許可證編號:1312033),體重(190±10)g。行去勢手術(shù)并適應(yīng)性飼養(yǎng)1周后采用隨機數(shù)字法將大鼠隨機分為6組:常氧組(n=10)、常氧+E2組(n=10)、常氧+2ME組(n=10)、低氧組(n=10)、低氧+E2組(n=10)、低氧+2ME組(n=10)。
主要儀器及材料:常壓低氧環(huán)境動物實驗箱(長沙長錦科技有限公司);RM3000四導(dǎo)聯(lián)生理記錄儀(日本光電公司);光學(xué)顯微鏡及照相系統(tǒng)(日本Olympus公司);756MC型紫外-可見分光光度計(上海精密科學(xué)儀器有限公司);2ME(湖北康寶泰精細(xì)化工公司);碘[125I]-雌二醇放射免疫分析藥盒(深圳拉爾文生物工程技術(shù)有限公司);PE-9600基因擴增儀(美國PE公司);BioID數(shù)碼成像分析系統(tǒng)(法國VilberLourmat公司);Powlab測壓軟件(美國匹茲堡AD器械有限公司);引物由上海生物工程技術(shù)公司合成;大鼠抗HIF-1α單克隆抗體、大鼠抗alkB單克隆抗體、辣根過氧化物酶標(biāo)記的二抗(美國Santa Cruz公司)。
模型建立:低氧組、低氧+E2組、低氧+2ME組大鼠放入低氧箱中飼養(yǎng),調(diào)整低氧箱參數(shù),保持艙內(nèi)氧濃度為(10.0±0.5)%,每天持續(xù)低氧24 h,連續(xù)8周。常氧組、常氧+E2組、常氧+2ME組大鼠置于同一室內(nèi)飼養(yǎng)。常氧+2ME組、低氧+2ME組自造模之日起,每日皮下注射2ME(240 μg /kg)。常氧+E2組、低氧+E2組每日皮下注E2(20 μg/kg)。常氧組、低氧組則每日皮下注射等量的生理鹽水。
肺動脈壓力測定:大鼠經(jīng)腹腔內(nèi)麻醉后,右頸縱形切口,分離出右側(cè)頸外靜脈,結(jié)扎遠(yuǎn)心端后,作靜脈“V”形切口,經(jīng)右頸外靜脈插入微導(dǎo)管,通過壓力傳感器連接四導(dǎo)生理記錄儀RM-3000連續(xù)測壓,觀察壓力波形變化來判斷導(dǎo)管頭端位置,待至肺動脈干后穩(wěn)定10 min,隨后記錄壓力波形,計算大鼠平均肺動脈壓(mPAP)。
標(biāo)本的留取:壓力測量結(jié)束后抽取大鼠頸靜脈血4 ml分別置于若干2 ml消毒EP管中,以1006.2 g離心,離心后用移液器將上清液移至2 ml消毒EP管中,放入-70℃冰箱冷凍保存。將胸腔打開取出全肺,以生理鹽水沖洗肺外表并放入潔凈玻璃皿內(nèi),
取左肺上葉制成石蠟標(biāo)本觀察肺動脈形態(tài),余肺葉待測HIF-1α、AlkB。
右心室肥厚指數(shù)(RVHI)的測定:經(jīng)以上檢測后將大鼠放血處死,取出心臟置于10%中性甲醛固定48 h,沿房室溝切除心房和大血管根部,再沿至后室間溝將右心室游離壁分離,吸干水分后用電子天平分別稱取右心室和左心室+室間隔的重量,計算RVHI來反映右心室肥厚程度的變化。
大鼠肺小動脈形態(tài)學(xué)分析:將肺組織石蠟切片進行蘇木素-伊紅(HE)染色和彈性纖維染色,顯微鏡下觀察肺動脈大體形態(tài)變化。
應(yīng)用反轉(zhuǎn)錄聚合酶鏈反應(yīng)(RT-PCR)測定肺組織中HIF-1α及AlkB mRNA水平:取100 mg肺組織置入勻漿器內(nèi),按Trizol法提取組織總RNA 2 μg,加入RT反應(yīng)體系(含AMV Buffer、dNTPs、OligodT Primer、AMV、Rnase Inhibitor等)管中,并用焦碳酸二乙酯處理水補足至50 μl反應(yīng)液體積,震蕩混勻后短暫離心,加少許礦物油于PCR儀42℃ 30 min(cDNA合成),99℃ 5 min(逆轉(zhuǎn)錄酶失活),5℃5 min。-20℃情況下保存?zhèn)溆谩CR擴增引物經(jīng)PAGE純化。Rat AlkB的序列:上游引物 5'-GATGAAGCTCCCACAGCCAT-3'。下游引物 5'-ACAGAACAGGGCTCAAGCAA-3' 擴增片段為 188 bp。Rat HIF-1α的序列:上游引物 5'- CTCAGAGGAAGCGAAAAATGG -3'。下游引物 5'-AAT TCT TCA CCCTGCAGTAGG -3' 擴增片段為 307bp。Rat GAPDH 的序列:上游引物5'- CCTTCATTGACCTCAACTAC -3 '。下游引物5'- GGAAGGCCATGCCAGTGAGC -3 ' 擴增片段為594bp。PCR擴增條件:94℃變性3 min;(94℃ 40 s,各自的退火溫度 50 s,72℃ 90 s)× 30個循環(huán);72℃延伸10 min。PCR產(chǎn)物在1%的含GV核酸染料的瓊脂糖凝膠電泳中加入的每個標(biāo)本擴增產(chǎn)物,量為6 μl,以DNA Marker(DL2000)作為標(biāo)準(zhǔn)片段標(biāo)記,電泳后在紫外透射儀下觀察,并且用數(shù)碼相機照相,輸入微機中后應(yīng)用Quantity One凝膠圖象分析軟件對目的電泳條帶進行分析,把內(nèi)參電泳條帶作為參照,結(jié)果以兩者之間的吸光度比值表示。
免疫蛋白印跡法(Western blot )檢測肺組織中AlkB、HIF-1α 蛋白質(zhì)的表達:取大鼠左側(cè)肺組織于 4℃用磷酸鹽緩沖液(PBS,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,pH 7.4,137 mmol/L NaCl,2.7 mmol/L KCl)充分洗滌,加 5 倍體積用冰預(yù)冷的懸浮緩沖液,迅速剪碎組織,冰浴中勻漿,加入等體積的 2×SDS 凝膠加樣緩沖液,再將樣品置于沸水浴中加熱 10 min,將上清液移于另一管中為待測樣品。采用改良酚試劑法(Lowry 法)進行蛋白定量,用于免疫蛋白印跡法分析。用8%SDS-聚丙烯酰胺凝膠電泳分離蛋白,電轉(zhuǎn)移至聚偏氟乙烯(PVDF)膜上。隨即與一抗及二抗結(jié)合于室溫反應(yīng) 2.5~3 h。用 TTBS液(20 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl)洗膜3次,每次10 min,然后用 TBS液(10 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl)洗膜 1 次,約5 min。用化學(xué)發(fā)光法檢測膜上的抗原抗體結(jié)合區(qū)帶。采用VilberLourmat公司 ID 數(shù)碼成像分析軟件對免疫蛋白印跡顯色區(qū)帶的信號強度進行相對定量分析,掃描灰度值用積分光密度值(IOD)表示。
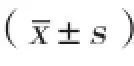
2 結(jié)果
2.1 大鼠平均肺動脈壓和右心室肥厚指數(shù)的改變(表1)
與常氧情況下大鼠比較,低氧情況下的三組大鼠mPAP明顯升高,符合肺動脈高壓的壓力水平;其中低氧組大鼠的mPAP較低氧+2ME組和低氧+E2組均明顯升高,差異有統(tǒng)計學(xué)意義(P<0.05);而低氧+2ME組與低氧+E2組比大鼠mPAP差異無統(tǒng)計學(xué)意義(P>0.05)。
表1 6組大鼠體重、平均肺動脈壓和右心室肥厚指數(shù)的比較
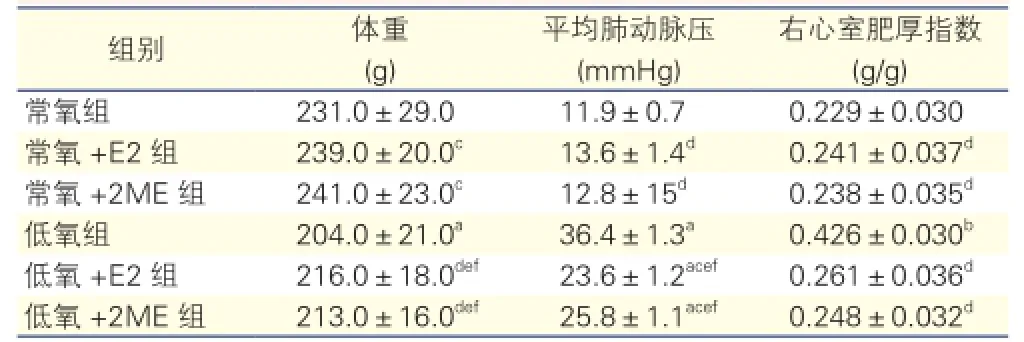
表1 6組大鼠體重、平均肺動脈壓和右心室肥厚指數(shù)的比較
注:E2:雌激素; 2ME: 2甲氧基雌二醇。1 mmHg=0.133 kPa。與常氧組比aP<0. 05bP<0.01;與低氧組比cP<0. 05dP<0.01;與常氧+E2組比eP<0.05;與常氧+2ME組比fP< 0. 05
?
2.2 大鼠肺小血管及右心室形態(tài)學(xué)變化(圖1)
光鏡下,常氧組、常氧+E2組、常氧+2ME組大鼠肺動脈血管內(nèi)皮細(xì)胞扁平連續(xù),細(xì)胞分布均勻,大小厚薄一致,無細(xì)胞水腫或壞死,肺動脈管壁結(jié)構(gòu)正常;而低氧組、低氧+E2組、低氧+2ME組大
鼠肺內(nèi)血管壁明顯增厚,肺細(xì)小動脈中膜平滑肌細(xì)胞增多,中膜增厚,管腔變窄;低氧+E2組及低氧+2ME組肺動脈管壁結(jié)構(gòu)介于常氧組和低氧組之間。各組右心室肥厚指數(shù)的變化趨勢同mPAP變化。
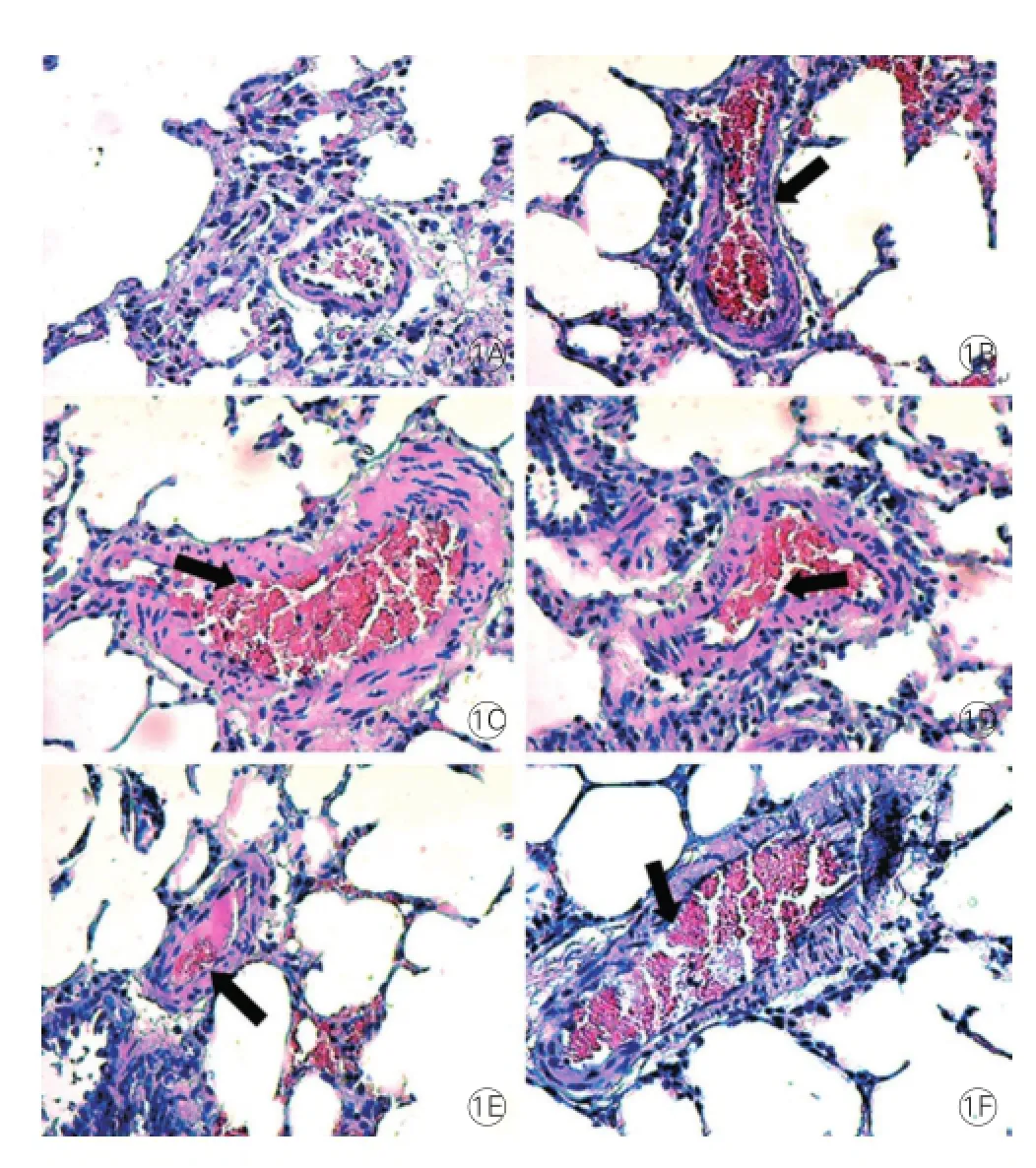
圖1 6組大鼠肺組織形態(tài)和病理變化(×100)
2.3 大鼠肺組織中HIF-1αmRNA及AlkBmRNA表達水平變化(圖2、表2)
低氧組大鼠HIF-1αmRNA表達水平顯著高于常氧組,低氧+E2組、低氧+2ME組亦升高,升高幅度不及低氧組,常氧+E2組、常氧+2ME組無明顯變化。AlkBmRNA表達水平在低氧組顯著低于常氧組,低氧+E2組、低氧+2ME組亦降低,降低幅度不及低氧組,常氧+E2組、常氧+2ME組無明顯變化。
表2 6組大鼠肺組織中HIF-1αmRNA和AlkBmRNA表達水平
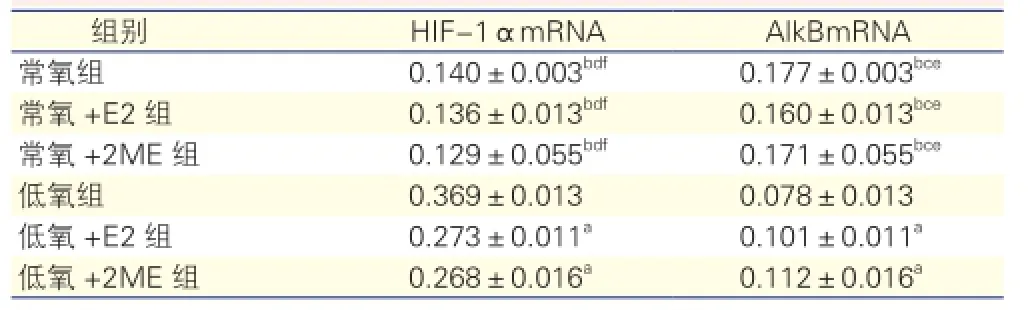
表2 6組大鼠肺組織中HIF-1αmRNA和AlkBmRNA表達水平
注:AlkB:烷烴單加氧酶;HIF-1α:低氧誘導(dǎo)因子-1α。與低氧組比aP<0. 05bP<0.01;與低氧+E2組比cP<0.05dP<0.01;與低氧+2ME組比eP<0. 05fP<0.01。余注見表1
?
2.4 大鼠肺組織中HIF-1α及AlkB蛋白表達水平的變化(圖3、表3)
低氧組HIF-1α蛋白表達水平顯著高于常氧組,低氧+E2組、低氧+2ME組亦較常氧組升高,但升高幅度不及低氧組,常氧+E2組、常氧+2ME組與常氧組比較無明顯變化。低氧組AlkB蛋白表達水平顯著低于常氧組,低氧+E2組、低氧+2ME組較常氧組亦降低,降低幅度不及低氧組,常氧+E2組、常氧+2ME組與常氧組比較無明顯變化。
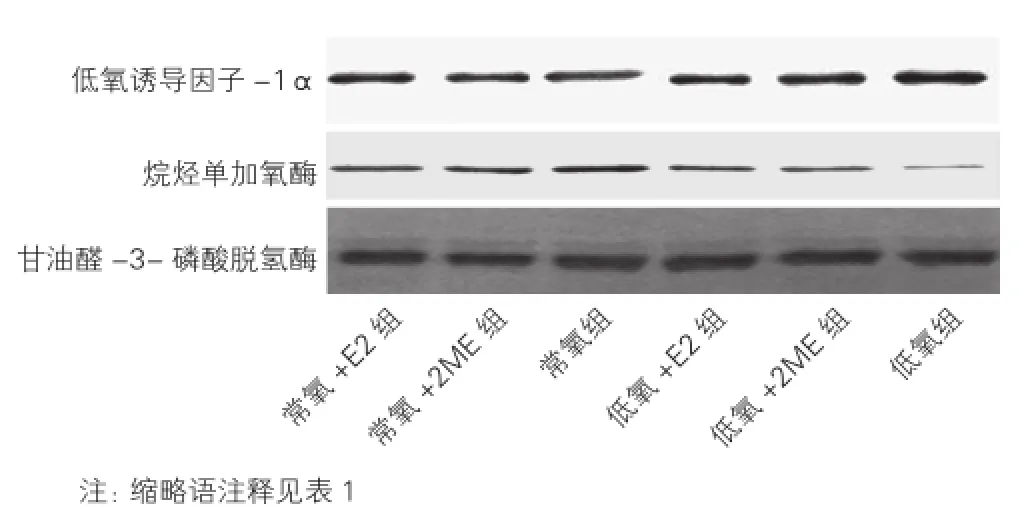
圖3 6組大鼠肺組織中低氧誘導(dǎo)因子-1α蛋白和烷烴單加氧酶蛋白的免疫印跡圖
表3 6組大鼠肺組織中低氧誘導(dǎo)因子-1α蛋白和烷烴單加氧酶蛋白表達水平

表3 6組大鼠肺組織中低氧誘導(dǎo)因子-1α蛋白和烷烴單加氧酶蛋白表達水平
注:與低氧組比aP< 0.05bP<0.01;與低氧+E2組比cP<0.05dP<0.01;與低氧+2ME組比eP<0.05fP<0.01。余注見表1
?
3 討論
肺動脈高壓的主要病理變化為肺動脈收縮反應(yīng)增強及以平滑肌細(xì)胞增生為主要特征的肺血管結(jié)構(gòu)
重建[1]。缺氧性肺動脈高壓的形成主要與低氧性肺血管收縮和肺血管重構(gòu)相關(guān)。HIF-1α是一種隨胞內(nèi)氧濃度變化而調(diào)節(jié)基因表達的轉(zhuǎn)錄激活因子,其活化后,能激活如血管內(nèi)皮生長因子等40種調(diào)控代謝、細(xì)胞遷移和血管生成的蛋白信號。常氧時HIF-1α蛋白的氧依賴性降解功能區(qū)調(diào)節(jié)HIF-1α與希佩爾—林道病腫瘤抑制蛋白作用,后者能識別泛素化連接酶E3導(dǎo)致HIF-1α發(fā)生泛素化降解[2]。缺氧時HIF-1α不能被希佩爾—林道病腫瘤抑制蛋白識別從而無法被泛素化降解,其表達量在細(xì)胞內(nèi)呈指數(shù)式增加[3]。
本研究顯示在去勢和低氧并存條件下,無論右心室及肺血管形態(tài)學(xué)還是mPAP等均變化較大,且肺組織中HIF-1α的表達呈明顯升高趨勢;推測缺氧是肺動脈高壓發(fā)展的始動因素,而雌激素的缺失加劇低氧所致肺動脈高壓。給予E2及2ME干預(yù)后右心室及肺動脈管壁結(jié)構(gòu)發(fā)生逆轉(zhuǎn),肺組織中HIF-1αmRNA表達水平明顯低于低氧組。Miyamoto等[4]研究發(fā)現(xiàn),E2在低氧時呈劑量、時間依賴性降低肺組織中HIF-1α的表達。研究認(rèn)為雌激素對HIF-1α的影響可通過其受體介導(dǎo)和下游代謝產(chǎn)物2ME來發(fā)揮作用,E2通過與受體結(jié)合具有促進細(xì)胞外信號調(diào)節(jié)蛋白激酶和p38絲裂原活化蛋白激酶磷酸化、下調(diào)細(xì)胞周期素依賴性蛋白激酶抑制蛋白、刺激內(nèi)皮細(xì)胞遷移及增殖及抑制內(nèi)皮細(xì)胞凋亡等作用[5-8]。此外,植物雌激素對氧感受信號具有調(diào)制作用,通過作用與細(xì)胞內(nèi)自由基,影響細(xì)胞內(nèi)各種信號傳導(dǎo)途徑從而下調(diào)HIF-1α的表達[9]。
2ME由雌二醇2位碳原子先羥化再甲基化形成;對雌激素受體的親和力較低[10]。有學(xué)者采用在低氧下培養(yǎng)HEK293細(xì)胞,發(fā)現(xiàn)經(jīng)2ME處理后可顯著降低HIF-1α的轉(zhuǎn)錄活性,推測其抑制HIF-1α的功能是通過促進HIF-1α蛋白降解[11]。也有觀點認(rèn)為經(jīng)2ME作用后,HIF水平降低是由于HIF-1α合成受抑制[12],研究者們普遍認(rèn)為2ME是不通過雌激素受體而獨立發(fā)揮對HIF-1α的拮抗作用。外源性雌激素進入機體后約80%經(jīng)17β脫氫酶氧化為雌酮或硫酸雌酮,僅約20%可能轉(zhuǎn)化為雌三醇、2ME等。缺氧以及氧化應(yīng)激又進一步下調(diào)2-羥基化通路關(guān)鍵酶2-CYP1A1/2的表達,導(dǎo)致E2轉(zhuǎn)化為2ME減少。故缺氧時2ME所發(fā)揮的抑制HIF-1α作用將被減弱。本研究中未觀察到上述現(xiàn)象,推測2ME對HIF-1α的抑制作用不存在類似E2的時間、劑量依賴性,這進一步提示二者的作用機制不同。達到一定濃度后,2ME對HIF-1α的抑制作用將與濃度無關(guān)。
缺氧時胞漿內(nèi)HIF-1α發(fā)生核移位與核內(nèi)HIF-1β 結(jié)合,調(diào)控相關(guān)基因的轉(zhuǎn)錄。本研究觀察到大鼠肺組織中ALKBmRNA及蛋白水平與HIF-1α的增加存在著一定的關(guān)系。AlkB為單核非血紅素Fe2+和α-酮戊二酸依賴的雙加氧酶超家族成員,通過激活雙氧分子催化氧化與穩(wěn)定雜環(huán)上氮原子相接觸的甲基團,使之構(gòu)象發(fā)生改變,從而以釋放甲醛的形式移除甲基團。低氧使AlkB表達下調(diào),致其修復(fù)DNA和RNA異常甲基化的能力有所下降從而導(dǎo)致HIF-1α的活性增加[13]。E2、2ME干預(yù)作用是否通過HIF-1α為介質(zhì)來發(fā)揮對AlkB的影響尚需進一步研究證實。
[1] 朱鋒, 董琳, 熊長明. 解讀2009歐洲心臟病學(xué)會肺動脈高壓診斷和治療指南解析肺動脈高壓新分類. 中國循環(huán)雜志, 2010, 25: 657.
[2] Park J. STAT3 inhibits the degradation of HIF-1 α by pVHL-mediated ubiquitination. Exp Mol Med, 2008, 40: 479-485.
[3] Lakham NJ, Sarkar MA, Venitz J, et al. 2-methoxyestradiol, a promising anticancer drug. Pharmacotherapy, 2003, 23: 165-172.
[4] Miyamoto N, Mandai M, Takagi H, et al. Contrasting effect of estrogen on VEGF induction under different oxygen status and it s role in murine ROP. Ophthalmol Vis Sci, 2002, 43: 2007-2014.
[5] Lippert C, Seeger H, Mueck AO, et al. The effects of A-ring and D-ring metabolites of estradiol on the proliferation of vascular endothelial cells. Life Sci, 2000, 67: 1653-1658.
[6] Dupont J, Karas M, LeRoith D. The potentiation of estrogen of insulinlike growth factor I action in MCF-7 human cancer cells includes cell cycle components. J Bio Chem, 2000, 275: 35893-35900.
[7] Suzuma I, Mandai M, Takagi H, et al. 17-Estradiol increases VEGF receptor-2 and promotes DNA synthesis in retinal microvascular endothelial cells. Invest Opthalmol Vis Sci, 1999, 40: 2122-2129.
[8] Geraldes P, Sirois MG, Bernatchez PN, et al. Estrogen regulation of endothelial and smooth muscle cell migration and proliferationw. Role of p38 and p42/44 mitogen-activate protein kinase. Arterioscler Thromb Vasc Biol, 2002, 22: 1585-1590.
[9] Alsharnoubi JM, Odland HH, Saugstad OD. Nicotine does not influence NF-κB activity in neonatal mice reoxygenated with room-air or 100% oxygen. J Matern Fetal Neonatal Med, 2012, 25: 2102-2105.
[10] 鄭泉, 鄧華君, 袁雅冬. 雌激素及其代謝產(chǎn)物與肺動脈高壓的相關(guān)性研究. 中國循環(huán)雜志, 2015, 30: 184-186.
[11] Gestl SA, Green MD, Shearer DA, et al. Expression of UGT2B7, a UDP-Glucuronosyltransferase Implicated in the Metabolism of 4-Hydroxyestrone and All-Trans Retinoic Acid, in Normal Human Breast Parenchyma and in Invasive and in Situ Breast Cancers.Am J Pathol, 2002, 4: 1467-1479.
[12] Mabjeesh NJ. 2ME2 inhibits tumor growth and angiogenesis by disrupting microtubules and dysregulating HIF. Cancer Cell, 2003, 3: 363-375.
[13] 鄧華君, 袁雅冬. 烷烴單加氧酶和低氧誘導(dǎo)因子-1α在大鼠低氧性肺動脈高壓模型肺組織中的表達及其意義. 中華醫(yī)學(xué)雜志, 2013, 93: 3226-3231.
Effect of Estradiol and its Metabolite on Hypoxic Induced Factor-1αand Alkane Hydroxylase in Experimental Rats With Ovariectomy and Hypoxic Pulmonary Hypertension
ZHENG Quan, YUAN Ya-dong, ZHAO Jing.
Department of Respiratory and Critical Care Medicine, The Second Hospital, Hebei Medical University, Shijiazhuang (050000), Hebei, China
Objective: To explore the effects of 17 β-estrogen (E2) and 2-methoxyestradiol (2ME) on hypoxic induced factor-1α (HIF-1α) and alkane hydroxylase (AlkB) in experimental rats with ovariectomy and hypoxic pulmonary hypertension.
Pulmonary hypertension; Anoxia; 17 β-estrogen; 2-methoxyestradiol; Hypoxia induced factor-1
2015-01-28)
(編輯:許 菁)
河北省自然科學(xué)基金(H2013206403)
050000 河北省石家莊市,河北醫(yī)科大學(xué)第二醫(yī)院 呼吸與危重癥醫(yī)學(xué)科
鄭泉 主治醫(yī)師 碩士 主要從事肺血管病研究 Email:xk9032@163.com*現(xiàn)就職于武漢市第三醫(yī)院呼吸內(nèi)科 通訊作者:袁雅冬
Email:yyd1108@126.com
R54
A
1000-3614(2015)09-0884-05
10.3969/j.issn.1000-3614.2015.09.015

