探討白藜三醇抑制快速電刺激乳鼠心肌細胞氧化應激損傷及其機制
葛力萁,李承宗,程明月,張超群,王志榮
探討白藜三醇抑制快速電刺激乳鼠心肌細胞氧化應激損傷及其機制
葛力萁,李承宗,程明月,張超群,王志榮
目的:探討白藜三醇(Resveratrol,RSV)對快速刺激乳鼠心肌細胞氧化應激損傷的保護機制。
方法:本實驗采用胰酶和膠原酶雙酶法及差速貼壁法分離新生大鼠心肌細胞和成纖維細胞。心肌細胞隨機分為5組:空白對照組、快速電刺激組(RES組)、快速電刺激+煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶抑制劑夾竹桃麻素組(RES+APO組)、快速電刺激+白藜三醇組(RES+RSV組)、快速電刺激+鈣/鈣調蛋白依賴性蛋白激酶抑制劑組(RES+AIP組)。為了證實白藜三醇是否還通過蛋氨酸亞砜還原酶—氧化型鈣/鈣調蛋白依賴性蛋白激酶(MsrA-OXCaMKⅡ)途徑對心肌細胞產生保護作用。除了上述5組,另設了MsrA競爭性阻斷劑0.5%二甲基亞砜(DMSO)對照組(DMSO對照組)和RSV+DMSO組,RES+RSV+DMSO組。細胞計數Kit-8(CCK-8)法檢測心肌細胞活性以確定白藜三醇的最佳濃度,采用酶聯免疫吸附檢測法(ELISA)檢測細胞培養液中AngⅡ水平以選擇最佳心肌細胞電刺激時間。流式細胞儀檢測心肌細胞內活性氧水平;蛋白免疫印跡法(Western blot)檢測心肌細胞MsrA、NADPH氧化酶4(Nox4)、NADPH氧化酶2(Nox2)、NADPH氧化酶p22phox亞基(P22phox)、OX-CaMKⅡ、凋亡相關激酶半胱氨酸蛋白酶3(Caspase-3)、Caspase-3剪切蛋白表達。
結果:(1)與空白對照組比,RES組心肌細胞AngⅡ分泌顯著增加,同時Nox4、Nox2及P22phox、OX-CaMKⅡ、Caspase-3剪切蛋白的表達水平顯著增加。(2)與RES組比,RES+APO組、RES+RSV組和RES+AIP組的活性氧水平降低,RES+RSV組降低更明顯。(3)與RES組比較,RES+APO組、RES+RSV組的Nox4、Nox2及P22phox、OX-CaMKⅡ、Caspase-3剪切蛋白的表達水平降低,RES+AIP組僅Nox2、OX-CaMKⅡ及Caspase-3剪切蛋白表達水平降低。(4)加入MsrA抑制劑二甲基亞楓(DMSO)后,白藜三醇抑制快速電刺激導致的Caspase-3剪切蛋白表達作用減弱。
結論:白藜三醇對快速電刺激乳鼠心肌細胞具有保護作用,其機制可能是抑制NADPH氧化酶及增加MsrA表達,從而減少乳鼠心肌細胞氧化應激損傷。
白藜三醇;快速電刺激;乳鼠心肌細胞;NADPH氧化酶;蛋氨酸亞砜還原酶
Methods: The neonatal rats cardiac fibroblasts and myocytes were isolated by double enzyme digestion and differential adhesion method, and the cardiomyocytes were randomly divided into 5 groups: ①Control (CTR) group, ②Rapid electrical stimulation (RES) group, ③RES+APO group, cells were pretreated with NADPH oxidase inhibitor APO, ④RES+RSV group,⑤RES+AIP group, cells were pretreated with CaMKII inhibitor AIP. In order to confirm whether RSV protection was via MsrA-OX-CaMKⅡpathway, the cells were further divided into another 3 groups: ①DMSO control group, ②RSV+DMSO group, ③RES+ RSV+DMSO group. The best dose of RSV was measured with Kit-8 by cardiomyocytes surviving condition, the optimal electrical stimulation time was detected with ELISA by Ang II level in conditioned medium. The level of reactive oxygen species (ROS) in cardiomyocytes was detected by flow cytometry, the protein expressions of MsrA, Nox4, Nox2, P22phox, OX-CaMK II and apoptosis related cleaved caspase-3 were observed by Western blot analysis.
Results:①Compared with CTR group, RES group showed increased AngII secretion with increased protein expressions of Nox4, Nox2, P22phox, OX-CaMK II and cleaved caspase-3. ②Compared with RES group, the RES+APO, RES+RSV, RES+AIP groups had decreased ROS level, the ROS was even lower in RES+RSV group. ③Compared with RES group, the RES+APO, RES+RSV groups presented decreased protein expressions of Nox4, Nox2, P22phox, OXCaMK II and cleaved caspase-3, while RES+AIP group only had decreased Nox2, OX-CaMK II and cleaved caspase-3.④Compared with DMSO control group, RES+ RSV+DMSO group had the lower level of cleaved caspase-3 expression.
Conclusion: RSV has protective effect on rapid electrical stimulation incurred oxidative stress injury in neonatal rats cardiomyocytes, which might be via NADPH oxidase with the increased MsrA expression .
(Chinese Circulation Journal, 2015,30:684.)
氧化反應對機體很重要,對細胞產生潛在的危害。目前對活性氧的具體作用途徑和機制并不完全明確,但一般清除活性氧,或是下調過氧化物酶、煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶及一氧化氮解偶聯,將對心血管系統產生保護作用[1-4]。鈣/鈣調蛋白依賴性蛋白激酶(CaMKⅡ)在心血管病中起到重要作用,活性氧作用的主要靶蛋白之一。是活性氧使CaMKⅡ轉換為氧化型鈣/鈣調蛋白依賴性蛋白激酶(OX-CaMKⅡ),呈持續的激活狀態。激活的CaMKⅡ將導致心肌細胞離子通道的改變、興奮收縮偶聯異常,促進活性氧繼續增加,甚至細胞凋亡。蛋氨酸亞砜還原酶(MsrA)可以逆轉CaMKⅡ氧化,減少對心肌細胞的損傷[5]。
白藜三醇(RSV)是廣泛存在于植物中的一種活性多酚物質。大量研究表明,RSV具有抗氧化、抗炎、抗血小板聚集等生物學特性,發揮心血管保護作用[6]。同時,白藜三醇對Na+、K+離子及鈣瞬變產生影響,從而保護心肌細胞[7]。此外,研究表明,白藜三醇可抑制NADPH氧化酶從而對心肌細胞產生保護作用[8]。本研究旨在探討白藜三醇對快速電刺激心肌細胞氧化應激損傷的保護機制。為證實白藜三醇除了抑制NADPH氧化酶外,是否還通過MsrA-OXCaMKⅡ途徑對心肌細胞產生保護作用,我們加入NADPH氧化酶抑制劑夾竹桃麻素(APO)及CaMKⅡ抑制劑(AIP)與之相比,進一步為研究白藜三醇在心血管疾病方面的治療作用提供理論依據。
1 材料與方法
藥品及試劑:新生SD大鼠來源于徐州醫學院動物實驗中心,RSV、APO和AIP均購于美國Sigma公司。DMEM高糖培養基、胎牛血清(FBS)購于美國Gibco公司。細胞刺激儀購于美國拜譜公司。大鼠血管緊張素-Ⅱ(AngⅡ)酶聯免疫檢測試劑盒購于上海西唐生物科技有限公司。鼠抗β-肌動蛋白(β-actin)、二氨基聯苯胺顯色劑(DAB)、堿性磷酸酶標記的馬抗小鼠和山羊抗兔二抗均購于北京中杉金橋科技有限公司。細胞計數Kit-8(CCK-8)試劑盒、活性氧檢測試劑盒購于碧云天生物技術研究所。NADPH氧化酶4(Nox4)、NADPH氧化酶2(Nox2)、NADPH氧化酶P22phox亞基(P22phox)抗體購于武漢博士德生物公司。MsrA抗體購于美國Abcam公司。OX-CaMKⅡ抗體購于美國Genetex公司。凋亡相關激酶半胱氨酸蛋白酶3(Caspase-3)抗體購于美國Santa Cruz公司。
心肌細胞分離培養及鑒定:取新生SD大鼠心臟400只,按照文獻[9]的方法獲得原代心肌細胞和心肌成纖維細胞。
快速電刺激模型的制備和分組:心肌細胞種于6孔板中,培養至第4天置換為無血清培養基,并予以不同藥物處理,NADPH氧化酶抑制劑APO劑量100 μmol/L,AIP的劑量是2 μmol/L。將與6孔板配套的帶有刺激電極的蓋板覆蓋于6孔板上,電極到達培養基液面以下。蓋板通過導線連接于刺激器,將刺激器頻率設置為4 HZ。心肌細胞分為五組:空白對照組(未給予任何干預)、快速電刺激組(RES組)、RES+APO組、RES+RSV組和RES+AIP組。
為了證實白藜三醇是否還通過MsrA-OXCaMKⅡ途徑對心肌細胞產生保護作用。除了上述5組,另設了MsrA競爭性阻斷劑0.5%二甲基亞砜(DMSO)對照組(DMSO對照組)、RSV+DMSO組和RES+RSV+DMSO組。
CCK-8檢測心肌細胞活性以確定白藜三醇的最佳濃度:白藜三醇分5、10、15、20、25 μmol/L五個濃度,將原代心肌細胞按每孔1×105個細胞接種于96 孔板。實驗步驟:避光的條件下每孔加入10 μl的CCK-8溶液,將培養板放在培養箱中預培養(在
37℃,5% CO2的條件下)4 h,用酶標儀測定在450 nm處的吸光度[10]。
酶聯免疫吸附檢測法(ELISA)檢測細胞培養液中AngⅡ水平:分別取電刺激0.5、1.0、1.5、2.0 h心肌細胞培養液,采用ELISA檢測不同時間段培養基中AngⅡ水平,具體方法參考劑量說明書操作。
流式細胞儀檢測心肌細胞活性氧水平:細胞干預結束后,各組加入熒光探針CM-H2DCFDA至終濃度為5 μmol/L,37℃、5%CO2培養箱內培養30 min。去除培養基,溫磷酸鹽酸緩沖液(PBS,含NaCl、Na2HPO4、KCl、KH2PO4,pH=7.35)洗三遍,充分去除未進入細胞的CM-H2DCFDA。消化收集細胞,無血清培養基洗2遍,PBS液重懸,上流式細胞儀檢測活性氧,激發光488 nm,發射光525 nm。細胞內的活性氧可以氧化無熒光的DCFH生成有熒光的DCF,檢測DCF的熒光就測得細胞內活性氧的水平[11]。
蛋白免疫印跡(Western blot)法檢測心肌細胞MsrA、Nox4、Nox2、P22phox、OX-CaMKⅡ、Caspase-3剪切蛋白、Caspase-3的蛋白表達。處理后的細胞用PBS液清洗干凈,用含有蛋白酶抑制劑的細胞裂解液在冰上裂解30 min,14 000×g離心10 min(4℃),收集上清液。二喹啉甲酸(BCA)法測定蛋白濃度,蛋白高溫變性,加樣,5%的濃縮膠和10%的分離膠進行跑膠,轉膜,含5%牛血清白蛋白(BSA)緩沖液封閉3 h,一抗4℃孵育過夜。PBS液洗3遍,每次5 min,二抗室溫孵育1.5 h,緩沖液洗凈,顯色,掃描。
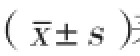
2 結果
2.1 不同白藜三醇濃度組心肌細胞活性的比較(表1)
CCK-8檢測結果顯示:與空白對照組相比,白藜三醇25 μmol/L組心肌細胞活性明顯降低(P<0.001),其他4個濃度較空白對照組間的差異無統計學意義(P均>0.05);與白藜三醇15 μmol/L組相比,白藜三醇20 μmol/L組心肌細胞活性降低(P<0.05),白藜三醇25 μmol/L組心肌細胞活性也顯著降低(P<0.001)。因此白藜三醇作用于心肌細胞的最佳濃度設定為15 μmol/L。
表1 不同白藜三醇濃度組心肌細胞活性的比較
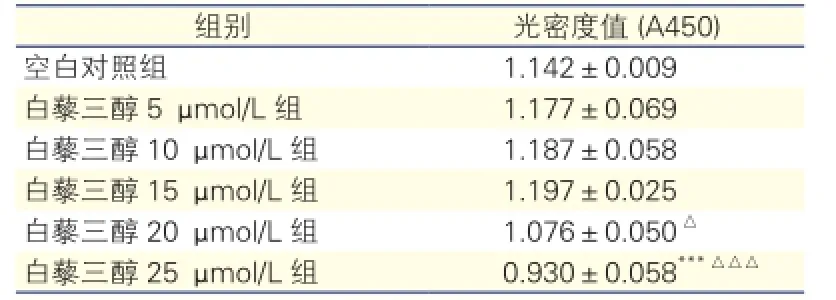
表1 不同白藜三醇濃度組心肌細胞活性的比較
注:與空白對照組相比***P<0.001;與白藜三醇15 μmol/L組相比△P<0.05△△△P<0.001
?
2.2 快速電刺激心肌細胞對血管緊張素Ⅱ水平的影響
與0.5 h相比,電刺激1.5 h及2 h 的AngⅡ水平明顯增加[(0.256±0.136) vs (0.890±0.099),(0.256±0.136) vs (0.949±0.095);P均<0.001];但在電刺激1.5 h與電刺激2 h AngⅡ水平未見有明顯差異[(0.890±0.099) vs (0.949±0.095),P均>0.05],因此,我們選擇刺激心肌細胞時間為1.5 h。
2.3 5組心肌細胞內活性氧水平比較(圖1)
與空白對照組相比,RES組、RES+APO組及RES+AIP組可見心肌細胞內活性氧水平增高(P均<0.05),但RES+RSV組心肌細胞內活性氧水平未見有明顯差異(P>0.05);與RES組相比,RES+APO組、RES+RSV組、RES+AIP組心肌細胞內活性氧產生減少(P均<0.01);RES+RSV組活性氧水平低于RES+AIP組(P<0.05),可見AIP減少活性氧水平的作用較RSV弱;RES+RSV組與RES+APO組活性氧水平未見明顯差異(P>0.05)。這說明RSV減少活性氧水平的作用較APO和AIP強。
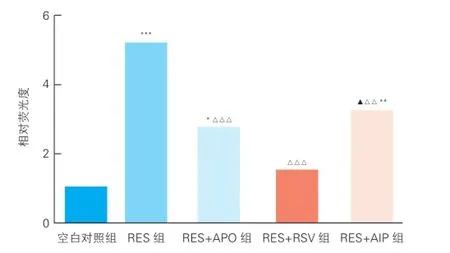
圖1 5組心肌細胞內活性氧水平的比較(x±s,n=5)
2.4 5組心肌細胞內Nox4、Nox2、P22phox、OXCaMKⅡ蛋白表達的比較(圖2)
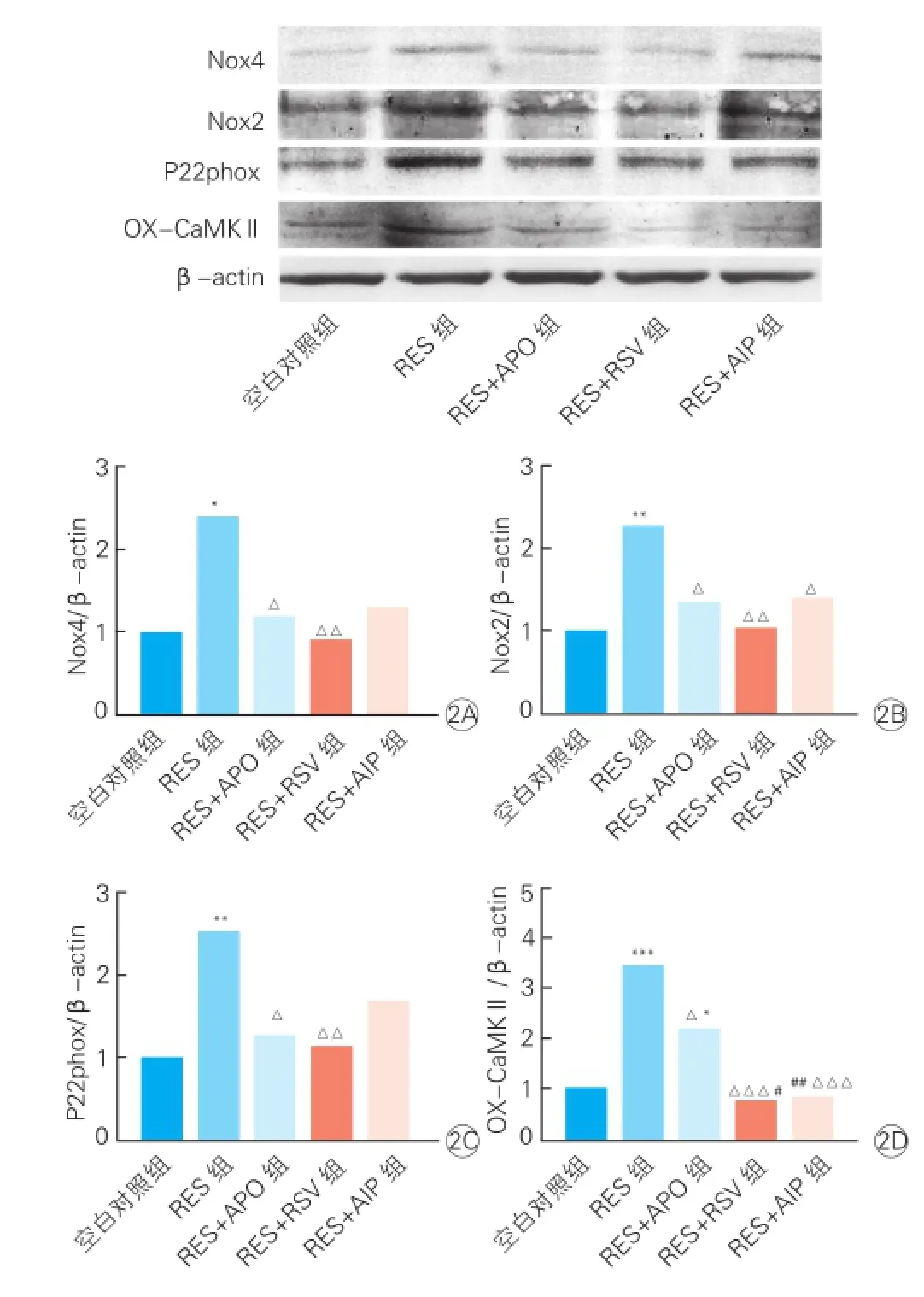
圖2 5組心肌細胞內Nox4、Nox2、P22phox、OX-CaMKⅡ蛋白水平的比較(
與空白對照組相比,RES組Nox4、Nox2、P22phox及OX-CaMKⅡ蛋白表達水平增加(P均<0.05)。與RES組相比,RES+APO組和RES+RSV組的Nox4、Nox2、P22phox蛋白表達水平均下降(P均<0.05),但兩組間上述三個指標的差異無統計學意義(P>0.05)。與RES組相比,RES+AIP組只有Nox2、OX-CaMKⅡ蛋白表達水平明顯降低(P<0.05);此外,RES+RSV組OX-CaMKⅡ蛋白表達水平低于RES+APO組(P<0.05),但與RES+AIP組的OX-CaMKⅡ蛋白表達水平差異無統計學意義(P>0.05)。
2.5 5組心肌細胞通過上調MsrA對Caspase-3剪切蛋白和總Caspase-3蛋白表達的影響(圖3)
與空白對照組相比,RES組及RES+RSV+DMSO組的Caspase-3剪切蛋白表達增加(P<0.01)、總Caspase-3蛋白表達減少;與RES組相比,RES+APO組、RES+RSV組、RES+AIP組、DMSO對照組、RSV+DMSO組的Caspase-3剪切蛋白表達均減少(P<0.05)、總Caspase-3蛋白表達增加;與RES+RSV+DMSO組比較,RES+RSV組、DMSO對照組、RSV+DMSO組的Caspase-3剪切蛋白表達減少(P<0.01)、總Caspase-3蛋白表達增加,但RES+APO組、RES+AIP組的Caspase-3剪切蛋白表達水平與RES+RSV+DMSO組相比差異無統計學意義(P>0.05)。

圖3 白藜三醇通過上調MsrA對Caspase-3剪切蛋白和總Caspase-3蛋白表達的影響(
3 討論
本實驗發現,短暫的快速電刺激將導致心肌細胞內AngⅡ增加,同時也伴隨著NADPH氧化酶和活性氧增加,最終導致Caspase-3蛋白表達增加。本實驗中,我們發現白藜三醇可以抑制快速電刺激導致的心肌細胞Caspase-3剪切增加,其機制可能是通過抑制NADPH氧化酶及增加MsrA表達從而發
揮對心肌的保護作用。
越來越多的證據表明,活性氧的增加將會導致心血管疾病的發生,如冠狀動脈粥樣硬化、高血壓、心律失常、心力衰竭等[2-4]。大量研究證實,AngⅡ是導致活性氧產生的主要因素[12]。CaMKⅡ屬于絲氨酸/蘇氨酸蛋白激酶家族, 活性氧作用的主要靶蛋白之一。 CaMKⅡ的增加或活性的提高將導致鈣離子平衡失調和活性氧繼續增加,導致心力衰竭[13]。CaMKⅡ也存在Ca2+/CaM非依賴性激活,包括磷酸化激活和氧化激活。活性氧誘導的氧化反應使CaMKⅡ調節域的甲硫氨酸殘基Met28l/282氧化,轉變成OX-CaMKⅡ,CaMKⅡ呈現持續激活狀態。CaMKⅡ的氧化主要是通過NADPH氧化酶和線粒體產生的活性氧,NADPH氧化酶通路的基因敲除或是活性氧的清除將減少CaMKⅡ的氧化[14]。MsrA也將使OX-CaMKⅡ可逆,從而減少對心肌的損害和心臟重構[15]。
白藜三醇是一種自然的酚類化合物。白藜三醇主要調節脂肪細胞、成纖維細胞生物學、血小板活性、血管功能、氧化應激、炎癥等對心血管產生保護[16]。其中,抗氧化應激主要是通過抑制NADPH氧化酶、增加沉默信息調節因子2相關酶1(SIRT1)/叉形頭轉錄因子O亞家族(FOXO)及核因子E2相關因子2(Nrf2)依賴性轉錄從而減少活性氧產生[17]。
心率的增加將使單位時間收縮的次數增加,從而影響細胞間隙,最終影響傳導速度[18]。本實驗發現快速電刺激使單位時間收縮的次數增加,致AngⅡ增加和活性氧的增加,從而導致心肌細胞的凋亡。白藜三醇可以抑制NADPH氧化酶和增加活性氧的清除能力,對心肌損傷產生保護。為進一步研究白藜三醇的作用機制,我們加用NADPH氧化酶抑制劑和CaMKⅡ抑制劑組。RES+RSV組及RES+APO組可明顯降低Nox4、Nox2、P22phox蛋白表達,但RES+AIP組未見有明顯抑制作用。流式細胞檢測提示RES+RSV組較RES+APO組和RES+AIP組活性氧有明顯降低,提示白藜三醇不僅僅通過抑制NADPH氧化酶減少活性氧產生,還存在其他途徑減少活性氧。白藜三醇可增加MsrA,從而抑制OX-CaMKⅡ,減少活性氧的繼續產生,減少Caspase-3剪切蛋白表達,但在加入MsrA抑制劑時,白藜三醇對抑制心肌Caspase-3剪切蛋白表達作用消失。白藜三醇通過抑制NADPH氧化酶及增加MsrA蛋白表達,最終使Caspase-3剪切蛋白表達減少,抑制氧化應激對心肌細胞損傷。
[1] Yu J, We?wer M, Linhardt RJ, et al. The role of the methoxyphenol apocynin, a vascular NADPH oxidase inhibitor, as a chemopreventative agent in the potential treatment of cardiovascular diseases. Curr Vasc Pharmacol, 2008, 6: 204-217.
[2] Tsutsui H, Kinugawa S, Matsushima S. Mitochondrial oxidative stress and dysfunction in myocardial remodelling. Cardiovasc res, 2009, 81: 449-456.
[3] Youn JY, Zhang J, Zhang Y, et al. Oxidative stress in atrial fibrillation: an emerging role of NADPH oxidase. J Mol Cell Cardiol, 2013, 62: 72-79.
[4] 左友梅, 高杉, 張野. 氧化應激與心室重構: 氧自由基-MAPK-NF-κB 信號轉導通路. 國際麻醉學與復蘇雜志, 2010 , 5: 459-461.
[5] Erickson JR, He BJ, Grumbach IM, et al. CaMKⅡ in the cardiovascular system: sensing redox states. Physiol rev, 2011, 91: 889-915.
[6] Li H, Xia N, F?rstermann U. Cardiovascular effects and molecular targets of resveratrol. Nitric Oxide, 2012, 26: 102-110.
[7] Baczko I, Liknes D, Yang W, et al. Characterization of a novel multifunctional resveratrol derivative for the treatment of atrial fibrillation. Br J Pharmacol, 2014, 171: 92-106.
[8] He T, Guan X, Wang S, et al. Resveratrol prevents high glucoseinduced epithelial-mesenchymal transition in renal tubular epithelial cells by inhibiting NADPH oxidase/ROS/ERK pathway. Mol Cell Endocrinol, 2015, 402: 13-20.
[9] 張琳, 李東野, 王志榮, 等. 新生大鼠心肌細胞原代培養方法的改良. 徐州醫學院學報, 2008, 28: 303-306.
[10] 張曉萍, 彭景燕, 熊君宇. 羅哌卡因預處理對其誘導 ND7/23 細胞毒性的影響. 中華麻醉學雜志, 2011, 31: 463-464.
[11] 劉亞洋, 李鶴, 吳宗貴, 等. 晚期糖基化終產物對大鼠血管外膜成纖維細胞中煙酰胺腺嘌呤二核苷酸磷酸氧化酶 P22phox 亞基及活性氧表達的影響. 中國循環雜志, 2012, 27: 228-231.
[12] Rosenbaugh EG, Savalia KK, Manickam DS, et al. Antioxidant-based therapies for angiotensin Ⅱ-associated cardiovascular diseases. Am J Physiol-Regul Integr Com Physiol, 2013, 304: R917-R928.
[13] Swaminathan PD, Purohit A, Hund TJ, et al. Calmodulin-dependent protein kinase Ⅱ: linking heart failure and arrhythmias. Cir Res, 2012, 110: 1661-1677.
[14] Purohit A, Rokita AG, Guan X, et al. Oxidized Ca2+/calmodulindependent protein kinase II triggers atrial fibrillation. Circulation, 2013, 128: 1748-1757.
[15] He BJ, Mei-ling AJ, Singh MV, et al. Oxidation of CaMKⅡdetermines the cardiotoxic effects of aldosterone. Nat Med, 2011, 17: 1610-1618.
[16] Petrovski G, Gurusamy N, Das DK. Resveratrol in cardiovascular health and disease. Ann N Y Acad Sci, 2011, 1215: 22-33.
[17] Tang PC, Nq YF, Ho S, et al. Resveratrol and cardiovascular healthpromising therapeutic or hopeless illusion? Pharma Res, 2014, 90: 88-115.
[18] Inoue N, Ohkusa T, Nao T, et al. Rapid electrical stimulation of contraction modulates gap junction protein in neonatal rat cultured cardiomyocytes: involvement of mitogen-activated protein kinases and effects of angiotensin Ⅱ receptor antagonist. J Am Coll Cardiol, 2004, 44: 914-922.
Resvertrol Suppressing the Rapid Electrical Stimulation Incurred Oxidative Stress Injury in Neonatal Rats Cardiomyocytes With its Possible Mechanisms
GE Li-qi, LI Cheng-zong, CHENG Ming-yue, ZHANG Chao-qun, WANG Zhi-rong.
Department of Cardiology, Affiliated Hospital of Xuzhou Medical College, Xuzhou ( 221000), Jiangsu, China
Objective: To explore the protective mechanism of resvertrol (RSV) suppressing the rapid electrical stimulation incurred oxidative stress injury in neonatal rats cardiomyocytes.
Resvertrol; Rapid electrical stimulation; Neonatal rats cardiomyocytes; NADPH oxidase; MsrA
2014-11-26)
(編輯:許 菁)
221000 江蘇省徐州市,徐州醫學院附屬醫院 心內科
葛力萁 碩士研究生 主要從事心律失常防治的基礎與臨床研究 Email:woshigeliqi@163.com 通訊作者:王志榮 Email: xzzrw@163.com
R54
A
1000-3614(2015)07-0684-05
10.3969/j.issn.1000-3614.2015.07.017

