Th1/Th2平衡在結核分枝桿菌免疫中的研究進展①
岳麗敏 秦峻嶺 王春芳 王春鳳 錢愛東 (吉林農業大學動物科學技術學院,長春130118)
?
Th1/Th2平衡在結核分枝桿菌免疫中的研究進展①
岳麗敏秦峻嶺王春芳王春鳳錢愛東(吉林農業大學動物科學技術學院,長春130118)
①本文為國家自然科學基金項目(No.31272566,No.31302124)和吉林省科技發展計劃項目(20090219,20120235)。
Th1/Th2細胞是機體內最重要的CD4+T細胞亞群,在機體抵抗外界感染中起到了重要的作用。機體的免疫保護作用也主要來源于Th1/Th2的相對平衡。如果這種平衡被打破,機體將會出現免疫低下,甚至不同程度的病理變化。目前利用該平衡在腫瘤、移植免疫抑制及慢性疾病中的應用越來越受到廣大學者的重視,而在結核病中的作用報道較少。本文就Th1/Th2細胞在結核分枝桿菌感染中的變化及在治療方面的相關研究作一綜述。
1 Th1/Th2細胞免疫學的特點
隨著Th1細胞和Th2細胞最早由Mosmann和Coffman在1986年提出后,這些年研究人員對Th1 和Th2細胞的分化進行了概括(圖1)[1-3]: Th1和Th2是由Th0在一定的條件下分化的T細胞亞群,它們在機體免疫系統中起著不同的免疫作用,但都是機體免疫系統中不可分割的部分。Th1細胞主要參與細胞免疫,刺激單核細胞的分化,能引起組織的炎癥反應; Th2細胞主要參與體液免疫,可引起變態反應,控制寄生蟲的感染。Th1細胞和Th2細胞在發揮作用的同時分泌多種細胞因子。Th1細胞主要分泌IL-1、IL-2、IL-12、IL-15、IL-18、IFN-γ和TNF。Th2主要分泌IL-4、IL-5、IL-6、IL-10、IL-13和GMCSF[4]。Th1和Th2細胞分泌的細胞因子可促進自身因子的生成,又可抑制對方因子的分泌。細胞因子之間相互影響、相互制約調控疾病的發展[5,6]。Th1細胞和Th2細胞還擁有各自特異性轉錄因子,分別是T-bet和GATA-3。T-bet在Th1細胞內選擇性地表達,同時在IFN-γ生成中起正反饋作用。它不僅促進Th1細胞產生IFN-γ,還促進Th2細胞也分泌IFN-γ。此外,它還抑制一些Th2細胞因子的表達[7]。GATA-3除了利于Th0向Th2分化外,還在IL-4和IL-5因子的表達中起關鍵性作用。
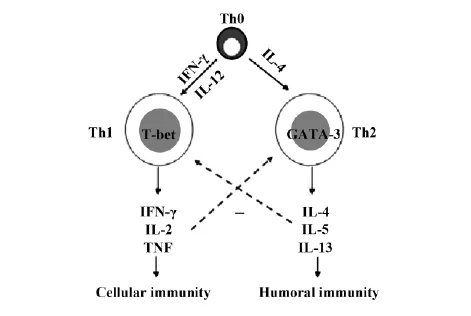
圖1 Th1和Th2細胞的分化Fig.1 Differentiation of Th1 and Th2 cells
2 Th1/Th2細胞在結核分枝桿菌感染的作用
結核分枝桿菌感染機體后,能否被消除,并不是Th1細胞發揮作用越強越好,它需要Th2細胞對其抑制,以減少Th1細胞在免疫過程中給機體帶來的炎癥反應。因此Th1/Th2的相對平衡在抵抗結核分枝桿菌感染中至關重要。
2.1 Th1細胞在結核分枝桿菌感染中的作用Th1細胞主要通過誘導巨噬細胞活化和控制結核分枝桿菌復制來抵抗該菌的感染。Th1細胞在發揮作用時離不開相關因子的參與。IFN-γ和TNF-α在抗結核分枝桿菌感染的免疫中起到關鍵性作用,這主要體現在能激活單核細胞并維護肉芽腫的完整性方面[8];活化T細胞產生的IL-2可影響活化細胞的壽命,并對其效應功能的發揮起積極作用[9]; IL-12是Th0向Th1分化中最核心的因子,它還能正調節IFN-γ的分泌,在激活的單核細胞和T細胞之間也起到了橋梁的作用,除此之外,它還能促進CD4+CD25-T細胞的擴增并表達激活標志[10]。
2.2 Th2細胞在結核分枝桿菌感染中的作用雖然Th1細胞是抗胞內菌感染的主要細胞,但Th2細胞在抗結核感染中也具有不可忽視的作用。Wu等[11]在比較結核病人和健康人體內的IL-4時發現,結核病人表達少量的IL-4,認為IL-4表達過低可能是導致肺結核出現嚴重病變的主要因素。雖然Th2細胞在一定水平上能夠降低Th1細胞給機體帶來的傷害,但Th2細胞表達過剩會抑制Th1細胞的作用,為結核分枝桿菌在體內生存提供有利條件。Ashenafi等[12]在活動期肺結核病人的肺內就檢測到了高水平的IL-4和低水平的IFN-γ。由此可見,使Th1/Th2達到相對平衡才能從根本上治療結核。
3 Th1/Th2細胞亞群的失調在結核分枝桿菌感染中的作用
對不同時期結核病人體內Th1/Th2細胞因子進行檢測時發現,機體內這兩種細胞因子的表達存在很大差異,而這可能就與該病的預后有關。胥萍等[13]在對不同感染程度的結核病人進行檢測時發現:隨著病情的加重,Th1細胞因子表達量下降加劇,且Th1/Th2嚴重失衡。崔海燕等人[14]在結核性胸膜炎患者體內檢測出了高含量的IFN-γ。Asma khanniche等[15]在非活動期結核患者體內發現Th1細胞因子表達呈現下降趨勢。除此之外,在感染耐藥結核分枝桿菌的病人體內也發現Th1細胞免疫受抑制的現象。Tan[16]在多重耐藥結核病人體內檢測到Th1細胞被抑制,其細胞因子IFN-γ、IL-2表達量下降,而Th2細胞處于激活狀態,表達了較高的IL-4、IL-6和TNF-α。因此一些學者提出了一種假設: Th1/Th2細胞的轉移是否會造成結核分枝桿菌感染向慢性轉化或導致其耐藥性的出現。但是為什么會出現這種現象的免疫機制有待探索。
Th1和Th2細胞因子在體內分布的不均衡可能會導致Th1/Th2平衡漂移。相關研究結果顯示外周血和肺組織細胞因子確實存在差異。Sharma等[17]對粟粒性結核病人進行檢測時發現外周血中高表達IFN-γ,肺內病變部位主要表達Th2細胞因子。這種不平衡的分布可能與一些調節因子有關。Ankathatti Munegowda等[18]證明單獨缺陷IL-6或IL-10時,會使CD4+Th2細胞轉變成Th1細胞。de Paus等[19]發現IFN-α和IFN-β能夠抑制IFN-γ的免疫反應并減少巨噬細胞分泌Th1型細胞因子。同時Bo Wu等在感染肺結核病人的外周血中檢測到了低水平的IFN-γ、IL-12β、IL-12α和IL-23mRNA含量,卻發現了高水平IL-9的mRNA。如果加入IL-9的特異性抗體,則體內IFN-γ的含量就會大大地增加[20]。此外,他還首次證明了在感染結核時IL-24 對IFN-γ的表達起到了正調節作用[21]。在肺結核病人的病變部位,Pradip.Saha等觀察到含有大量的CXCR3+CCR5+細胞聚集,而且它能促進IFN-γ的產生[22]。Tregs細胞是免疫系統中最重要的調節細胞,在Tregs對IFN-γ調節的研究方面,Shimon Sakaguchi等[23]觀察到: Treg細胞通過促進IL-10和TGF-β的分泌抑制T細胞產生IFN-γ。但陳心春等[24]通過CD4+CD25+調節性T細胞促進了結核患者體內細胞因子IFN-γ及IL-10的分泌。因此,Treg在結核病患者體內的具體作用還不是很清楚[25]。關于是否是調節因子控制著機體內細胞因子的分布還有待進一步的研究,此外這些調節因子是如何對細胞因子作用的也同樣需要探討。
病變部位的微環境也可能對細胞因子的變化造成影響,從而導致平衡的失調。Li等[26]已經證明了來自結核病人的胸膜液可以導致從健康人體內分離的Th1細胞發生功能紊亂,且抑制Th1細胞的分化和阻止其發揮免疫效應。為了進一步驗證,他又用結核病人的胸膜液作用分離于BCG刺激后胸膜液中的CD4+T細胞,檢測到胸膜液以劑量依賴的形式抑制CD4+T細胞分泌IFN-γ、IL-2和TNF-α,從而猜測局部產生的胸膜液可能會破壞CD4+T細胞產生的免疫反應[27]。
4 Th1/Th2平衡失調與結核分枝桿菌感染的治療
4.1通過細胞因子治療結核分枝桿菌的感染通過細胞因子對結核分枝桿菌進行治療已經成為一個新的研究方向。王霞芳[28]通過向感染結核的小鼠體內注入外源的IFN-γ,證實了該細胞因子具有增強小鼠抵抗結核分枝桿菌免疫保護力的能力。Ma等[29]認為建立在IL-24基礎上的免疫治療能起到很好的抑制結核分枝桿菌感染的目的。Zhang等[30]通過減少肺結核病人體內的CD19+CD5+CD1d+調節性B細胞來恢復抗結核特異性抗原IL-22的反應達到有效的治療。從這些實驗成果中我們可以看到通過細胞因子治療結核病具有一定的參考價值。
除此之外,細胞因子還能夠提高結核分枝桿菌疫苗的免疫效果。張豐經等[31]成功地構建了重組卡介苗———rBCG-IL-12p70-TB10.4,該重組卡介苗誘導產生的特異性細胞免疫應答比BCG產生的應答強且持久。李暉等[32]將IL-12表達質粒與結核分枝桿菌的Mtb8.4基因疫苗聯合免疫給小鼠,觀察到該表達質粒能夠在一定程度上增強Mtb8.4基因疫苗提供的保護力。陳麗萍等[33]則檢測到T-bet佐劑有利于Ag85B抗結核疫苗發揮免疫作用,顯著地誘導Th1細胞免疫。在結核分枝桿菌治療模型中,So-Shin Ahn等采用IL-7作為結核分枝桿菌DNA疫苗的佐劑提高了抗原特異性T細胞的反應[34]。
4.2構建細胞因子相關的融合基因疫苗目前有很多將表達細胞因子和結核分枝桿菌抗原的融合基因做成疫苗的報道,這種疫苗在一定程度上提高了機體的抵抗力,為結核分枝桿菌感染的治療和預防開辟了另一條新的道路。Shi等[35]建立了HSP65-IL-2-DNA融合基因疫苗,發現該疫苗的免疫原性和保護性均優于HSP65-DNA疫苗,之后又在大腸桿菌體內成功地表達出了IL-12與結核分枝桿菌Rv1759c結構域的融合蛋白[36]。鄧儀昊等[37]構建了能夠表達IL-12p70-Ag85A融合蛋白的重組卡介苗。鄧儀昊[38]在比較rBCG-IL-12p70-MPT64重組疫苗與卡介苗時,證實了該重組疫苗能提供很好的保護力。郝牧等[39]在該領域同樣也有重大的突破,將人IL-12和結核分枝桿菌ESAT-6抗原建立聯合疫苗,能明顯地刺激機體的細胞免疫和穩定體液免疫,使機體形成足夠的免疫力。這些研究的方向都為以后結核分枝桿菌的預防和治療奠定了基礎。
5 展望
雖然通過細胞因子可能達到結核治療的目的,但該技術還不成熟。由于就目前研究的結果來看,處在不同的結核感染期及感染的毒株存在差異等原因,其不同的結核病人體內Th1/Th2漂移的方向不同,不能盲目地通過細胞因子進行治療結核。而且,對于細胞因子在疫苗設計中達到的免疫效果也并不是十分完美,仍然需要研究人員不斷地對其完善。對于Th1/Th2漂移的研究還只是起步,特別是在慢性結核分枝桿菌感染中,現在只是觀察到了這種現象,然而為什么出現向Th2漂移及其機制有待進一步的研究。而調節因子在Th1和Th2平衡中的調節機制更值得我們進行研究與探討,這對于結核病的預防和治療具有重要的參考價值。
參考文獻:
[1]Zhu JF,Jankovic D,Oler AJ,et al.The transcription factor T-bet is induced by multiple pathways and prevents an endogenous Th2 cell program during Th1 cell responses[J].Immunity,2012,37(4) : 660-673.
[2]Chiu HY,Cheng YP,Tsai TF.T helper type 17 in psoriasis: From basic immunology to clinical practice[J].Dermatol Sin,2012,30 (4) : 136-141.
[3]Ottenhoff TH.New pathways of protective and pathological host defense to mycobacteria[J].Trends Microbiol,2012,20 (9 ) : 419-428.
[4]Raghupathy R.Th1-type immunity is incompatible with successful pregnancy[J].Immunol Today,1997,18(10) : 478-482.
[5]Robinson CM,Jung JY,Nau GJ.Interferon-γ,tumor necrosis factor,and interleukin-18 cooperate to control growth of Mycobacterium tuberculosis in human macrophages[J].Cytokine,2012,60 (1) : 233-241.
[6]Mayer-Barber KD,Andrade BB,Barber DL,et al.Innate and adaptive interferons suppress IL-1α and IL-1β production by distinct pulmonary myeloid subsets during mycobacterium tuberculosis infection[J].Immunity,2011,35(6) : 1023-1034.
[7]Szabo SJ,Kim ST,Costa GL,et al.A novel transcrip tion factor,T-bet,directs Th1 line2 age commitment[J].Cell,2000,100: 655-669.
[8]Jacobs M,Togbe D,Fremond C,et al.Tumor necrosis factor is critical to control tuberculosis infection[J].Microbes Infect,2007,9 (5) : 623-628.
[9]Hoyer KK,Dooms H,Barron L,et al.Interleukin-2 in the development and control of inflammatory disease[J].Immunol Rev,2008,226(1) : 19-28.
[10]King IL,Segal BM.Cutting edge: IL-12 induces CD4+CD25-T cell activation in the presence of T regulatory cells[J].J Immunol,2005,175(2) : 641-645.
[11]Wu HP,Wu CL,Yu CC,et al.Efficiency of interleukin-4 expression in patients with tuberculosis and nontubercular pneumonia[J].Hum Immunol,2007,68(10) : 832-838.
[12]Ashenafi S,Aderaye G,Bekele A,et al.Progression of clinical tuberculosis is associated with a Th2 immune response signature in combination with elevated levels of SOCS3[J].Clin Immunol,2014,151(2) : 84-99.
[13]胥萍,施美華,費曉峰,等.肺結核患者外周血中Th細胞極化偏移及臨床意義分析[J].中國免疫學雜志,2010,26 (2) : 178-185.
[14]崔海燕,張青,粟波,等.結核性胸膜炎患者Th1/Th2及前炎癥細胞因子的變化[J].中華臨床醫師雜志,2012,6 (14) : 4109-4111.
[15]Asma khanniche,王穎,沙巍,等.Th1和Th17細胞在活動期肺結核病患者外周比例失衡的臨床研究[J].現代免疫學,2012,32(5) : 387-391.
[16]Tan Q,Xie WP,Min R,et al.Characterization of Th1-and Th2-type immune response in human multidrug-resistant tuberculosis [J].Eur J Clin Microbiol,2012,31(6) : 1233-1242.
[17]Sharma SK,Mitra DK,Balamurugan A,et al.Cytokine Polarization in Miliary and Pleural Tuberculosis[J].J Clin Immunol,2002,22 (6) : 345-352.
[18]Ankathatti Munegowda M,Xu S,Freywald A.CD4+Th2 cellsfunction alike effector Tr1 and Th1 cells through the deletion of a single cytokine IL-6 and IL-10 gene[J].Mol Immunol,2012,51 (2) : 143-149.
[19]de Paus RA,van Wengen A,Schmidt I,et al.Inhibition of the type I immune responses of human monocytes by IFN-α and IFN-β[J].Cytokine,2013,61(2) : 645-655.
[20]Wu B,Huang C,Kato-Maeda M,et al.IL-9 is associated with an impaired Th1 immune response in patients with tuberculosis[J].Clin Immunol,2008,126(2) : 202-210.
[21]Wu B,Huang C,Kato-Maeda M,et al.IL-24 modulates IFN-γ expression in patients with tuberculosis[J].Immunol Lett,2008,117(1) : 57-62.
[22]Saha PK,Sharma PK,Sharma SK,et al.Recruitment of Th1 effector cells in human tuberculosis: Hierarchy of chemokine receptor(s) and their ligands[J].Cytokine,2013,63(1) : 43-51.
[23]Shimon Sakaguchi,Kajsa Wing,Yasushi Onishi,et al.Regulatory T cells: how do they suppress immune responses?[J].Int Immunol,2009,21(10) : 1105-1111.
[24]陳心春,周伯平,鄧群益,等.CD4+CD25+調節性T細胞對肺結核患者特異細胞免疫的調節作用[J].中國防癆雜志,2008,30(3) : 165-169.
[25]Hyo-Jeong Lin,Jong Sun Park.CD4+Foxp3+T regulatory cells in drug-susceptible and multidrug-resistant tuberculosis[J].Tuberculosis,2013,93(5) : 523-528.
[26]Li Q,Li L,Liu Y,et al.Pleural fluid from tuberculous pleurisy inhibits the functions of T cells and the differentiation of Th1 cells via immunosuppressive factors[J].Cell Mol Immunol,2011,8: 172-180.
[27]Li Q,Li L,Liu Y,et al.Biological functions of Mycobacterium tuberculosis-specific CD4+T cells were impaired by tuberculosis pleural fluid[J].Immunol Lett,2011,138(2) : 113-121.
[28]王霞芳,吳妹英,徐培君,等.干擾素-γ對小鼠結核病的實驗研究[J].抗感染藥學,2008,5(4) : 236-240.
[29]Ma YF,Chen HD.Interleukin 24 as a novel potential cytokine immunotherapy for the treatment of Mycobacterium tuberculosis infection[J].Microbes Infect,2011,13(12-13) : 1099-1110.
[30]Zhang MZ,Zeng GC,Yang QT,et al.Anti-tuberculosis treatrment enhances the production of IL-22 through reducing the frequencies of regulatory B cell[J].Tuberculosis,2013,dx.doi.org/10.1016/j.tube.2013.12.003.
[31]張豐經,何紅云,鄧儀昊,等.重組結核病疫苗rBCG-IL-12p70-TB10.4的免疫效應[J].基礎醫學與臨床,2014,34 (1) : 93-97.
[32]李暉,李強,鐘森,等.結核分枝桿菌Mtb84基因疫苗與人白細胞介素12表達質粒聯合免疫的細胞免疫應答觀察[J].解放軍醫學雜志,2007,32(3) : 229-244.
[33]陳麗萍,張榮波,胡東,等.T-bet佐劑對Ag85B抗結核DNA疫苗的免疫調節[J].細胞與分子免疫學雜志,2012,28(7) : 680-683.
[34]Ahn SS,Jeon BY,Park SJ,et al.Nonlytic Fc-fused IL-7 synergizes with Mtb32 DNA vaccine to enhance antigen-specific T cell responses in a therapeutic model of tuberculosis[J].Vaccine,2013,31(27) : 2884-2890.
[35]Shi CH,Zhang H,Wang LM,et al.Therapeutic efficacy of a tuberculosis DNA vaccine encoding heat shock protein 65 of Mycobacterium tuberculosis and the human interleukin 2 fusion gene[J].Tuberculosis,2009,89(1) : 54-61.
[36]師長虹,江鷹,毛峰峰,等.結核分枝桿菌Rv1759c結構域與IL-2融合蛋白的表達與鑒[J].現在生物醫學進展,2011,11(6) : 1001-1004.
[37]鄧儀昊,何紅云,張本斯.人細胞因子IL-12p70與結核分枝桿菌特異性抗原Ag85A融合基因重組卡介苗的構建及鑒定[J].實用醫學雜志,2012,28(24) : 4038-4040.
[38]鄧儀昊,何紅云,王勇,等.重組結核病疫苗rBCG-IL-12p70-MPT64免疫原性研究[J].中國現代醫學雜志,2013,23(20) : 29-34.
[39]郝牧,鮑朗,高蕾,等.人IL-12與結核分枝桿菌抗原ESAT-6聯合基因疫苗的免效果觀察[J].微生物學報,2007,47(3) : 477-481.
[收稿2014-04-21修回2014-05-15]
(編輯張曉舟)
doi:10.3969/j.issn.1000-484X.2015.10.030
通訊作者及指導教師:王春鳳(1972年-),女,博士,教授,博士生導師,主要從事動物微生態和黏膜免疫研究,E-mail: wangchunfeng@ jlau.edu.cn。錢愛東(1960年-),男,博士,教授,博士生導師,主要從事動物微生物與分子免疫學的研究,E-mail: qianaidong0 115@ 163.com。
作者簡介:岳麗敏(1987年-),女,E-mail: min241987yue@ 163.com。
文章編號1000-484X(2015) 10-1426-04
文獻標志碼A
中圖分類號R392