Keap1-Nrf2-ARE信號通路與2型糖尿病氧化應激相關性研究進展
Keap1-Nrf2-ARE信號通路與2型糖尿病氧化應激相關性研究進展
宋媛李虹閆海震趙倉煥歐仕益1
(暨南大學附屬第一醫院,廣東廣州510632)
關鍵詞〔〕Keap1-Nrf2-ARE信號通路;2型糖尿病;氧化應激
中圖分類號〔〕R587.1〔
基金項目:暨南大學附屬第一醫院科研培育
1暨南大學理工學院
第一作者:宋媛(1979-),女,博士,主治醫師,主要從事中藥藥性理論的分子生物學研究。
研究表明糖尿病(DM)病因和發病機制與遺傳、環境、病毒感染、肥胖、種族、營養物質代謝和內分泌失調等因素有關〔1,2〕。Keap1-Nrf2-ARE信號通路是近年來抗氧化研究領域的熱點,以Keap1-Nrf2-ARE信號通路介導多種抗氧化基因和Ⅱ相解毒酶的轉錄,被認為是抗氧化機制中最重要的通路。激活Keap1-Nrf2-ARE信號通路,減少活性氧(ROS)的產生,改善氧化應激(OS)誘導的胰島素抵抗(IR),以糾正DM高糖因素導致的組織細胞生化功能紊亂,發揮其抗OS、抗慢性炎癥反應的細胞保護功能,在DM發生發展中起著非常重要的作用,本文對Keap1-Nrf2-ARE信號通路與DM OS相關性作一綜述。
1Keap1-Nrf2-ARE信號通路與OS
Keap1-Nrf2-ARE信號通路的核心分子包括核轉錄因子紅細胞系-2p45(NF-E2)相關因子-2(Nrf2)、抗氧化反應元件(ARE)和Kelch樣環氧氯丙烷相關蛋白-1(Keap1)。
1.1Nrf2、Keap1與ARE〔3~7〕Nrf2分子量為66 kD,屬于轉錄因子cap'n'collar(CNC)家族成員,含有一高度保守的堿性亮氨酸拉鏈(bZIP)結構,在肝臟、腎臟、肺、消化道等器官高表達,是新近發現的一種對OS非常敏感的基因轉錄因子,也是細胞OS反應中的關鍵因子和中樞調節者。它是ARE的激活因子,在抵抗外來刺激、 保護機體功能和ARE介導的抗氧化基因表達中發揮極其重要的作用。
Keap1是分子量為69 kD的細胞質蛋白伴侶分子,有5個主要結構域,是調控Nrf2所必需的結構域。Keap1主要調控Nrf2的轉錄活性,對Nrf2的功能起負性調控作用。
ARE存在于胞核中,是一個特異的DNA啟動子結合序列,位于谷胱甘肽S-轉移酶(GST)、煙酰胺腺嘌呤二核苷酸(磷酸)〔NAD(P)H〕:醌氧化還原酶1(NQO1)、谷氨酰半胱氨酸連接酶(GCL)、過氧化氫酶(CAT)、超氧化物歧化酶(SOD)、血紅素氧化酶(HO)-1等Ⅱ相解毒酶和抗氧化酶基因的5'端啟動序列,這一序列能被多種氧化性和親電性化合物激活,從而啟動Ⅱ相解毒酶和抗氧化酶基因的表達,保護由OS引起的組織損傷。
1.2Keap1-Nrf2-ARE信號通路的激活和作用
1.2.1通路的激活生理狀態下,Nrf2與Keap1耦聯并與胞質肌動蛋白結合被錨定在細胞質,處于一種非游離并且不斷降解的非活性狀態,通常Nrf2表達量維持在較低水平,從而使保護細胞的酶類和抗氧化物處于基礎表達水平,細胞處于穩定狀態。當受到ROS、親電子物質、上游信號通路-促分裂原活化蛋白激酶(MAPKs)、蛋白激酶C(PKC)和磷脂酰肌醇-3-激酶(PI3K)的刺激時,Nrf2與Keap1解離,Nrf2被激活,轉移入核,與核中小分子肌腱纖維瘤蛋白(Maf)結合形成異二聚體后并與ARE結合,從而啟動受ARE調控的Ⅱ相解毒酶、氧化還原酶類和轉運蛋白基因的轉錄(見圖1),提高細胞的抗OS及損傷修復能力,從而避免很多疾病的發生和發展,其中Ⅱ相解毒酶和氧化還原酶是目前的研究熱點,但其詳細的調控機制尚未闡明〔8,9〕。Nrf2與Keap1解耦聯是Nrf2 激活的重要環節,主要通過兩種途徑:一是活性氧或親電子化合物的直接作用;二是磷酸化蛋白的作用。研究表明MAPKs〔細胞外信號調節激酶(ERK)、p38、c-jun氨基末端激酶(JNK)〕、PKC、PI3K等也參與調控Keap1-Nrf2-ARE信號通路的激活及其相關基因的表達〔10〕。
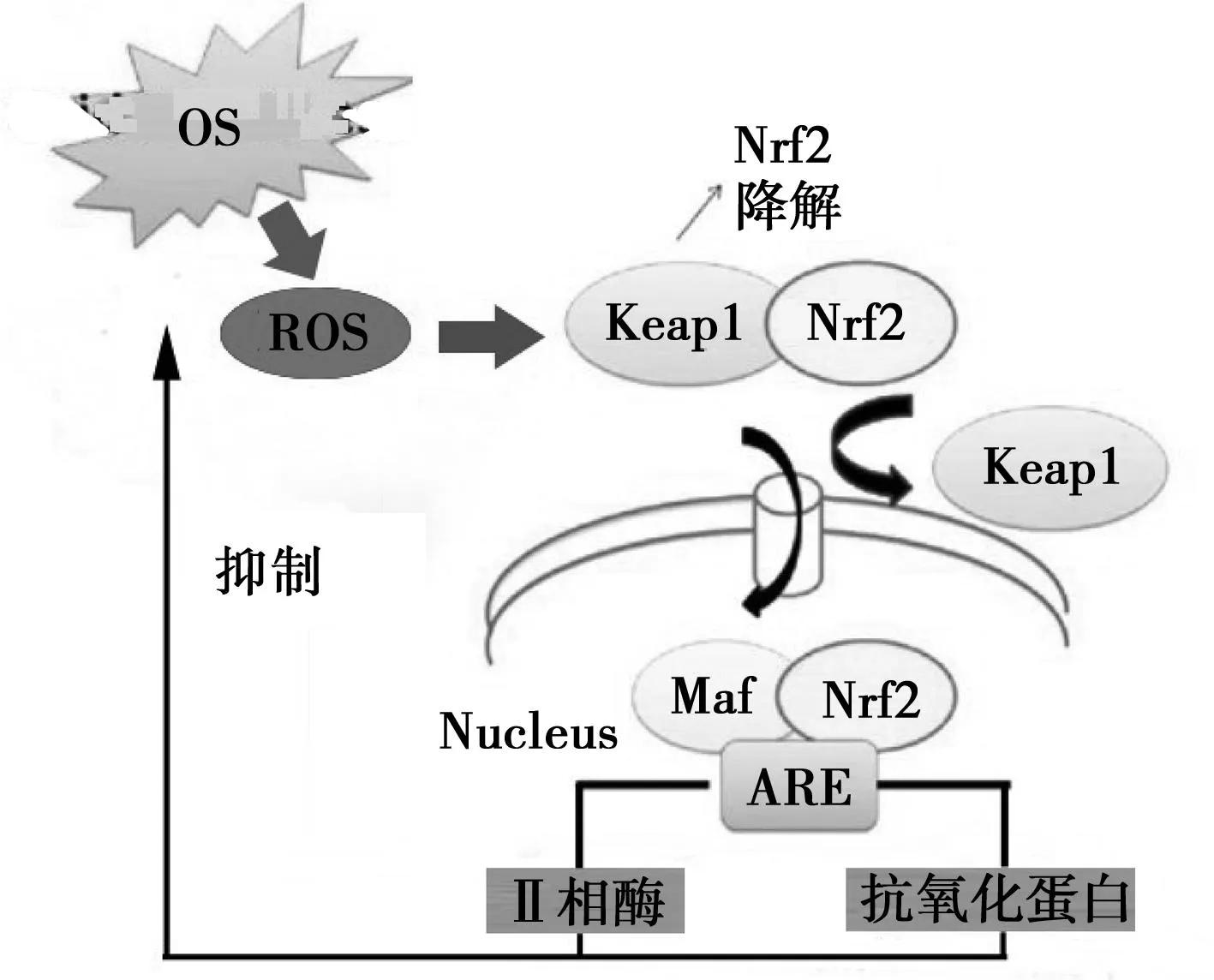
圖1 OS激活Nrf2/ARE信號通路示意圖
1.2.2通路的作用OS產生的ROS直接或間接地損傷細胞內蛋白質、脂質、核酸等大分子物質的生理功能,是眾多疾病發生發展的病理生理基礎。機體在應對ROS損害時形成了一套復雜的抗OS系統,近年來研究表明,Keap1-Nrf2-ARE信號通路在細胞抗OS和外源性有毒物質誘導的主要防御機制中發揮著極其重要的作用,是迄今為止發現的最為重要的內源性抗OS通路〔11~13〕。在Nrf2基因敲除小鼠的基礎及誘導性抗氧化基因表達明顯降低,而OS損傷明顯增強,提示Keap1-Nrf2-ARE通路是調節細胞內氧化還原狀態的關鍵〔14〕。研究表明,Keap1-Nrf2-ARE信號通路具有抗氧化、抗炎、抗細胞凋亡、抗組織損傷、免疫調節、解毒等作用,通過對該通路的調節,在抗腫瘤、抗動脈粥樣硬化、抗衰老及心臟、肝臟、神經保護等發揮多面的作用〔15~17〕。可見,Keap1-Nrf2-ARE信號通路的激活,無疑是對抗OS引起組織損傷的重要途徑。Keap1-Nrf2-ARE信號通路現已成為多種疾病防治的新靶點,也是近年來研究的熱點〔12,13〕。
2Keap1-Nrf2-ARE信號通路與2型DM(T2DM)
Nrf2介導內源性抗氧化物表達被認為是機體防御DM引起OS損傷的重要機制〔18〕,一定程度上,過量的ROS可能促進DM及其相關疾病的發生。DM高糖狀態下,細胞內的葡萄糖氧化增加,線粒體產生過多的超氧化物引起組織細胞OS損傷,OS可通過活化OS相關通路引起IR。激活Keap1-Nrf2-ARE通路可減輕糖尿病高血糖引起的OS損傷,改善OS誘導的IR。
2.1與糖代謝異常的關系高糖誘導線粒體內電子傳遞呼吸鏈產生超氧化物過多,是造成OS引起DM、IR和心血管并發癥的重要原因。激活Keap1-Nrf2-ARE通路可作用于糖代謝異常引起的OS損傷,發揮其保護功能。Cheng等〔19〕研究發現,抑制Keap1-Nrf2-ARE通路活性會引起內皮細胞功能紊亂,IR及血管生成紊亂。持續的高糖加劇氧化還原的異常調節,通過正反饋加重了DM的并發癥,表明Keap1-Nrf2-ARE信號通號在DM中起關鍵作用。Nrf2是保護防止發生DM并發癥的重要因子。He等〔20〕研究發現,Nrf2+/+的心肌細胞在高糖處理下的ROS水平要遠低于Nrf2-/-產生的ROS水平,且呈時間和濃度依賴性,并觀察到NQO1和HO-1 mRNA與蛋白表達的上調,而在Nrf2-/-心肌細胞中并無此現象,以上結果提示,Keap1-Nrf2-ARE是DM中調節ROS的一個關鍵通路。調節Nrf2可能有希望預防和治療DM及其并發癥發生。
2.2與IR的關系生理狀態下,胰島素與胰島素受體結合,通過促進胰島素受體底物(IRS)酪氨酸磷酸化而發揮作用。OS可通過活化OS敏感性信號通路引起IR。研究表明,葡萄糖氧化酶(GO)預處理肝細胞與葡萄糖相互作用生成過量的ROS引起細胞OS損傷,誘導IR。姜黃素通過誘導Nrf2核轉位,使ROS生成減少,從而減輕OS誘導的IR〔21〕。提示通過促進Nrf2核轉位并與ARE結合,發揮Keap1-Nrf2-ARE通路抗OS作用,改善OS誘導的細胞IR。
3展望
近年來研究表明,Nrf2在抗氧化損傷中起關鍵作用,能維持細胞內氧化還原平衡,使細胞免受損傷。但Nrf2持續激活,也會產生諸多不利影響,如腫瘤,動脈硬化等。綜上所述,探索具有選擇性的細胞內Nrf2活化劑Keap1的抑制劑等可能為臨床治療T2DM開辟新的途徑,Keap1-Nrf2-ARE信號通路可能是防治T2DM一個非常有前景的潛在靶點。
4參考文獻
1楊紅英,薛麗,徐勉,等.云南省彝族2型糖尿病與HLA-DRBI等位基因多態性關聯的研究〔J〕.中華醫學遺傳學雜志,2007;24(1):101-3.
2Flekac M,Skrha J,Hilgertova J,etal.Gene polymophisms of superoxide dismutase and catalase in diabetes mellitus〔J〕.BMC Med Gene,2008;9:30.
3劉薇,王紅霞,王立魁,等.COX-2/Nrf2/ARE信號通路與體內外的抗炎、抗氧化作用機理〔J〕.生命科學,2011;23(10):1027-33.
4Minerva RG,Kwak MK,Dolan PM,etal.Sensitivity to carcinogenesis is increased and chemoprotective efficacy of enzyme inducers is lost in nrf2 transcription factor-deficient mice〔J〕.Proc Natl Acad Sci USA,2001;98(6):3410-5.
5Morimitsu Y,Nakagawa Y,Hayashi K,etal.A sulforaphane analogue that potently activates the Nrf2-dependent detoxification pathway〔J〕.J Biol Chem,2002;277(5):3456-63.
6Lee JM,Calkins MJ,Chan K,etal.Identification of the NF-E2-related factor-2-dependent genes conferring protection against oxidative stress in primary cortical astrocytes using oligonucleotide microarray analysis〔J〕.J Biol Chem,2003;278(14):12029-38.
7Thimmulappa RK,Mai KH,Srisuma S,etal.Identification ofNrf2-regulated genes induced by the chemopreventive agent sulforaphane by oligonucleotide microarray〔J〕.Cancer Res,2002;62(18):5196-203.
8Lee JS,Surh YJ.Nrf2 as a novel molecular target for chemoprevention〔J〕.Cancer Lett,2005;224(2):171-84.
9Lau A,Zhang DD.Dual roles of Nrf2 in cancer〔J〕.Pharmacol Res,2008;58:262-70.
10Nguyen T,Sherratt PJ,Pickett CB.Regulatory mechanisms controlling gene expression mediated by the antioxidant response element〔J〕.Annu Rev Pharmacol Toxicol,2003;43:233-60.
11Yu X,Kensler T.Nrf2 as a target for cancer chemoprevention〔J〕.Mutat Res,2005;591:93-102.
12崔俁,馬海英,孔力.Nrf2/ARE通路與機體抗氧化機制的研究進展〔J〕.吉林大學學報(醫學版),2011;37(1):187-90.
13蔡維霞,張軍,胡大海.氧化和化學應激的防御性轉導通路-Nrf2/ARE〔J〕.中國生物化學與分子生物學報,2009;25(4):297-303.
14李航,段惠軍.Nrf2/ARE信號通路及其調控的抗氧化蛋白.中國藥理學通報,2011;27(3):300-3.
15王笑亮,王漢東.Nrf2在中樞神經系統疾病中的神經保護作用〔J〕.醫學研究生學報,2011;24(7):754-7.
16Que LL,Wang HX,Cao BS,etal.The regulation and functions of transcription factor Nrf2 in cancer chemoprevention and chemoresistance〔J〕.J Chin Pharmaceutical Sci,2011;20:5-19.
17呼海娟,崔煒,劉靜.Nrf2在心血管系統中的作用研究進展〔J〕.中華心血管雜志,2011;16(1):66-8.
18Abdul-Ghani MA,Jani R,Chavez A,etal.Mitochondrial reactive oxygen species generation in obese non-diabetic and type 2 diabetic participants〔J〕.Diabetologia,2009;52(4):574-82.
19Cheng XH,Siow RCM,Mann GE.Impaired redox signaling and antioxidant gene expression in endothelial cells in diabetes:a role for mitochondria and the nuclear factor-E2-related factor 2-Kelch-like ECH-associated protein 1 defense pathway〔J〕.Antioxid Redox Sign,2011;14(3):469-87.
20He XQ,Kan H,Cai L,etal.Nrf2 is critical in defense against high glucose-induced oxidative damage in cardiomyocytes〔J〕.J Mol Cell Cardiol,2009;46(1):47-58.
21趙曙光,李強,王景杰,等.姜黃素誘導Nrf2核轉位對氧化應激誘導人肝細胞胰島素抵抗的影響〔J〕.現代生物醫學進展,2011;11(1):48-51.
〔2013-12-19修回〕
(編輯趙慧玲/張慧)

