單側孤立基底節區腔隙性腦梗死早期神經功能惡化的多因素分析及缺血耐受的相關性研究
蔄紅好,畢玉華,于永鵬,王勝武,趙振銘,喬曉紅,鞠衛萍
單側孤立基底節區腔隙性腦梗死,臨床可見20%~30%患者在卒中后數小時或數天內出現早期神經功能惡化(early neurological deterioration,END),可能進展為嚴重殘疾,是導致患者預后不良的主要原因之一[1-2]。該區域為脈絡膜前動脈、內囊紋狀體動脈及丘腦膝狀體動脈供血區,大多研究表明發生END多考慮為穿支動脈粥樣硬化病及低灌注造成。本研究對象排除了病灶側頸內動脈和大腦中動脈中重度狹窄的患者,目的為研究除此之外的神經功能惡化的因素,并探討其可能的機制。
1 對象與方法
1.1 研究對象 回顧性分析2012年7月-2015年6月于威海市中心醫院神經內科收治的新發的單側基底節區孤立的腔隙性腦梗死患者167例,均經腦磁共振成像(magnetic resonance imaging,MRI)、彌散加權成像(diffusion weighted imaging,DWI)、磁共振血管造影(magnetic resonance angiography,MRA)成像證實,確定為單側基底節區孤立的急性腔隙性腦梗死,病灶延續累及側腦室體部,累及皮層、皮層下半卵圓中心的病例不在本研究范圍,根據TOAST分型大動脈粥樣硬化性病變不在本研究范圍內[3];符合中國急性缺血性卒中診治指南2010版的標準,入院后24 h內完成頭顱MRI、MRA及頸部和(或)顱內血管學檢查;排除DWI提示存在急性多發部位及雙側的皮質、皮質下腔隙性梗死者;排除側腦室旁炎癥、腫瘤及脫髓鞘病變者,既往卒中遺留明顯神經功能缺失者,同時存在側腦室旁以外部位急性腦梗死患者。END定義為入院72 h內任一時刻復評美國國立衛生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)評分較入院時增加2分或2分以上。將患者分為兩組,END陽性組42例,END陰性組125例。
1.2 研究方法
1.2.1 一般資料 詳細記錄患者性別、年齡、既往史(包括高血壓、糖尿病、卒中史)、個人史(吸煙、飲酒史)、發病至入院時間、進展達高峰時間,以及相關實驗室指標(入院血糖、糖化血紅蛋白、總膽固醇、甘油三酯、低密度脂蛋白、血凝常規、C-反應蛋白、尿酸、同型半胱氨酸),均行十二導聯心電圖、心臟超聲、頸部血管彩超、TCD檢查。
1.2.2 影像學檢查 所有患者在知情同意的情況下于入院后接受1.5T(美國通用電器公司Signa l.5T)或3.0T(德國西門子公司MAGENTOM 3.0T)磁共振檢查,檢查序列包括T1加權成像、T2加權成像、彌散加權成像、液體衰減反轉回復序列及磁共振血管成像等。橫斷面掃描至少包括側腦室旁前端至后端3個解剖平面,在側腦室體部層面按梗死所在的部位可分為前型、中型、后型,于T2加權成像(或DWI)橫斷面成像判斷梗死灶是否延伸至側腦室旁放射冠后部。所有患者顱內血管學檢查由磁共振血管成像或頭頸部CT血管成像完成。
1.2.3 在院治療評估流程及END定義標準 患者入院即刻進行NIHSS評分,并由同一位評分者于入院后前3天、第7天、第14天上午或下午進行兩次NIHSS復評,選取最高分。END定義為復評NIHSS前1周內最高分較入院時增加2分或以上[4]。本研究采用盲法,對患者進行NIHSS評分的醫生對其影像學檢查結果不知情。
1.3 統計學方法 采用SPSS 16.0軟件包錄入數據并進行統計分析,定量資料滿足正態分布采用表示,不滿足則采用中位數和四分位數間距表示,組間比較采用獨立樣本t檢驗。等級資料采用數量(百分率)表示,組間比較采用χ2檢驗或Fisher精確概率法。將單因素分析中P<0.1的自變量納入各個Logistic回歸模型用以確立END的預測指標及校正混雜因素影響,并在不同年齡、性別、不同病灶位置(內囊后肢、側腦室體旁后部及放射冠區域)的患者亞組中分別進行分析。P<0.05表示差異有顯著性。
2 結果
共納入167例腦梗死患者,其中42例(25.15%)發生早期神經功能惡化(END陽性),125例(74.85%)END陰性。年齡<65歲、病灶部位累及側腦室體旁后型、收縮壓較低、無卒中病史、C反應蛋白較高、入院血糖較高以及無腦白質病變的腦梗死患者END陽性發生率較高,比較差異有顯著性(P<0.05)(表1)。
以END陽性作為因變量進行多因素的逐步Logistic回歸分析(α入=0.05,α出=0.10),將可能的影響因素作為自變量納入模型,結果顯示,年齡≥65歲、收縮壓高、有卒中史、有腦白質病變是END陽性的保護因素,OR值分別為0.831、0.569、0.797、0.963(P<0.05),病灶部位為后型、入院血糖較高是END陽性的獨立危險因素,OR值分別為4.687、1.531(P<0.05)(表2)。
考慮到有無合并糖尿病,以及病灶部位不同可能是影響年齡、卒中史、腦白質病變與END陽性關系的混雜因素,因此本研究分別以有無合并糖尿病、不同病灶位置進行分層并行層間的單因素及多因素分析,結果顯示,有無合并糖尿病、病灶部位的不同不影響年齡、卒中史、腦白質與END陽性的關系(表3)。
3 討論
腦深部基底節區腔隙性梗死是一組臨床常見的缺血性卒中,早期神經功能惡化發生率高,致殘率高,起病時往往神經功能損害輕,3~5 d病情逐漸進展至高峰期,錯過了溶栓時機,即使及時給予靜脈溶栓治療,也多不盡人意。以往學者對此研究很多,普遍認為發病機制為穿支動脈閉塞所致,然而影像學檢查很難發現這些穿支動脈病變,即使DSA檢查也很難發現頸內動脈存在局部狹窄或穿支口閉塞[1]。國內也有研究認為是低灌注分水嶺梗死所致[2],可能與豆紋動脈病變、大腦中動脈狹窄或Heubner返動脈狹窄有關[5-7]。本研究對近兩年間我院單側基底節區腔隙性腦梗死患者的相關因素進行回顧性分析,研究對象排除大動脈粥樣硬化低灌注機制,目的是盡早評估入院NHISS評分極低的腔隙性腦梗死患者,未發現有大動脈狹窄卻發生END的相關因素。本研究所得END的發生率25.15%,與既往研究的10%~40%基本一致[8],數據有所偏低可能與本研究樣本量小及排除了大動脈狹窄這部分患者有關。
本研究發現病灶部位、發病年齡、既往卒中史、腦白質病變、糖尿病史、入院收縮壓與END存在有統計學意義的相關性。END發生與病灶部位延伸累及側腦室后部有顯著相關(P<0.01),與糖尿病史、入院收縮壓與END有相關性(P<0.05),與既往多項研究結果一
致[9-11]。本研究值得探討的是既往卒中史、腦白質病變、年齡為該類型卒中的保護性因素,既往未曾有相關報道,并且與國內研究發現的腦白質病變分級與腔隙性腦梗死早期神經功能惡化無聯系結論相悖[10]。得出這一陽性結果可能與上述因素是否能夠啟動機體的缺血耐受機制相關。

表1 END陽性與陰性患者一般情況比較
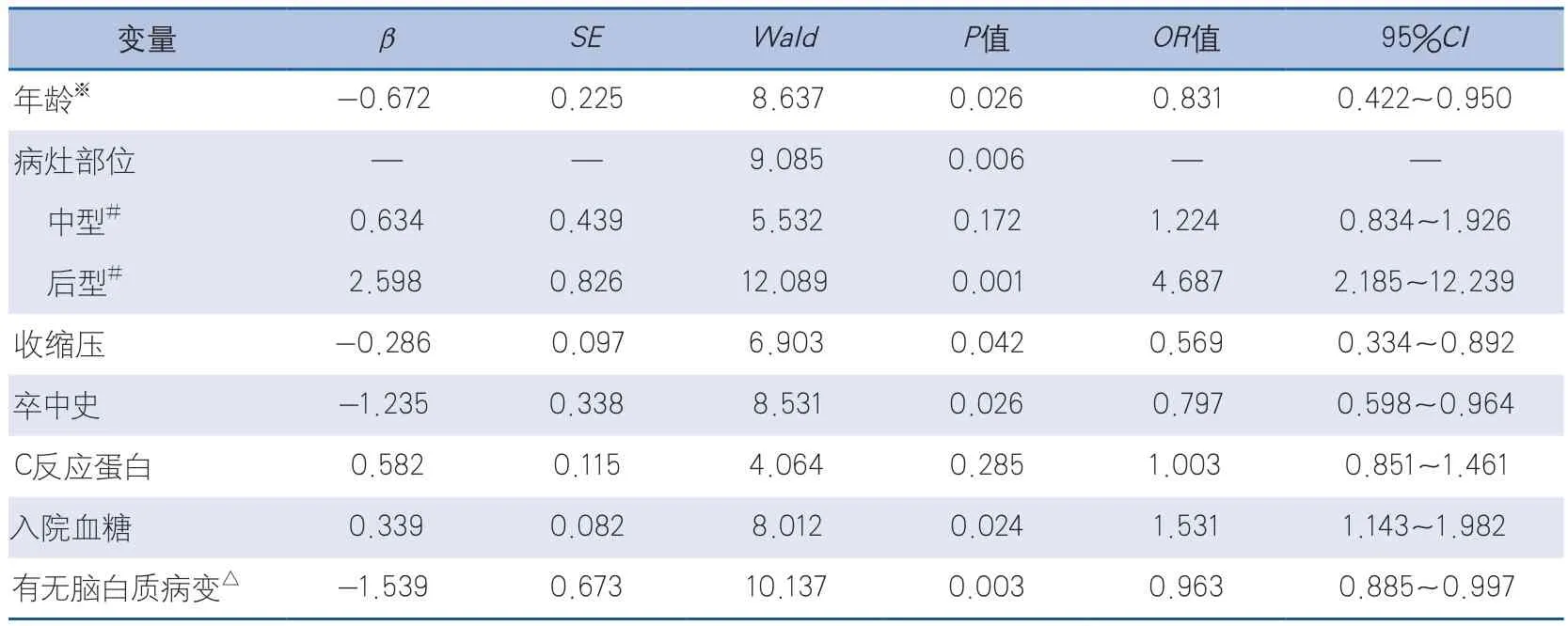
表2 影響END發生的相關危險因素的Logistic回歸分析
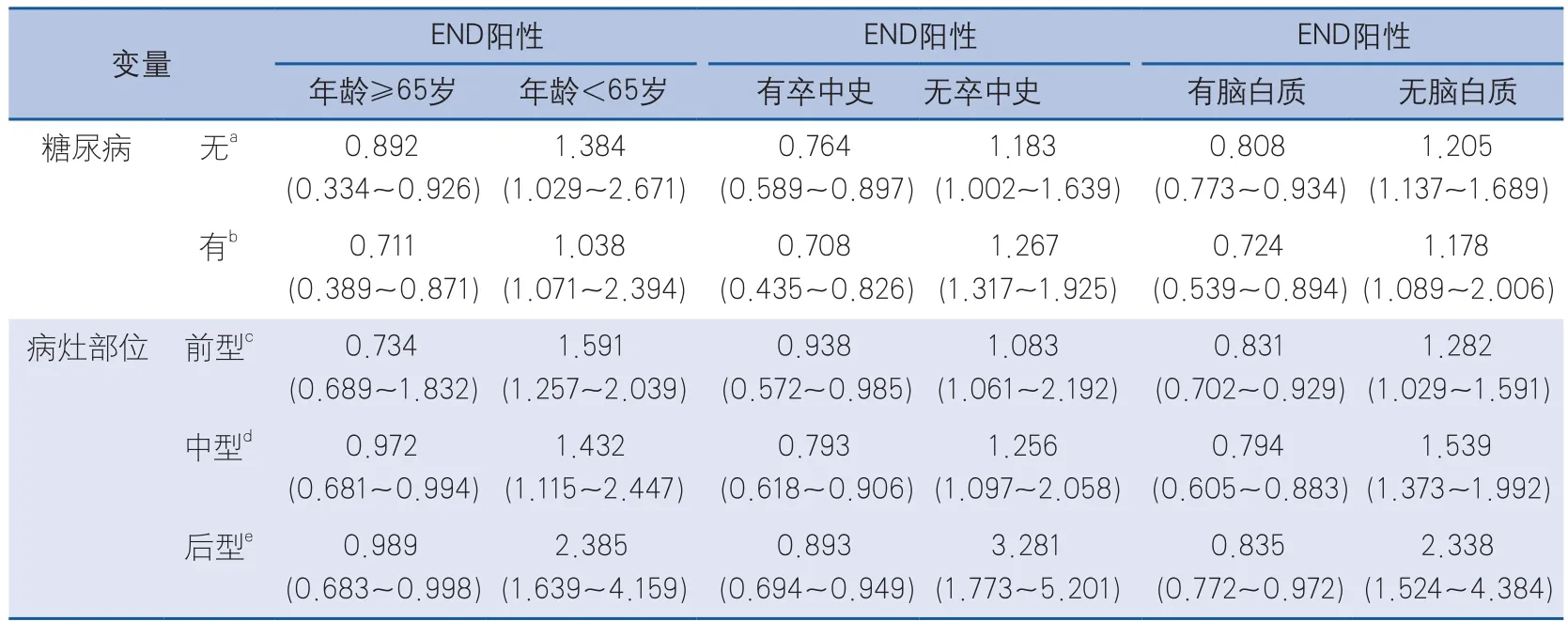
表3 腦梗死患者年齡、卒中史以及腦白質與END陽性的關系
腦缺血耐受為機體對腦缺血事件的耐受能力,指腦血流再灌注后,腦組織會產生相應的保護機制,能夠使其對以后的缺血性損傷產生保護作用,縮小缺血損傷的體積,減輕神經功能缺損。其包括缺血預處理(ischemic preconditioning,IP)及缺血后處理(ischemic postconditioning,IPC)兩大內源性保護策略。缺血預處理是一種潛意識的刺激隨后的有害缺血前應用神經保護策略,提出較早,分兩個階段進行,快速預處理(啟動3~5 min預處理刺激后,結束1 h后)和延遲預適應(開始2~3 d預處理后,結束1周后)。參與缺血預處理神經保護機制極端復雜,涉及許多信號傳導途徑和改建的基因表達。缺血后處理是近年發現的通過誘導靶器官缺血耐受從而減少缺血再灌注損傷,實現功能保護的強有效內源性保護措施。缺血后處理是一個相對較新的神經保護策略,目前腦缺血后處理誘導腦缺血耐受的機制尚不完全清楚。大量動物實驗表明,給予動物短暫性全腦或局灶性缺血對間隔一定時間后發生嚴重缺血有保護作用[11-12]。腦梗死前有短暫性腦缺血發作史,相當于腦缺血預處理,實際也為缺血后處理。臨床研究短暫性腦缺血發作對再次缺血的作用有兩種,積累性損傷及保護性耐受。國外學者研究發現,如果兩次缺血時間間隔幾小時,那么第2次缺血就會加重第1次損傷,稱為積累性損傷。如果間隔時間長,那么缺血預處理可以激發機體內在保護機制,而對再次致死性缺血損傷產生保護作用[13]。Caplan等[14]觀察到較長時間TIA對之后的缺血性卒中有較好的神經保護作用,患者的預后好于之前無TIA或有TIA但持續時間過短的患者。
腦缺血耐受的特征部分類似于天然存在的適應機制。由此本研究分析患者發病之前的腦梗死病史及腦白質病變提示的腦慢性缺血的小血管病變可能啟動了體內的內源性保護機制,為保護性耐受。腦白質病代表的慢性低灌注,多見于高血壓患者小血管病變,梗死前的微循環低灌注狀態有可能模擬缺血預處理機制,導致新基因產物的表達和細胞防御機制的強化從而對抗急性缺血損害,可能對早期神經功能存在保護作用,從而阻止病情進展加重[15-16]。年齡對于卒中來說,年齡越輕早期遭受卒中的打擊越是不能耐受,損傷越是較年齡長者為重。但對于后期的神經功能康復卻是另外一個機制,故年齡、腦梗死病史、腦白質病變僅僅對于患者早期神經功能惡化是有意義的指標之一。
綜上所述,本研究認為年齡≥65歲、收縮壓高、卒中史、腦白質病變是END陽性的保護因素。缺血不耐受為腔隙性腦梗死發生END的主要機制。而既往腦梗死病史、腦白質病變相當于一次又一次的缺血預處理和缺血后處理,能夠激活機體的內源性保護機制,促進側支循環建立,提高機體抵抗下一次腦缺血事件的能力。目前,有很多腦缺血預處理手段,如高壓氧、電針等預處理誘導腦缺血耐受[17-18],在動物實驗中取得了成功,但腦缺血耐受形成的具體機制尚不完全清楚。線粒體的熱休克蛋白70(HSP70)、腦源性促紅細胞生成素、細胞信號傳導通路、腫瘤壞死因子-α(TNF-α)、Bcl-2基因、神經遞質等均可能參與腦缺血耐受形成[11,19-22]。隨著分子生物學及基因技術的不斷發展,對腦缺血耐受的基因定位及功能研究,將為新的腦保護藥物的發現提供新的理論依據,為缺血性腦血管病的防治提供新的靶點,開辟新的途徑。本研究樣本量小,樣本的代表性可能不足。本研究尚需要進一步觀察證實進展性孤立單側基底節區腔隙性腦梗死的遠期功能及生命預后情況。
1 Nakase T,Yamamoto Y,Takagi M,et al. The impact of diagnosing branch atheromatous disease for predicting prognosis[J]. J Stroke Cerebrovasc Dis,2015,24:2423-2428.
2 高金立,劉尖尖,高蕾,等. 內囊后肢梗死的分水嶺機制探討[J]. 中國神經精神疾病雜志,2015,41:304-307.
3 Adams HP,Bendixen BH,Kappelle LJ,et a1.Classi fi cation of subtype of acute ischemic stroke[J].Stroke,1993,24:35-41.
4 周佳佳,徐子奇,羅本燕. 進展性腔隙性腦梗死的發病機制、臨床預測與治療研究現狀[J]. 中華神經科雜志,2013,46:494-495.
5 高萍,張志翔,陳治國,等. 內囊預警綜合征的臨床分析(附6例報道)[J]. 中國神經免疫學和神經病學雜志,2013,20:180-183.
6 Lee J,Albers GW,Marks MP,et al. Capsular warning syndrome caused by middle cerebral artery stenosis[J]. J Neurol Sci,2010,296:115-120.
7 Cohen JE,Rabinstein A,Gomori JM,et al. Capsular warning syndrome and crescendo lacunar strokes after atherosclerotic stenosis of the recurrent artery of Heubner[J]. J Clin Neurosci,19:1730-1733.
8 Del Bene A,Palumbo V,Lamassa M,et al.Progressive lacunar stroke:review of mechanisms,prognostic features,and putative treatments[J]. Int J Stroke,2012,7:321-329.
9 劉廷磊,王允明. 側腦室旁放射冠后部的孤立單側腦梗死與進展性運動障礙的關系[J]. 現代實用醫學,2015,27:434-435.
10 王昭君,李蕓,肖露露,等. 腔隙性腦梗死患者早期神經功能惡化相關因素及與腦白質病變的關聯研究[J].中華神經科雜志,2014,47:633-637.
11 彭蓓,郭曲練,賀智晶. 一氧化氮參與肢體缺血后處理對全腦缺血-再灌注損傷的保護作用[J]. 臨床麻醉學雜志,2012,28:901-904.
12 Ziegler G,Freyer D,Harhausen D,et al. Blocking TLR2 in vivo protects against accumulation of inflammatory cells and neuronal injury in experimental stroke[J]. J Cereb Blood Flow Metab,2011,31:757-766.
13 Kitagawa K,Matsumoto M,Tagaya M,et al.'Ischemic tolerance' phenomenon found in the brain[J].Brain Res,1990,528:21-24.
14 Caplan LR. Do transient ischemic attacks have a neuroprotective effect?[J]. Neurology,2000,55:1596.
15 Takuwa H,Masamoto K,Yamazaki K,et al. Longterm adaptation of cerebral hemodynamic response to somatosensory stimulation during chronic hypoxia in awake mice[J]. J Cereb Blood Flow Metab,2013,33:774-779.
16 胡躍強,唐農,雷龍鳴,等. 大鼠局灶性腦缺血預處理后蛋白激酶樣內質網激酶及葡萄糖調節蛋白78表達的變化[J]. 中華神經科雜志,2012,45:45-50.
17 洪煥茂,虞容豪,倪嘯曉. 高壓氧預處理誘導腦缺血耐受的研究進展[J]. 中華航海醫學與高氣壓醫學雜志,2015,22:78-81.
18 葉濤,朱路文,唐強. 電針預處理誘導腦缺血耐受的研究進展[J]. 針灸臨床雜志,2015,31:87-90.
19 Peng B,Guo QL,He ZJ,et al. Remote ischemic postconditioning protects the brain from global cerebral ischemia/reperfusion injury by up-regulating endothelial nitric oxide synthase through the PI3K/Akt pathway[J]. Brain Res,2012,1445:92-102.
20 Brown IR. Heat shock proteins and protection of the nervous system[J]. Ann N Y Acad Sci,2007,1113:147-158.
21 呂敬雷,王鵬,隋雪琴,等. 缺血后處理對腦缺血再灌注大鼠TNF-α和IL-1β表達影響[J]. 齊魯醫學雜志,2012,27:319-322.
22 Noguchi CT,Asavaritikrai P,Teng R,et al. Role of erythropoietin in the brain[J]. Crit Rev Oncol Hematol,2007,64:159-171.

