p53蛋白介導多巴胺受體激動劑阿樸嗎啡對人神經母細胞瘤的抗氧化作用
高 玲 苗 軍
(長春醫學高等專科學校,吉林 長春 130031)
?
p53蛋白介導多巴胺受體激動劑阿樸嗎啡對人神經母細胞瘤的抗氧化作用
高玲苗軍
(長春醫學高等專科學校,吉林長春130031)
摘要〔〕目的探討p53蛋白在非選擇性多巴胺受體激動劑阿樸嗎啡的抗氧化作用。方法采用不同濃度過氧化氫(H2O2)誘導人神經母細胞瘤細胞侏(SH-SY5Y)細胞損傷;CellTiter-BlueTM熒光生存能力檢測試劑盒測定細胞損傷程度。Western印跡檢測蛋白表達變化。結果SH-SY5Y細胞經不同濃度的H2O2處理24 h后,細胞死亡率呈濃度依賴性,經0.7 mmol/LH2O2處理不同時間后,細胞死亡率具有時間依賴性;經不同濃度H2O2處理細胞6 h后,p53和p21蛋白水平呈濃度依賴性升高;0.7 mmol/L H2O2處理不同時間p53蛋白水平在1 h開始升高,6 h達高峰,以后逐漸下降但仍然保持較高水平持續至少達24 h;處理6 h后p21蛋白水平升高,持續24 h基本保持不變;APO從5~20 μm均可抑制H2O2誘導的細胞凋亡,我們確定有效的濃度是10 μm;0.7 mmol/L H2O2處理后升高的p53和p21蛋白水平被提前2 h加入的10 μm APO所抑制。結論APO通過降低p53蛋白水平實現抗氧化作用,為臨床應用治療阿爾海默病、帕金森病、肌萎縮側索硬化及衰老等提供實驗依據。
關鍵詞〔〕阿樸嗎啡;氧化應激;p53
第一作者:高玲(1971-),女,講師,博士,主要從事神經生理研究。
氧化應激在神經系統變性疾病中發生神經細胞功能障礙和死亡的最重要原因之一。阿爾茨海默病(AD)〔1〕、帕金森病〔2〕、肌萎縮側索硬化〔3〕、衰老〔4〕和許多其他神經細胞功能障礙和缺失疾病中都存在過氧化與抗氧化失平衡,最終導致神經細胞損傷。過氧化氫(H2O2)通過產生羥基而引起DNA、蛋白質和細胞膜損傷〔5〕產生細胞毒性。阿樸嗎啡(APO)是一個強有力的非選擇性多巴胺受體激動劑,可以激活所有的多巴胺受體亞型。目前用于治療帕金森病是由于APO啡可以促進幾種生長因子的合成〔6,7〕。亦有報道顯示,APO在低濃度時具有抗氧化作用,在高濃度時具有細胞毒性〔8〕,其抗氧化作用可能不是通過受體介導的〔9〕。P53為腫瘤抑制基因。在控制細胞周期、細胞凋亡、基因組穩定性、抑制血管新生等方面扮演重要角色。已有研究表明,p53在AD〔10〕動物模型和AD患者腦中明顯升高,這與海馬神經元的凋亡有直接關系。APO的抗氧化中是否通過誘導p53蛋白的表達一直未有報道。本研究通過APO抑制H2O2誘導產生的細胞凋亡,分析低濃度的APO的抗氧化作用機制。
1材料與方法
1.1細胞培養人神經母細胞瘤細胞株(SH-SY5Y)細胞用含10%胎牛血清、1%青霉素/鏈霉素的DMEM培養液培養。細胞置于37℃、含5%二氧化碳潮濕空氣的溫箱中。
1.2細胞生存率實驗細胞生存率用CellTiter-BlueTM熒光生存能力檢測試劑盒測定。所有細胞死亡的測定結果均通過倒置顯微鏡觀察得到證實。CellTiter-BlueTM熒光生存能力檢測試劑盒以刃天青作為指示劑。培養在24孔培養皿中的細胞吸去培養基,將100 ml CellTiter-BlueTM試劑加入500 ml DMEM培養基后加入培養皿,在37℃孵育1 h,培養基轉移到96孔培養皿中,培養基的熒光強度用熒光分析儀(MTP800 AFC Microplate-Reader;Corona Electric Japan,東京,日本)測定,測定參數為激發波長560 nm,發射波長590 nm,未經任何處理的培養基熒光強度作為基礎參照。所有實驗均重復6次以上。
1.3蛋白質印跡檢測p53蛋白、p21蛋白細胞用2%十二烷基磺酸鈉(SDS)溶液裂解后蛋白質濃度用BCA蛋白檢測試劑盒(Pierce,Rockford,IL,美國)測定。電泳時每個樣品上樣10 μg,蛋白質經15%聚丙烯酰胺凝膠電泳分離后轉移到PVDF膜上(Millipore,Bedford,MA,美國),用TBS-T溶液(25 mmol/L Tris-HCl pH7.6,150 mmol/L NaCl,0.1% Tween-20)制成的5%脫脂牛奶封閉無蛋白部分后,PVDF膜孵育在抗p53單克隆抗體(1∶1 000 dilution;DO-1;Santa Cruz,CA,美國),抗p21單克隆抗體(1∶1 000 dilution;187;Santa Cruz;CA,美國)和抗α-actin單克隆抗體(1∶4 000 dilution;AC-15;Sigma,SL,美國)中常溫下過夜,用TBS-T溶液反復清洗后室溫下孵育在相應的二抗溶液中1 h,并在ECL 化學發光檢測系統(Amersham Bioscience,Piscataway,NJ,美國)中顯示目標蛋白條帶。
1.4蘇木精-伊紅染色載玻片上培養的細胞用冷PBS清洗后用95%乙醇在室溫下固定10 min,用蘇木精染色40 s,流水清洗后用伊紅染色1 min,再用流水清洗后用酒精脫水,用二甲苯清除殘存的酒精后蓋上蓋玻片,顯微鏡下攝取圖像。
1.5統計學方法應用StatView軟件進行雙因子方差分析。
2結果
2.1H2O2誘導的濃度和時間依賴性細胞死亡與p53蛋白的關系不同濃度的H2O2作用于SH-SY5Y 24 h后,細胞死亡率隨H2O2濃度增加而增大;選用0.7 mmol/L H2O2,隨培養時間的延長細胞死亡率增加,見圖1。
不同濃度的H2O2處理SH-SY5Y細胞6 h后,測定到p53和p21蛋白水平隨H2O2的濃度增加而升高,并與p53和p21蛋白表達呈正相關。同時,用0.7 mmol/L H2O2處理SH-SY5Y細胞,經不同時間點后測定,p53蛋白水平在處理后1 h開始升高,6 h達高峰,以后逐漸下降但仍然保持高位持續至少達24 h。H2O2處理6 h后p21蛋白水平升高,一直持續24 h基本保持不變,見圖1。
2.2APO抑制H2O2誘導的細胞死亡與p53和p21蛋白的關系本實驗應用的APO的濃度(5~20 μmol/L)沒有引起細胞死亡,且提前應用APO可以有效降低H2O2誘導的細胞死亡,最以10 μmol/L的APO效果明顯。0.7 mmol/L的H2O2培養24 h導致大約50%的細胞死亡,細胞生存率實驗顯示提前2 h應用10 μmol/L的APO可以完全逆轉H2O2引起的細胞死亡。HE染色清楚地顯示0.7 mmol/L H2O2導致的細胞死亡完全被提前應用10 μmol/L的APO所抑制。而且,提前2 h應用10 μmol/L APO處理的細胞加入0.7 mmol/L H2O2,經6 h后測定p53和p21蛋白水平,顯示0.7 mmol/L H2O2處理6 h后升高的p53和p21蛋白水平也被阿樸嗎啡所抑制,見圖2。
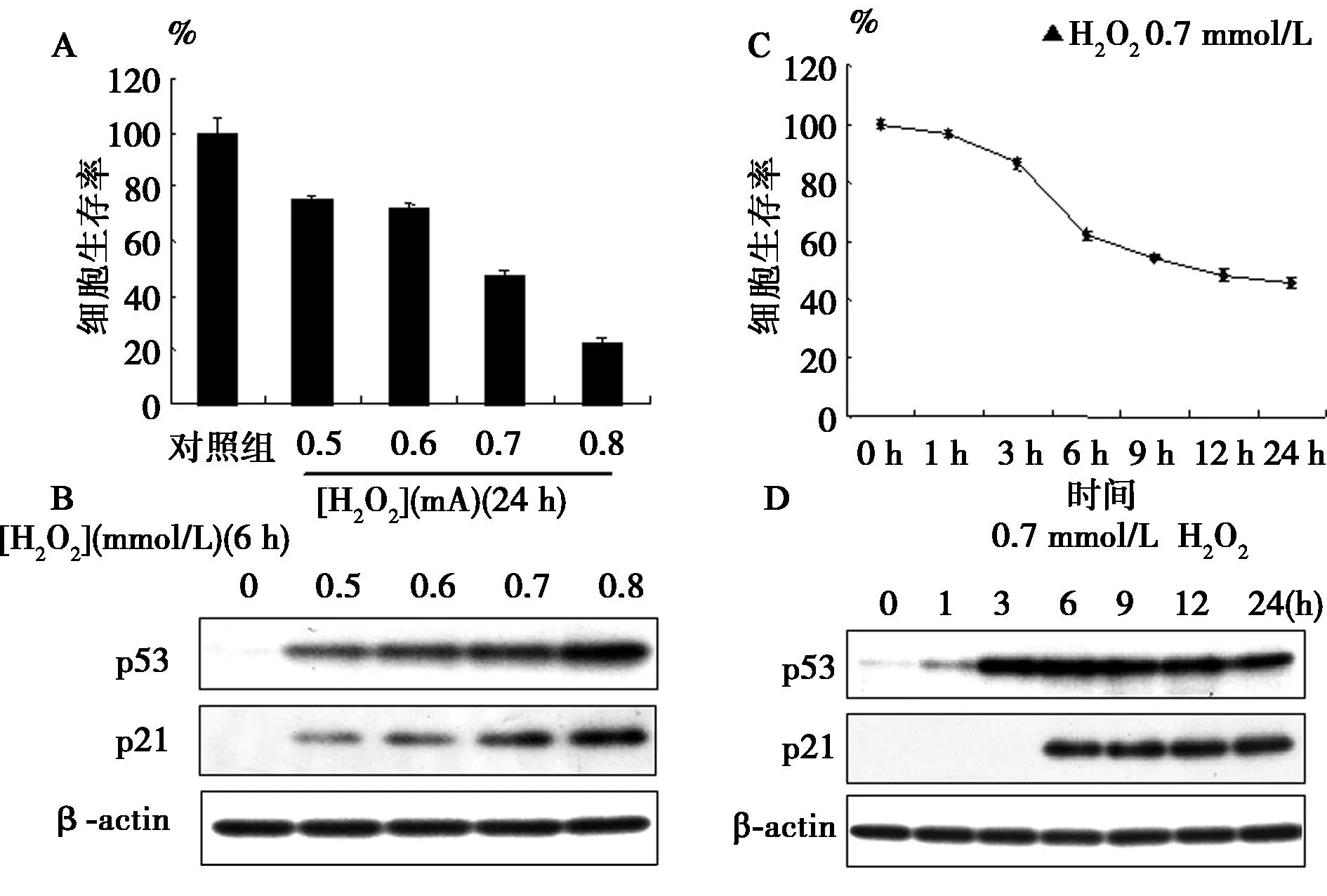
A、B:不同濃度H2O2處理24 h后細胞生存率;C、D:0.7 mmol/L H2O2處理經不同時間點測定細胞生存率圖1 在SH-SY5Y細胞中H2O2誘導的濃度依賴性和時間依賴性細胞死亡

A:細胞提前2 h不同濃度APO處理后,加入不同濃度H2O2 24 h后細胞生存率;B:10 μmol/L APO處理2 h加入0.7 mmol/L H2O2 24 h后細胞生存率;C:HE染色圖2 SH-SY5Y細胞中APO抑制H2O2誘導的細胞死亡并下調H2O2處理后增高的p53和p21蛋白水平
3討論
p53作為一個轉錄因子,參與細胞周期的調節、DNA的修復以及細胞凋亡的啟動。p53位于一個巨大的蛋白質網絡中心,整合不同來源的信號。細胞處于應激狀態時,如DNA損傷或癌基因表達,可以導致整個網絡的激活。激活后的p53與特定DNA啟動子的相應序列結合,誘導下游目標基因轉錄。這些基因的蛋白質產物啟動DNA修復機制,如果修復失敗就產生程序細胞死亡。所以當細胞處于應激狀態下p53可以通過阻止細胞進入細胞周期而抑制細胞增殖,在很多情況下甚至導致細胞凋亡。p21是p53的一個重要的下游基因〔9〕。
本研究說明H2O2誘導產生的氧化應激狀態激活了p53網絡。p53蛋白水平升高發生在過氧化氫處理后1 h,而作為p53的下游基因,p21的蛋白水平在過氧化氫處理6 h以后才開始增加。p53和p21蛋白水平升高之間的時間差說明p21蛋白增加繼發于p53蛋白升高。增高的p53蛋白與p21基因的啟動子結合,誘導p21信使RNA轉錄以及蛋白質的合成,同時還有其他p53下游基因的轉錄和翻譯,產生一系列蛋白質產物,從而啟動程序細胞死亡,最終導致細胞凋亡。
左旋多巴仍然是治療帕金森病的金標準。然而,大多數患者在治療幾年后出現左旋多巴相關的運動障礙,最終造成患者殘疾。多巴胺受體激動劑的應用可能產生更好的遠期效果。APO作為非選擇性多巴胺受體激動劑可以直接刺激突觸后膜的多巴胺受體改善帕金森癥狀。APO的作用機制目前還不十分明了。已知APO可以抑制過度的細胞凋亡,降低過度產生的一氧化氮,從而作為強抗氧化劑改善多巴胺能神經元的功能〔11〕。APO可以保護細胞免受氧化應激誘導劑,如過氧化氫、6-羥基多巴胺〔8〕和谷氨酸〔12〕等產生的氧化應激損傷。抑制早期的氧化損傷對于阿樸嗎啡的抗氧化作用至關重要。另外APO是通過下調p53蛋白的表達實現其抗氧化作用,從而為帕金森病的預防和合理治療提供了科學依據。
參考文獻4
1Bonda DJ,Wang X,Perry G,etal.Oxidative stress in Alzheimer disease:a possibility for prevention 〔J〕.Neuropharmacology,2010;59(4-5):290-4.
2Zhou C,Huang Y,Przedborski S.Oxidative stress in Parkinson's disease:a mechanism of pathogenic and therapeutic significance 〔J〕.Ann N Y Acad Sci,2008;1147(1):93-104.
3Barber SC,Shaw PJ.Oxidative stress in ALS:key role in motor neuron injury and therapeutic target 〔J〕.Free Radic Biol Med,2010;48(5):629-41.
4Dr?ge W,Schipper HM.Oxidative stress and aberrant signaling in aging and cognitive decline 〔J〕.Aging Cell,2007;6(2):361-70.
5Wang T,Chen L,Wu W,etal.Potential cytoprotection:antioxidant defence by caffeic acid phenethyl ester against free radical-induced damage of lipids,DNA,and proteins 〔J〕.Can J Physiol Pharmacol,2008;86(5):279-87.
6Li A,Guo H,Luo X,etal.Apomorphine-induced activation of dopamine receptors modulates FGF-2 expression in astrocytic cultures and promotes survival of dopaminergic neurons 〔J〕.FASEB J,2006;20(10):1263-5.
7Guo H,Tang Z,Yu Y,etal.Apomorphine induces trophic factors that support fetal rat mesencephalic dopaminergic neurons in cultures 〔J〕.Eur J Neurosci,2002;16(6):1861-70.
8Gassen M,Gross A,Youdim MB.Apomorphine enantiomers protect cultured pheochromocytoma(PC12)cells from oxidative stress induced by pO2 and 6-hydroxydopamine 〔J〕.Mov Disord,1998;13(2):242-8.
9Grünblatt E,Mandel S,Gassen M,etal.Potent neuroprotective and antioxidant activity of apomorphine in MPTP and 6-hydroxydopamine induced neurotoxicity 〔J〕.J Neural Transm Suppl,1999;55(1):57-70.
10R?mer L,Klein C,Dehner A,etal.p53-a natural cancer killer:structural insights and therapeutic concepts 〔J〕.Angew Chem Int Ed Engl,2006;45(5):6440-60.
11Kyriazis M.Neuroprotective,anti-apoptotic effects of apomorphine 〔J〕.J Anti Aging Med,2003;6(1):21-8.
12Ishige K,Chen Q,Sagara Y,etal.The activation of dopamine D4 receptors inhibits oxidative stress-induced nerve cell death 〔J〕.J Neurosci,2001;21(2):6069-76.
〔2014-11-29修回〕
(編輯李相軍/滕欣航)
通訊作者:苗軍(1971-),男,副主任藥師,主要從事臨床藥理應用與研究
基金項目:吉林省教育廳科研課題(2014606)
中圖分類號〔〕R73〔
文獻標識碼〕A〔
文章編號〕1005-9202(2015)21-6054-03;doi:10.3969/j.issn.1005-9202.2015.21.021

