冬蟲夏草提取物對混合淋巴細胞培養體系Treg/Th17軸的影響
楊 梅 張 巖 金 昊 李一夫 夏 鵬 鄭少玲 蔡 勇 陳必成 楊亦榮
冬蟲夏草提取物對混合淋巴細胞培養體系Treg/Th17軸的影響
楊 梅 張 巖 金 昊 李一夫 夏 鵬 鄭少玲 蔡 勇 陳必成 楊亦榮
目的觀察冬蟲夏草提取物對混合淋巴細胞(MLC)培養體系Treg/Th17軸的影響,探討冬蟲夏草提取物的免疫調節機制。方法體外建立單向混合淋巴細胞培養體系,用冬蟲夏草提取物干預培養體系,在不同的時間點收集細胞,采用流式細胞術檢測細胞中輔助性T細胞17(Th17細胞)和CD4+CD25+T調節性T淋巴細胞(Treg細胞)的比例,并計算出Th17細胞與Treg細胞的比值;采用酶聯免疫吸附試驗法分別檢測培養液白細胞介素(IL)-17、IL-23、IL-2和IL-6的濃度。結果冬蟲夏草提取物干預組12、24、36h三個時間點T細胞中Treg細胞比例分別為(13.17± 1.25)%、(12.3±1.31)%、(11.89±1.46)%,同時間點對照組T細胞Treg細胞比例分別為(11.04±1.32)%、(10.16±1.15)%、(8.91±0.97)%,差異均有統計學意義(P<0.05);干預組T細胞中Th17細胞比例分別為(2.81±0.13)%、(4.02±0.38)%、(4.95±0.49)%,同時間點的對照組T細胞中Th17細胞比例分別為(4.65±0.31)%、(6.63±0.63)%、(8.03±0.76)%,差異均有統計學意義(P<0.05)。冬蟲夏草提取物干預組12、24、36h三個時間點T細胞中Th17細胞與Treg細胞的比例均顯著低于同時間點的對照組(P<0.05)。冬蟲夏草提取物干預組12、24、36h三個時間點培養液IL-2水平明顯高于同時間點對照組(P<0.05),而干預組培養液IL-6、IL-17、IL-23水平低于同時間點的對照組(P<0.05)。結論冬蟲夏草提取物能夠明顯促進MLC體系細胞中Treg細胞增殖,抑制Thl7細胞增殖,降低Th17/Treg細胞比值,改變Th17/Treg軸的平衡,同時增加IL-2分泌、減少IL-6、IL-17、IL-23分泌,有利于誘導免疫耐受。
冬蟲夏草提取物;細胞分化;輔助性T細胞17;調節性T細胞;細胞因子
冬蟲夏草(cordyceps sinensis,CS)是我國傳統中藥,現代科學研究證實了冬蟲夏草有抗腫瘤、降血壓、調節內分泌、增強免疫力、鎮靜中樞、抗心肌缺血及調節心率等功能,臨床上人工冬蟲夏草制劑用于腎臟移植已近20年,療效顯著。我們前期對冬蟲夏草提取物治療移植動脈硬化的研究結果表明,冬蟲夏草可以減少T淋巴細胞浸潤,減輕慢性排斥反應,延緩大鼠移植動脈硬化的進展[1-2];但其抗慢性排斥的機理不明。本研究通過觀察冬蟲夏草提取物對混合淋巴細胞(MLC)培養體系Treg/Th17軸及細胞因子的影響,探討冬蟲夏草提取物的免疫調節機制。
1 實驗材料
1.1 藥 物 冬蟲夏草提取物的制備:冬蟲夏草在15℃恒溫下培養45天,取冬蟲夏草菌絲體,經過濾、干燥和粉碎成為超細粉。超細粉經過乙醇提取、水提取和酶解,溶解至水中,4℃冰箱保存。
1.2 試 劑 RPMI-1640培養基為美國GIBCO公司產品,新生牛血清為杭州四季青公司產品,絲裂霉素為浙江海正藥業公司產品,BCA蛋白濃度測定試劑盒為江蘇碧云天生物研究所產品。FITC標記的CD4單克隆抗體,PE標記的白細胞介素(IL)-17A、CD25單克隆抗體均購自美國eBioscience公司。小鼠IL-2、IL-6、IL-17A和 IL-23酶聯免疫吸附試驗(ELISA)檢測試劑盒均購自美國eBioscience公司。
1.3 動 物 受鼠為BALB/c小鼠,雌性;供鼠為C57BL/6小鼠,雄性;均為清潔級近交系小鼠,鼠齡8~12周,溫州醫科大學實驗動物中心提供,許可證號:SYXK(浙)2010-0150。所有小鼠給予標準規格的嚙齒類食物喂養,可自由飲水。喂養環境設置:12h:12h人工白天黑夜循環,維持室內溫度(21±2)℃,濕度(55±2)%。
2 試驗方法
2.1 單向MLC培養體系的建立 將C57BL/6小鼠(供鼠)頸椎脫臼處死,置入75%的乙醇中浸泡10 min,在超凈臺內無菌取出小鼠脾臟,置于200目金屬過濾網上,勻漿器芯輕輕研磨,制成脾細胞懸液,用RPMI-1640液洗2次。調整細胞含量為1×109/L。經臺盼藍染色后計算細胞存活率(>95%)。計數板計數并將C57BL/6小鼠脾細胞調2×109/L作為反應細胞。BALB/c小鼠(受鼠)的脾細胞取法同上。將BALB/ c小鼠脾細胞含量調至1×109/L,加入絲裂霉素至終濃度25mg/L,于37℃水浴作用30min,用無血清RPMI-1640培養基洗滌2次,除去殘余的絲裂霉素,調整細胞含量至2×109/L,作為刺激細胞。將已制備好的供受鼠脾細胞按如下分組加入24孔板,每孔加入反應細胞和刺激細胞各0.1mL。實驗分組:對照組不加任何處理,冬蟲夏草組每孔加入無菌處理過的2mmol/L蟲草提取物,每組設3個復孔,各組均置于37℃ 5%CO2孵箱進行培養。在培養的12、24、36h時收集各實驗孔的細胞。
2.2 CD4+CD25+T及Th17+T細胞檢測 制備淋巴細胞懸液,將淋巴細胞濃度調整為5×108/L,加入異硫氰基熒光素(FITC)標記的抗CD4單抗和藻紅蛋白(PE)標記的抗CD25單抗,上機檢測。以陰性對照管設門參數,檢測CD4+CD25+T細胞。將淋巴細胞密度調整為5×106/mL,加入異硫氰基熒光素(FITC)標記的抗CD4單抗和藻紅蛋白(PE)標記的抗白細胞介素(IL)-17單抗,破膜后上機檢測,以陰性管設門參數作為對照,檢測CD4+IL-17+Th17細胞比例。
2.3 培養液IL-17和IL-23水平測定 取培養液,使用小鼠IL-2、IL-6、IL-17A和IL-23酶聯免疫吸附試驗(ELISA)檢測試劑盒分別檢測培養液中IL-2、IL-6、IL-17A和IL-23的水平,操作步驟嚴格按試劑盒說明書進行。
2.4 統計學方法 應用SPSS13.0統計軟件進行處理,計量資料用均數±標準差(±s) 表示,采用單因素方差分析,P<0.05為差異有統計學意義。
3 實驗結果
3.1 冬蟲夏草提取物對Treg細胞分化和增殖的影響 對照組12、24、36h三個時間點CD4+CD25+T細胞占CD4+T細胞的比例隨時間延長而下降,呈時間依賴性。冬蟲夏草組12、24、36h三個時間點CD4+ CD25+T細胞占CD4+T細胞的比例均顯著高于同時間點的對照組,差異有統計學意義(P<0.05),見表1,圖1(封二)。
3.2 冬蟲夏草提取物對Th17細胞分化和增殖的影響 對照組12、24、36h三個時間點CD4+Th17+T細胞占CD4+T細胞的比例隨時間延長而增加,呈時間依賴性。冬蟲夏草組12、24、36h三個時間點CD4+ Th17+T細胞占CD4+T細胞的比例均顯著低于同時間點的對照組(P<0.05),見表1,圖2(封二)。
3.3 冬蟲夏草提取物對Th17/Treg細胞比值的影響
對照組12、24、36h三個時間點Th17/Treg細胞比值隨時間延長而升高,呈時間依賴性。冬蟲夏草組12、24、36h三個時間點TTh17/Treg細胞比值均顯著低于同時間點的對照組,差異有統計學意義(P<0.05),見表1。
3.4 冬蟲夏草提取物對混合淋巴培養體系IL-2、IL-6、IL-17和IL-23表達水平的影響 對照組12、24、36h三個時間點IL-2濃度隨時間延長而升高,呈時間依賴性。冬蟲夏草組12、24、36h三個時間點IL-2濃度均顯著高于同時間點的對照組,差異有統計學意義(P<0.05),見表2。對照組12、24、36h三個時間點IL-6、IL-23、IL-17濃度分均隨時間延長而下降,呈時間依賴性。冬蟲夏草組12、24、36h三個時間點IL-6、IL-23、IL-17濃度均顯著低于同時間點的對照組,差異有統計學意義(P<0.05),見表2。
表1 各組混合淋巴細胞培養體系CD4+CD25+Treg、CD4+Th17細胞的分布(%,±s)
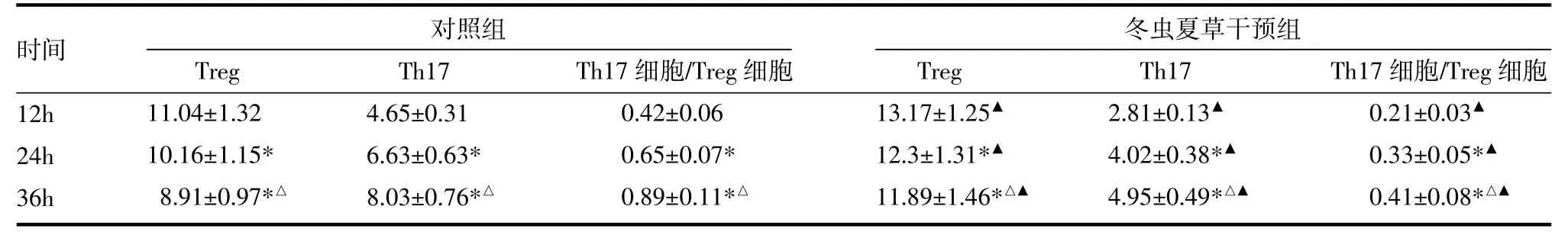
表1 各組混合淋巴細胞培養體系CD4+CD25+Treg、CD4+Th17細胞的分布(%,±s)
注:與12h比較,*P<0.05;與24h比較,△P<0.05;與同時間點對照組比較,▲P<0.05;Treg:調節性T淋巴細胞;Th17:輔助性T淋巴細胞17
時間12h 24h 36h對照組冬蟲夏草干預組Treg 11.04±1.32 10.16±1.15* 8.91±0.97*△Th17 4.65±0.31 6.63±0.63* 8.03±0.76*△Th17細胞/Treg細胞0.42±0.06 0.65±0.07* 0.89±0.11*△Treg 13.17±1.25▲12.3±1.31*▲11.89±1.46*△▲Th17 2.81±0.13▲4.02±0.38*▲4.95±0.49*△▲Th17細胞/Treg細胞0.21±0.03▲0.33±0.05*▲0.41±0.08*△▲
表2 各組淋巴細胞培養液IL-2、IL-6、IL-17和IL-23表達水平(pg/mL±s)

表2 各組淋巴細胞培養液IL-2、IL-6、IL-17和IL-23表達水平(pg/mL±s)
注:與12h比較,*P<0.05;與24h比較,△P<0.05;與同時間點對照組比較,▲P<0.05;IL-2:細胞介素-2;IL-6:白細胞介素-6;IL-17A:白細胞介素-17A;IL-23:白細胞介素-23
時間12h 24h 36h對照組 冬蟲夏草干預組IL-2 125.13±15.39 139.82±20.36* 157.69±21.09*△IL-6 120.64±11.06 132.07±13.39* 138.74±14.15*△IL-17A 61.79±11.55 75.58±14.34* 83.03±16.25*△IL-23 112.70±18.75 96.31±14.61* 87.16±12.85*△IL-2 144±19.37▲176±24.11*▲189.35±32.15*△▲IL-6 102.73±8.65▲114.47±9.37*▲122.31±9.89*△▲IL-17A 46.17±7.46▲58.02±9.86*▲63.97±10.99*△▲IL-23 81.49±12.77▲74.93±10.08*▲59.82±7.63*△▲
4 討 論
冬蟲夏草為麥角菌科真菌冬蟲夏草菌Cordyceps sinensis(Berk)Sace.寄生在蝙蝠蛾科昆蟲幼蟲上的子座及幼蟲尸體的復合體。最近一些研究證實冬蟲夏草能延長異體皮膚移植物和心臟移植的存活時間,和環孢素A有協同效應,與環孢素A聯用可以抑制排斥反應,同時減少環孢素A引起的蛋白尿和延緩慢性移植物腎臟病的進展[3]。He等[4]研究表明,冬蟲夏草對慢性移植物腎臟病有一定的治療作用,它可以減輕腎小球及腎小管間質損害。此外,冬蟲夏草能顯著降低CD8+T細胞活性,抑制急性排斥反應,減輕移植物血管病[5]。我們前期的研究發現冬蟲夏草提取物有顯著地抗移植物血管病的作用,并且有顯著的抗慢性排斥的作用[1-2],但其抗慢性排斥的機制不明。
調節性T細胞(Treg)中以對CD4+CD25+的T調節性淋巴細胞的研究最為突出。在體內,CD4+ CD25+Treg可抑制CD4+T細胞介導的排斥反應[6];CD4+CD25+Treg可抑制抗原特異性CD8+T細胞介導的排斥反應[7];CD4+CD25+Treg可直接或間接作用于抗原提呈細胞(APC),從而影響細胞因子的產生,下調共刺激分子的表達,通過促進凋亡而清除效應細胞[8-9]。在免疫耐受形成的過程中,IL-2參與誘導初始CD4+CD25-T細胞轉化為CD4+CD25+T細胞并表達Foxp3,使其具備調節性T細胞的特性[10]。
近年研究發現,機體存在一種新型的不同于Th1 和Th2的CD4+效應細胞——輔助性T細胞17型(T help cell 17,Th17),該細胞是由天然T細胞前體分化而來,具有獨立的分化和調節機制,特異性產生白介素(interleukin 17,IL-17)效應因子,在自身免疫性疾病和機體防御反應中具有重要的意義[11]。IL-23主要參與Thl7細胞的擴增以及功能的維持12。IL-2是Th17細胞分化的抑制因素,它通過STAT5信號傳導對Th17細胞的分化起到抑制作用[12]Th17細胞除了分泌IL-17以外還可以產生IL-21、IL-22、TNF-α和IL-6等炎性因子,Thl7細胞在疾病中的作用主要是促進器官特異性的自身免疫性疾病和慢性感染的防御[13]。研究證實,IL-23或者IL-17缺陷小鼠可以降低自身免疫病和慢性感染的易感性,而近期的一些研究也表明,TH17細胞可以加速移植物血管病的進程,介導移植血管硬化[14-15]。
正常體內Treg與Th17細胞保持平衡狀態,而當炎癥等情況時Th17細胞分化增強比例增加導致Treg/Th17失衡,是引起多種自身免疫病以及移植排斥的重要原因[16]。Treg細胞與Th17細胞之間存在復雜的相關關系,二者在功能上相互拮抗,而在分化上卻具有相關性。Treg/Th17的平衡在器官移植、自身免疫性疾病中有著重要的作用[17]。Treg/Th17的平衡能夠抑制炎癥反應[18],減輕排斥,誘導免疫耐受,在大鼠的肝臟移植[19]及人類的移植物抗宿主病[20]中均得到了證實。通過調控Th17細胞/Treg細胞比值可以維持體內免疫穩態的平衡,該比值升高時,自身免疫及促炎效應占優勢,比值降低時,免疫耐受及抗炎效應占優勢。
本實驗發現干預組Treg細胞顯著高于同時間點的對照組,而Th17細胞顯著低于同時間點的對照組,干預組的Th17/Treg細胞比值也顯著低于同時間點的對照組。表明冬蟲夏草提取物可以顯著促進Treg細胞增殖,抑制Th17細胞增殖,降低Th17/Treg細胞比值,改變Th17/Treg軸的平衡,誘導T細胞向Treg分化,抑制T細胞向Th17細胞分化。同時檢測培養體系中一系列細胞因子的表達水平,發現干預組IL-2水平顯著高于同時間點的對照組;IL-6、IL-17和IL-23表達水平顯著低于同時間點的對照組。這表明冬蟲夏草提取物可以提高IL-2水平,降低IL-6、IL-17和IL-23表達水平。而IL-2正是CD4+ CD25+細胞擴增所必需的細胞因子。這也是冬蟲夏草提取物誘導T細胞向Treg分化的一個分子水平的證據。另外冬蟲夏草提取物降低了IL-6、IL-17和IL-23表達水平,這可能是其抑制T細胞向Th17細胞分化,Th17細胞數量減少,分泌的IL-6、IL-17和IL-23也相應的減少,這些促炎因子的減少也有利于誘導免疫耐受。
綜上所述,本實驗結果顯示,冬蟲夏草提取物能改變Th17/Treg軸的平衡,誘導T細胞向Treg分化,抑制T細胞向Th17細胞分化。提高單向混合淋巴細胞培養體系中IL-2表達水平,降低IL-6、IL-17和IL-23表達水平。其誘導免疫耐受的作用機制可能是通過改變Th17/Treg軸的平衡,提高抗炎細胞因子,降低炎性細胞因子來實現的,具體機制有待于在動物實驗及臨床試驗進一步驗證。
[1]Zhang Y,Yang M,Gong S,et al.Cordyceps sinensis Extracts Attenuate Aortic Transplant Arteriosclerosis in Rats[J]. 允ournal of Surgical Research,2012,175(1):123-130.
[2]夏鵬,張巖,徐自強,等.冬蟲夏草提取物抑制大鼠移植物血管病的實驗研究[J].中華器官移植雜志,2012,33(4):236-240.
[3]Li Y,Xue WJ,Tian PX,et al.Clinical application of Cordyceps sinensis on immunosuppressive therapy in renal transplantation[J].Transplant Proc,2009,41(5):1565-1569.
[4]He XL,Chen JH,Wang YM,et al.Clinical observation on treatment of chronic allograft nephropathy with bailing capsule[J].Zhongguo Zhong Xi Yi允ie He Za Zhi,2006,26 (2):102-125.
[5]Jordan JL,Hirsch GM,Lee TD.C.sinensis ablates allograft vasculopathy when used as an adjuvant therapy with cyclosporin A[J].Transpl Immunol 2008,19(3-4):159-166.
[6]Han Y,Wu J,Bi L,et al.Malignant B cells induce the conversion of CD4+CD25-T cells to regulatory T cells in B-cell non-Hodgkin lymphoma[J].Plos One,2011,6(12):e28649.
[7]Ballesteros-Tato,A.Beyond regulatory T cells:the potential role for IL-2 to deplete T-follicular helper cells and treat autoimmune diseases[J].Immunotherapy,2014,6(11):1207-1220.
[8]Hasenkrug KJ,Myers LM.In vitro and in vivo analyses of regulatory T cell suppression of CD8+T cells[J].Methods Mol Biol,2011,707:45-54.
[9]Bayry J.Regulatory T cells as adjuvant target for enhancing the viral disease vaccine efficacy[J].Virusdisease,2014,25 (1):18-25.
[10]Verhagen J,Gabrysová L,Shepard ER,et al.Ctla-4 modulates the differentiation of inducible Foxp3+Treg cells but IL-10 mediates their function in experimental autoimmune encephalomyelitis[J].PLoS One,2014,9(9):e108023.
[11] Geginat J,Paroni M,Maglie S,et al.Plasticity of human CD4 T cell subsets[J].Front Immunol,2014,16(5):630.
[12] Annunziato F,Cosmi L,SantarlaseiV,et al.Phenotypic and functional features of human Th17 ceils[J].允Exp Med,2007,204(8):1849-1861.
[13]Dillenbeck T,Gelius E,Fohlstedt J,et al.Triple Cytokine FluoroSpot Analysis of Human Antigen-Specific IFN-γ,IL-17A and IL-22 Responses[J].Cells,2014,3(4):1116-1130.
[14]Bryna E.Burrell,Keri Csencsits,CD8+Th17 Mediate Costimulation Blockade Resistant Allograft Rejection in T-bet Deficient Mice[J].允.Immunol,2008,181(6):3906-3914.
[15]Yuan X,Paez-Cortez J,Schmitt-Knosalla I,et al.A novel role of CD4 Th17 cells in mediating cardiac allograft rejection and vasculopathy[J].允ournal of Experimental Medicine,2009,205(13):3133-3144.
[16]Afzali B,Lombardi G,Lechler RL,et al.The role of T helper 17(Th17)and regulatory T cells(Treg)in human organ transplantation and autoimmune disease[J].Clin Exp Immunol,2007,148(1):32-46.
[17]Khoury SJ.Th17 and Treg balance in systemic sclerosis[J]. Clin Immunol,2011,139(3):231-232.
[18]Hanidziar D,Koulmanda M.Inflammation and the balance of Treg and Th17 cells in transplant rejection and tolerance[J].Curr Opin Organ Transplant,2010,15(4):411-415.
[19]Li J,Lai X,Liao W,et al.The dynamic changes of Th17/ Treg cytokines in rat liver transplant rejection and tolerance[J].Int Immunopharmacol,2011,11(8):962-967.
[20]Ratajczak P,Janin A,Peffault de Latour R,et al.Th17/ Treg ratio in human graft-versus-host disease[J].Blood,2010,116(7):1165-1171.
(收稿:2015-08-11 修回:2015-10-10)
Influence of Cordyceps Sinensis Extract on the Treg/Th17 Axis of Mixed Lymphocyte Culture Technique
YANG Mei,ZHANG Yan,允IN Hao,Li Yifu,XIA Peng,ZHENG Shaoling,CAI Yong,CHEN Bicheng,YANG Yirong.Department of Intensive Care Unit(YANG Mei),Centre for Transplantation(ZHANG Yan,JIN Hao,Li Yifu,XIA Peng,ZHENG Shaoling,CAI Yong,YANG Yirong),Department of Surgery Laboratory(CHEN Bicheng), the First Affiliated Hospital of Wenzhou Medicine University,Wenzhou(325000),China
ObjectiveTo investigate the influence of Cordyceps sinensis extract on the Treg/Th17 axis of mixed lymphocyte culture(MLC)system,in order to explore the immune regulation mechanism of Cordyceps sinensis extract.MethodsOne-way mixed lymphocyte culture system was established in vitro,then was interfered with Cordyceps sinensis extract.Cells were collected at different time points for detection of Th17 cells and Treg cells by flow cytometry;the ratio of TH17 cells to Treg cells was calculated.Enzyme linked immunosorbent assay was used to determine concentrations of interleukin(IL)-17,IL-23,IL-2 and IL-6 in the medium.ResultsAt 12,24, 36 h after treatment,the percentage of Treg cells in Cordyceps sinensis extract group were 13.17%±1.25%,12.3%± 1.31%,11.89%±1.46%,those in control group were 11.04%±1.32%,10.16%±1.15%,8.91%±0.97%;the difference between the 2 groups was statistically significant(P<0.05).At the same time points,the percentage of Th17 cells in Cordyceps sinensis extract group were 2.81%±0.13%,4.02%±0.38%,4.95%±0.49%,those in control group were 4.65%±0.31%,6.63%±0.63%,8.03%±0.76%,with significant difference between 2 groups(P<0.05).The ratio of TH17/Treg in Cordyceps sinensis extract group was significantly lower than that of control group at the same timepoints(P<0.05).IL-2 levels of the medium in Cordyceps sinensis extract group were significantly higher than those in the control group at the same time points(P<0.05),while IL-6,IL-17,and IL-23 levels were significantly lower than those in control group(P<0.05).ConclusionCordyceps sinensis extract can obviously promote the proliferation of Treg cells,inhibit the proliferation of Thl7 cells,resulting in the decrease of the ratio of Th17/Treg and consequently changing the balance of Th17/Treg axis in the system of MLC cells.Meanwhile,Cordyceps sinensis extract can increase the secretion of IL-2,reduce the secretion of IL-6,IL-17,IL-23,which is advantageous to the induction of immune tolerance.
Cordyceps sinensis extract;cell differentiation;Th17cells;regulatory T cells;cytokine
浙江省溫州市科技計劃項目(No.Y20120207,Y20120158);浙江省自然科學基金資助項目(No.LQ13H100003,No.LQ16H100003)
溫州醫科大學附屬第一醫院重癥醫學科(楊梅)、移植中心(張巖、金昊、李一夫、夏鵬、鄭少玲、蔡勇、楊亦榮)、外科實驗室(陳必成)(溫州 325000)
張巖,E-mail:biobabry@163.com

