熒光定量PCR法檢測重組畢赤酵母工程菌的外源基因拷貝數
郭晉霞,何云鳳,范 開
(1.重慶理工大學 藥學與生物工程學院,重慶 400054;
2.重慶富進生物醫藥有限公司,重慶 400050)
?
熒光定量PCR法檢測重組畢赤酵母工程菌的外源基因拷貝數
郭晉霞1,何云鳳1,范開2
(1.重慶理工大學 藥學與生物工程學院,重慶400054;
2.重慶富進生物醫藥有限公司,重慶400050)
摘要:提出了重組畢赤酵母工程菌pPICZ-DT30/GS115基因組中外源基因DT30拷貝數的實時熒光定量PCR方法。該重組工程菌用來表達人胰島素前體(PI-DT30),其表達量的高低、菌種穩定性對工藝研究及整體項目成本等有重大影響。外源基因拷貝數是檢測表達量的一個重要指標。該方法中,利用畢赤酵母的看家基因GAP(Glyceraldehyde-3-phosphate dehydrogenase)為內參,分別建立含GAP基因和DT30基因的雙標準曲線。將工程菌基因組進行熒光定量PCR,根據標準曲線和Ct值計算目的基因DT30在重組畢赤酵母工程菌中的拷貝數,結果為7個。
關鍵詞:熒光定量PCR; 表達; 胰島素前體; 基因拷貝數
糖尿病是一種嚴重危害人類健康的代謝性疾病。根據國際糖尿病聯盟(International Diabetes Federation)數據,預計到2030年全世界糖尿病患者人數將接近5億[1]。重組人胰島素類似物是目前治療糖尿病的首選藥物之一,具有廣闊的市場前景。重組人胰島素在生產過程中通常有兩種工藝,其中利用酵母為表達體系,先得到重組人胰島素原再生產胰島素成品的占70 %左右的市場份額[2]。本研究中檢測的重組酵母工程菌pPICZ-DT30/GS115即可用于重組人胰島素原(PI-DT30)的生產。
畢赤酵母表達系統是目前廣受歡迎的外源蛋白表達系統之一。外源基因在畢赤酵母中通常會以同源重組的方式整合到宿主菌基因組上,且可插入多個拷貝。而高拷貝的外源基因通常會導致其在畢赤酵母中的高表達量[3]。在研究重組工程菌表達量的工作中,對于外源基因拷貝數的監測可以起到指示作用。另外,在菌種傳代過程中,拷貝數是否降低也可以表征菌種是否有質粒丟失。
Wesblum等[4]根據瓊脂糖電泳過程中不同DNA其遷移速度不同的原理和放射性標記來測定拷貝數。Projan等[5]用熒光標記DNA,從而擴大了這一方法的應用范圍。Genthner[6]用HPLC-HPHT(羥基磷灰石柱)法測定E.coli HB101中的pBR322拷貝數為29,與冷泉港實驗室報道的30個相差不大。還有報道用毛細管電泳法[7]、間接測定酶活法[8]等方法檢測質粒拷貝數。目前運用最多的方法為Southern blot 法[9],該方法的優點是準確性高,但是需要大量的DNA,操作要求高,且容易產生假陽性結果。實時熒光定量PCR技術 (real-time fluores-cence quantitative PCR,RTFQ PCR)是1996年由美國Applied Biosystems公司推出的一種新定量試驗技術[10],具有快速、靈敏、特異性強、高通量等優點,已在DNA和RNA的定量檢測方面有較多應用[11-13]。
本研究利用畢赤酵母中的看家基因GAP(Glyceraldehyde-3-phosphate dehydrogenase)為內參,采用雙標準曲線方法,提出了一種對pPICZ-DT30/GS115 工程菌中DT30拷貝數的快速、準確的SYBR Green熒光定量PCR檢測方法。
1材料與方法
1.1主要試劑及儀器
GoTaq qPCR MasterMix(SYBR Green),購自promega公司;Realplex實時熒光定量PCR儀,購自德國Eppendorf公司;大腸桿菌質粒小量快速抽提試劑盒、酵母基因組提取試劑盒,均購自美國Omega公司;微量核酸定量儀,購自Gene Company Limited。
1.2菌種及質粒
pPICZ-DT30/GS115 工程菌、pPICZ-DT30/Top10菌由重慶富進生物醫藥有限公司提供;大腸桿菌Top10、畢赤酵母GS115均購自Invitrogen公司; pMD19-T Simple載體體系購自TaKaRa公司。
1.3培養基
LB液體培養基:1% Trptone,0.5% Yeast Extraction,1% NaCl;藍白斑篩選培養基:1% Trptone,0.5% Yeast Extraction,0.5% NaCl,100 mg/mL Amp,40 μg/mL X-gal,24 μg/ mL IPTG,1.5% Agar;YPD培養基:1% Yeast Extraction,2% Polypetone,2% Dexotrose。
1.4引物設計
根據NCBI數據庫公布的畢赤酵母GAP基因序列(U62648)設計GAP引物(GAP-1,GAP-2),根據待測目的基因DT30序列設計DT30擴增引物(DT30-1,DT30-2),結果見表1。
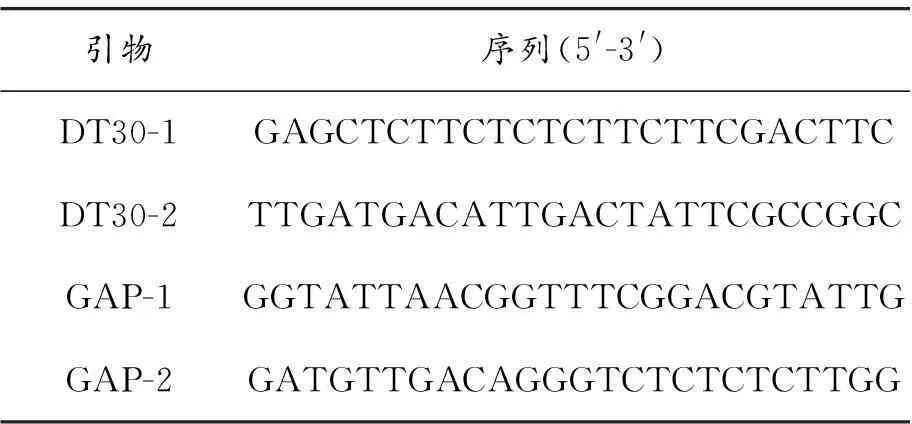
表1 DT30和GAP引物序列
1.5標準質粒構建
接種GS115,抽提GS115基因組;接種pPICZ-DT30/Top10,抽提pPICZ-DT30質粒。以GS115基因組為模板, GAP -1和GAP-2為引物,PCR擴增GAP基因;以pPICZ-DT30質粒為模板,DT30-1和DT30-2為引物,擴增DT30目的基因片段。回收GAP和DT30片段,在16 ℃下分別與載體PMD19-T vector連接過夜,連接液轉化大腸桿菌Top10,涂布藍白斑篩選平板,37℃培養過夜。挑選白色單菌落接種LA液體培養基培養,37 ℃培養過夜。抽提質粒,對抽提得到的重組質粒進行PCR鑒定,分別將鑒定正確的陽性克隆送大連寶生物公司測序,將測序正確的質粒分別命名為T-GAP和T-DT30,作為實時定量PCR的標準質粒。
用微量核酸定量儀測定標準質粒濃度(ng/μL)。根據以下公式計算GAP和DT30的拷貝數:
copies/u=(6.02×1023) × (ng/μL×10-9)/ (DNA length×660)
1.6待測樣品處理
接種pPICZ-DT30/GS115 工程菌于YPD液體培養基中,30 ℃培養過夜。第2天抽提基因組,并用微量核酸定量儀測定其濃度(ng/μL)及純度。
1.7實時定量PCR體系及反應程序
在前期的實驗過程中完成了對PCR反應體系的優化。PCR反應體系和時間程序如表2、3所示。

表2 實時定量PCR反應體系

表3 實時定量PCR時間程序
注:其中第2步到第4步重復40個循環。
1.8標準曲線建立
將已計算拷貝數的標準質粒T-GAP和T-DT30分別梯度稀釋至108,107,106,105,104,103copies/μL,分別以GAP-1和GAP-2、DT30-1和DT30-2為引物進行熒光定量PCR。每個梯度重復測定3次,以驗證標準曲線的重復性。以Realplex PCR儀軟件給出的Ct值作為縱坐標、以起始模板拷貝數作為橫坐標建立標準曲線。
1.9DT30拷貝數測定
取抽提的pPICZ-DT30/GS115基因組樣品,將其依次進行10倍稀釋,得到原液、10-1、10-2、10-3四個梯度。同樣分別以GAP-1和GAP-2、DT30-1和DT30-2為引物進行熒光定量PCR。每個梯度重復測定3次。
GAP基因在畢赤酵母中以單拷貝的形式存在[14],因此用GAP基因的拷貝數可以表征模板中基因組的起始拷貝數。DT30基因的拷貝數與GAP基因的拷貝數的比值即為DT30基因在畢赤酵母基因組中的起始拷貝數。
2結果與分析
2.1標準質粒構建
經PCR鑒定結果和測序結果表明,已成功構建了T-GAP和T-DT30質粒。微量核酸定量儀測定T-GAP濃度為276.1 ng/μL(OD260/OD280=1.91),T-DT30濃度為198.1 ng/μL(OD260/OD280=1.93),計算得T-GAP和T-DT30的拷貝數分別為1.14×1011copies/μL,0.821×1011copies/μL。
2.2標準曲線建立
T-GAP和T-DT30的擴增曲線及標準曲線如圖1,2所示。由實驗結果可知:曲線光滑平穩,有明顯的指數增長期,擴增效率較高,符合定量檢測要求。T-GAP的標準方程為y=-3.468x+35.30(R2=0.994),T-DT30的標準方程為y=-3.711x+37.66(R2=0.998),根據兩條曲線的斜率可以算出兩標準曲線的擴增效率,分別為0.90和0.94,比較接近。另外,從表4中可以看出,標準曲線Ct值的標準偏差在0.02~0.16之間,變異系數在0.07%~1.4%之間,說明建立的標準曲線精密度及重復性良好。
熔解曲線如圖3所示,為T-GAP和T-DT30 108~103copies/μL共6個梯度的實時定量PCR熔解曲線,可以看出:所有濃度下均可檢測到明顯的特異峰值,且無非特異性擴增的雜峰及引物二聚體的低矮小峰出現,證明引物特異性好。
2.3重組酵母工程菌中DT30拷貝數檢測
重組酵母工程菌pPICZ-DT30/GS115中DT30拷貝數檢測結果見表5和6。基因組樣品稀釋為4個梯度,熒光定量PCR得到的Ct值重復性良好,標準偏差都在0.12以下,且變異系數低于0.68%。由擴增曲線及熔解曲線(圖4、5)可知擴增效率好。測定的拷貝數數值在6.16~8.36之間,為消除系統誤差取平均值,則重組酵母工程菌pPICZ-DT30/GS115中DT30拷貝數為7。
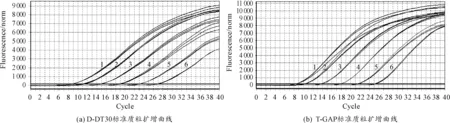
圖1 標準質粒的擴增曲線
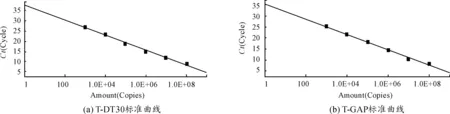
圖2 標準質粒的標準曲線

圖3 標準質粒的熔解曲線

標準質粒拷貝數(copies/μL)Ct值第1次第2次第3次Ct平均值T-GAPT-DT30T-GAPT-DT30T-GAPT-DT30T-GAPT-DT30標準偏差(SD)T-GAPT-DT30變異系數(CV%)T-GAPT-DT301088.528.728.588.818.498.798.538.770.050.120.451.4010710.3011.3510.2811.1810.4411.0510.3411.190.050.060.340.5110613.7814.7913.7914.8513.7714.7813.7814.810.030.060.150.3910517.8918.9717.8718.8517.8918.7617.8818.860.030.020.120.1210421.6023.0221.6523.1121.6222.9921.6223.040.090.020.310.0710325.2426.9325.3126.7725.0926.8025.2126.830.160.050.520.17

圖4 待測基因組樣品的擴增曲線
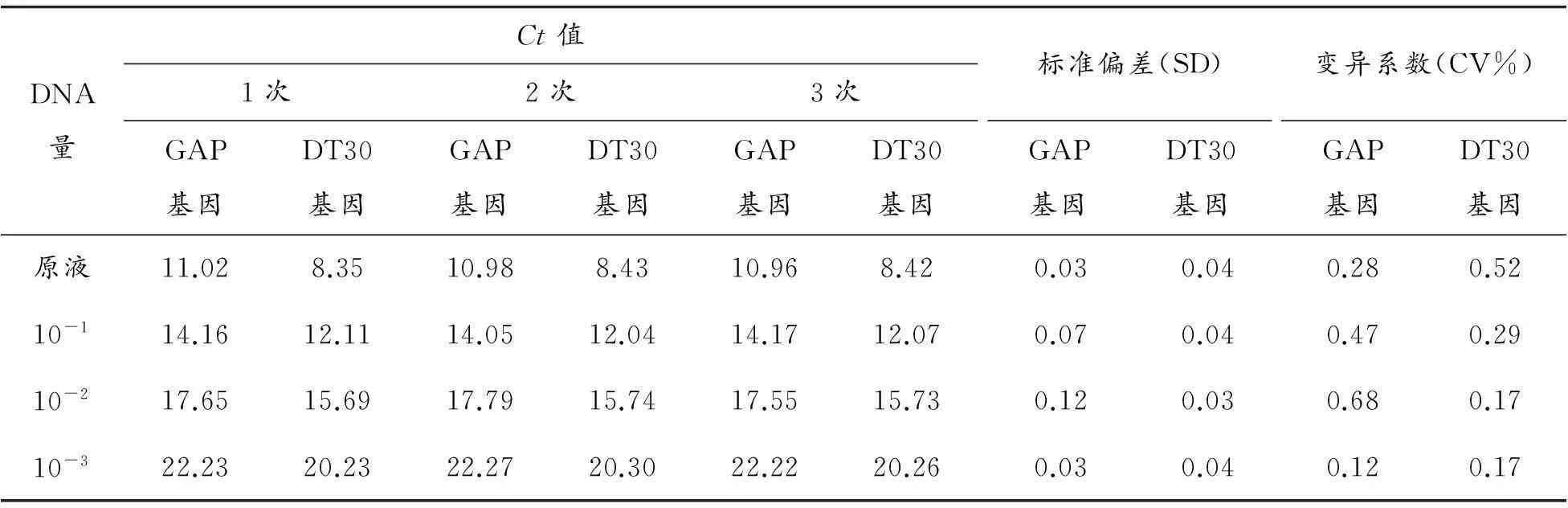
DNA量Ct值1次2次3次GAP基因DT30基因GAP基因DT30基因GAP基因DT30基因標準偏差(SD)GAP基因DT30基因變異系數(CV%)GAP基因DT30基因原液11.028.3510.988.4310.968.420.030.040.280.5210-114.1612.1114.0512.0414.1712.070.070.040.470.2910-217.6515.6917.7915.7417.5515.730.120.030.680.1710-322.2320.2322.2720.3022.2220.260.030.040.120.17
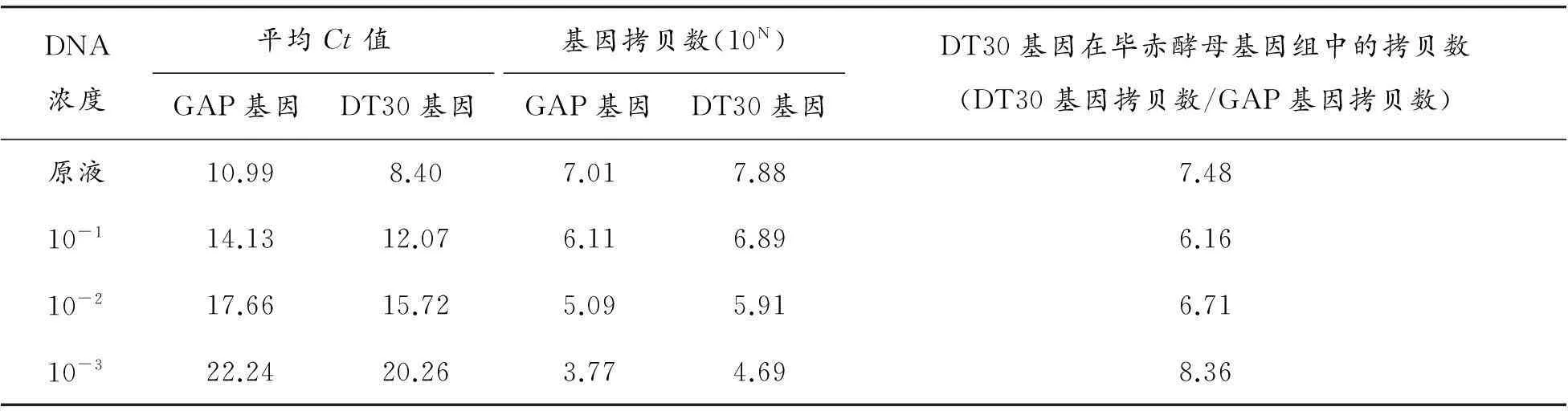
表6 實時熒光定量PCR法檢測 pPICZ-DT30/GS115中DT30拷貝數結果
3討論
本研究利用GAP和DT30雙標準曲線提出了一種檢測重組酵母工程菌pPICZ-DT30/GS115中DT30拷貝數的實時熒光定量PCR法。這種方法只需要盡量保證待測基因和內參基因的PCR擴增效率相近即可。本研究前期對該方法的穩定性、精密度進行了大量的研究實驗,為本研究奠定了堅實的基礎。GAP、DT30標準曲線檢測范圍為108~103copies/uL,相關系數好,Ct值標準偏差低于0.2,變異系數低于1.4%。有文獻報道[15],一般單個樣品的擴增反應的Ct值標準偏差低于0.3可認為可精確測定樣品的拷貝數,說明建立的標準曲線精密度及重復性良好。
目前關于QPCR法檢測酵母基因工程菌質粒拷貝數的報道很少。SYBR Green熒光定量PCR法快速、經濟、方便、準確度高,且可高通量篩選,引物設計合理,較少出現假陽性。GAP 基因為畢赤酵母看家基因,故此方法同樣適用于其他畢赤酵母菌株如X33、SMD1163等外源基因拷貝數的檢測。經后續實驗驗證,該方法還可應用在菌種保藏、發酵過程、傳代過程中監測拷貝數的變化方面,對菌種穩定性的考察有重要意義。
參考文獻:
[1]中華醫學會糖尿病學分會.中國II型糖尿病防治指南[M].北京:北京大學醫學出版社,2010.
[2]肖擁軍,曹春來.重組人胰島素制備過程中轉肽工藝的研究[J].現代生物醫學進展,2013(22):4206-4209.
[3]CEREGHINO J L,CREGG J M.Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J]. FEMS Microbiol Rev,2000,24(1):45-66.
[4]WEISBLUM B,GRAHAM M Y,GRYCZAN T.Plasmid copy number control:isolation and characterization of high-copy number mutants of plasmid pE194[J].J Bacteriol,1979,137:635.
[5]PROJAN S J,CARLETON S,NOVICK R P.Determination of plasmid copy number by fluorescence densitometry[J].Plasmid,1983,9:182.
[6]GENTHNE F J,HOOK L A,STROHL W R.Determination of the molecular mass of bacteriol genomic DNA and plasmid copy number by High-Pressure Liquid Chromatography[J].Appl Environ Microbiol,1985,50:1007.
[7]HUANG M,LIU S,MURRAY B K,et al.High resolution,separation and quantition of ribonucleotides using CE[J].Anal Biochem,1992,207:231.
[8]GIVSKOV M,MOLIN S.Copy number of plasmid R1:effects of base pair substitutions in the copA gene on the replication control system[J].Mol Gen Genet,1984,194:286.
[9]HINNEBUSCH J,BARBOUR A G.Linear- and circular-plasmid copy numbers in Borrelia burgdorfen[J].J Bacteriol,1992,174:5251.
[10]BUSTIN S A,BENES V,NOLAN T,et al.Quantitative real-time RT-PCR perspective[J].Journal of Molecular Endocrinology,2005,34(3):597-601.
[11]宣姚吉,周祥山,張元興.實時熒光定量PCR檢測畢赤酵母基因組中外源基因拷貝數[J].中國生物制品學雜志,2009,22(12):1236-1239.
[12]李凱,高宏雷.Taqman實時熒光定量PCR檢測畢赤酵母基因組中外源基因拷貝數[J].畜牧獸醫學報,2011,42(5):742-746.
[13]裘劫人,許穎.利用SYBR Green實時定量PCR法檢測轉基因植物外源基因的拷貝數[J].安徽農業科學,2011,39(21):12655-12657.
[14]WATERHAM H R,DIGAN M E,KOUTZ P J,et al.Isolation of the Pichia pastoris glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter[J].Gene,1997,186(1):37-44.
[15]BUBNER B,BALDWIN I T.Use of real-time PCR for detemining copy number and zygosity in transgenic plants[J].Plant Cell Rep,2004,23(5):263-271.
(責任編輯何杰玲)
Detection of Restructuring of Transgenic Copy Number of Pichia Engineering Bacteria with Fluorescence Quantitative PCR Method
GUO Jin-xia1, HE Yun-feng1, FAN Kai2
(College of Pharmacy and Bidogical Engineering, Chongqing University of Technology,Chongqing 400054, China; 2.Chongqing Fujin Biological Pharmacentical Co.,Ltd.,Chongqing 400050, China)
Abstract:A method for the reconstruction of the copy number of foreign gene DT30 in genome of the recombinant engineered yeast pPICZ-DT30/GS115 by real-time fluorescent quantitative PCR was developed. The yeast was used to express human insulin precursor(PI-DT30), and its expression and stability have largely impact on both the process research and the overall cost. The copy number of foreign gene is always an important indicator in detecting expression quantity. In this study, GAP gene, the housekeeping gene in Pichia pastoris, was used as a reference, and the double standard curves of GAP gene and DT30 gene were generated respectively. Then the genome of pPICZ-DT30/GS115 was analyzed by real-time fluorescent quantitative PCR, and the copy number of DT30 was calculated with the standard curves and Ct value. The results have seven.
Key words:fluorescent quantitative PCR; expression; pro-insulin; copy number
文章編號:1674-8425(2016)02-0077-07
中圖分類號:Q39
文獻標識碼:A
doi:10.3969/j.issn.1674-8425(z).2016.02.014
作者簡介:郭晉霞(1989—),女,山西人,碩士,主要從事基因工程藥物研究。
收稿日期:2015-10-22
引用格式:郭晉霞,何云鳳,范開.熒光定量PCR法檢測重組畢赤酵母工程菌的外源基因拷貝數[J].重慶理工大學學報(自然科學版),2016(2):77-83.
Citation format:GUO Jin-xia, HE Yun-feng, FAN Kai.Detection of Restructuring of Transgenic Copy Number of Pichia Engineering Bacteria with Fluorescence Quantitative PCR Method[J].Journal of Chongqing University of Technology(Natural Science),2016(2):77-83.

