PDCD4、mTOR在乳腺癌中的表達及意義①
王 新,韓麗麗,趙海豐,王 博,孫慶玉
(佳木斯大學(xué)附屬第一醫(yī)院腫瘤科,黑龍江 佳木斯 154003)
?
PDCD4、mTOR在乳腺癌中的表達及意義①
王新,韓麗麗,趙海豐,王博,孫慶玉
(佳木斯大學(xué)附屬第一醫(yī)院腫瘤科,黑龍江 佳木斯 154003)
摘要:目的:檢測PDCD4和mTOR蛋白在乳腺癌中的表達,分析與臨床病理的關(guān)系。方法:運用免疫組化SP法測PDCD4和mTOR蛋白在50例乳腺癌及癌旁組織中的表達。結(jié)果:乳腺癌及癌旁組織陽性率(28%,80%)(χ2=29.543,P<0.05),PDCD4 的表達與乳腺癌的組織分化有關(guān)(χ2=11.952,P<0.05),臨床分期有關(guān)(χ2=12.346,P<0.05),淋巴結(jié)轉(zhuǎn)移有關(guān)(χ2=6.349,P<0.05),比較差異有統(tǒng)計學(xué)意義(P<0.05),與年齡無關(guān)(χ2=2.266,P>0.05),腫瘤大小無關(guān)(χ2=2.066,P>0.05),比較差異無統(tǒng)計學(xué)意義。乳腺癌及癌旁組織陽性率(72%,26%)(χ2=25.882,P<0.05),mTOR的表達與組織學(xué)分化有關(guān)(χ2=7.291,P<0.05),淋巴結(jié)轉(zhuǎn)移有關(guān)(χ2=9.921,P<0.05),臨床分期有關(guān)(χ2=5.062,P<0.05),比較差異有統(tǒng)計學(xué)意義(P<0.05),與年齡無關(guān)(χ2=0.734,P>0.05),與腫瘤大小無關(guān)(χ2=0.651,P>0.05),比較差異無統(tǒng)計學(xué)意義,Spearman分析,PDCD4和mTOR的表達呈負相關(guān)(r=-0.355,P<0.05)。結(jié)論:①PDCD4蛋白在乳腺癌中低表達,mTOR蛋白高表達;②兩因子參與乳腺癌的發(fā)生發(fā)展。
關(guān)鍵詞:PDCD4;mTOR;乳腺癌;臨床意義
乳腺癌嚴重威脅婦女健康甚至生命,近年來發(fā)病率、死亡率在我國女性呈上升趨勢且年輕化。人們對乳腺癌的認識從宏觀到微觀,從表象到本質(zhì),隨分子生物學(xué)發(fā)展,乳腺癌病因、治療也發(fā)展至亞細胞分子水平,癌基因激活,抑癌基因失活,細胞周期異常均參與乳腺癌發(fā)生發(fā)展,且涉及多條信號通路。PDCD4是AKT/PI3K/mTOR通路下游重要靶點之一,研究發(fā)現(xiàn)它是一種新的抑癌的基因[1]。在細胞凋亡過程中扮演重要角色,并對腫瘤細胞生長有調(diào)控作用,此作用通過蛋白質(zhì)轉(zhuǎn)錄和翻譯實現(xiàn)。近年,在PDCD4基因?qū)Τ绦蛐约毎劳龅恼{(diào)控,細胞蛋白質(zhì)的翻譯等方面進行了大量研究。mTOR能調(diào)控細胞蛋白質(zhì)的合成,對細胞生長、增殖、血管生成也有重要作用。近年來發(fā)現(xiàn)[2],與mTOR相關(guān)的信號通路復(fù)雜且廣泛,通路中多個元素異常都和腫瘤發(fā)生發(fā)展甚至侵襲轉(zhuǎn)移有關(guān)。mTOR主要通過PI3k/Akt/mTOR信號通路對細胞周期等多種生理功能進行調(diào)控。許多相關(guān)的信號通路對乳腺癌的發(fā)生發(fā)展,侵襲及轉(zhuǎn)移都有調(diào)控作用,其中PI3k/ Akt/ mTOR信號通路在乳腺癌中存在高頻失調(diào),最高可達70%[3],相關(guān)文獻報導(dǎo)此通路的異常激活與乳腺癌的細胞增殖,對化療及內(nèi)分泌治療耐藥有關(guān)。
1材料與方法
1.1材料
1.1.1對象及標本
搜集2014-06~2015-06乳腺癌標本50例,來自佳木斯大學(xué)附屬第一醫(yī)院腫瘤科手術(shù)切除標本,對應(yīng)的癌旁組織為對照,30例淋巴結(jié)轉(zhuǎn)移的患者,無淋巴結(jié)轉(zhuǎn)移的20例。患者術(shù)前未做化療等治療。腫瘤的大小以最大橫徑為計,所有患者的臨床資料完整。年齡30~68歲。病理、淋巴結(jié)轉(zhuǎn)移均經(jīng)病理證實,皆為浸潤性導(dǎo)管癌。所有標本取下后常規(guī)固定等程序后備用。
1.1.2實驗用品
兔抗人PDCD4抗體及兔抗人mTOR抗體(北京博奧森生物技術(shù)有限公司),超凈工作臺,恒溫箱,顯色劑(DAB液),抗體稀釋液。
1.2實驗方法
1.2.1免疫組化步驟
通過病歷號選取病理科存檔的蠟塊切片脫蠟、封閉、滴加兔抗人PDCD4、mTOR,然后加二抗、顯色劑、復(fù)染,最后脫水、封片。陽性對照:已經(jīng)染色陽性的片子作對照。陰性對照:用PBS片代替為陰性對照。
1.2.2結(jié)果判定
PDCD4陽性表達于胞漿或胞核,主要胞漿。mTOR主要在胞漿表達。最終判定:≤3分為陰性(-),4~5分為弱陽性(+),6~7分為陽性(),≥8分為強陽性()。評定方法以下兩種結(jié)果相乘:染色強度分級:沒有染色記為0分,淡黃色記為1分,黃色或者深黃色記為2分,褐色或者棕褐色記為3分。陽性細胞比例:≤50%為2分,50%~75%為3分,≥75%為4分。
1.3統(tǒng)計學(xué)方法
采用SPSS17.0統(tǒng)計軟件處理。PDCD4和mTOR表達情況采用方差分析,各相關(guān)因素比較用秩相關(guān),P<0.05為差異有統(tǒng)計學(xué)意義。
2結(jié)果
2.1PDCD4表達
PDCD4陽性表達主要位于胞漿。PDCD4在乳腺癌及癌旁組織中比較差異有統(tǒng)計學(xué)意義(χ2=29.543,P<0.05)見表1。
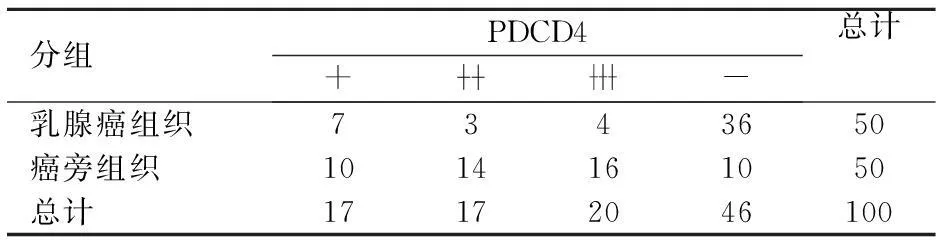
表1 乳腺癌及癌旁組織中PDCD4的表達情況
2.2mTOR表達
mTOR在乳腺癌旁組織及癌中表達比較差異有統(tǒng)計學(xué)意義(χ2=25.882,P<0.05),見表2。

表2 乳腺癌及癌旁組織中mTOR蛋白的表達情況
2.3PDCD4與臨床病理的關(guān)系
見表3。
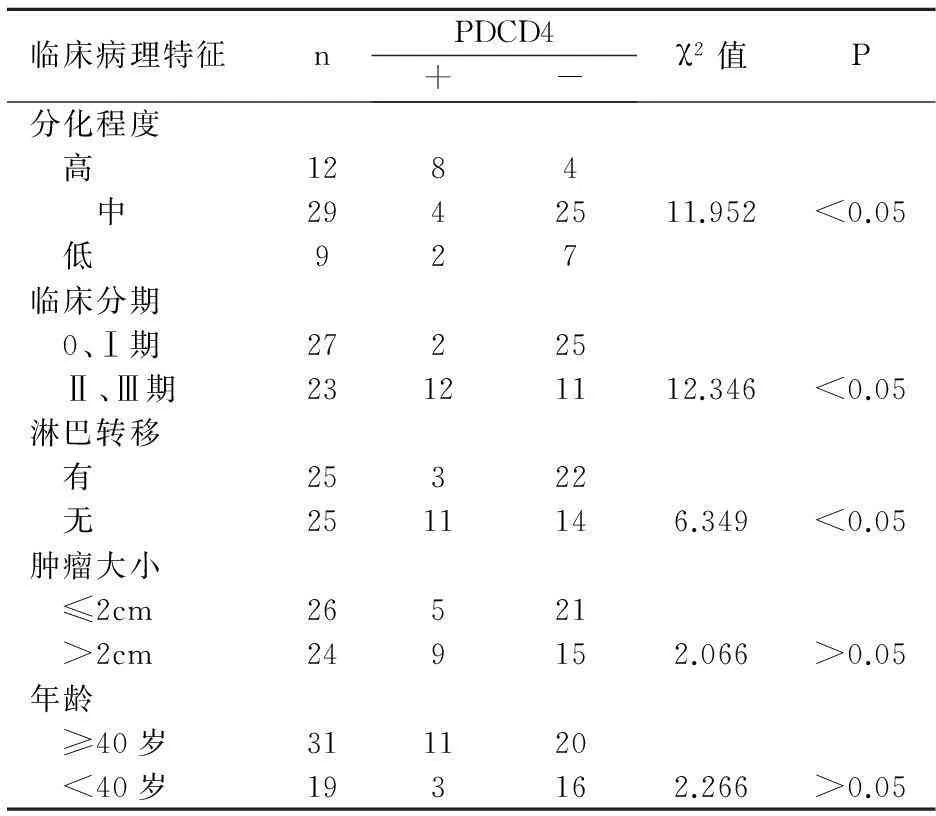
表3 PDCD4與臨床病理之間的關(guān)系
2.4mTOR與臨床病理之間的關(guān)系
見表4。
表4mTOR與臨床病理之間的關(guān)系
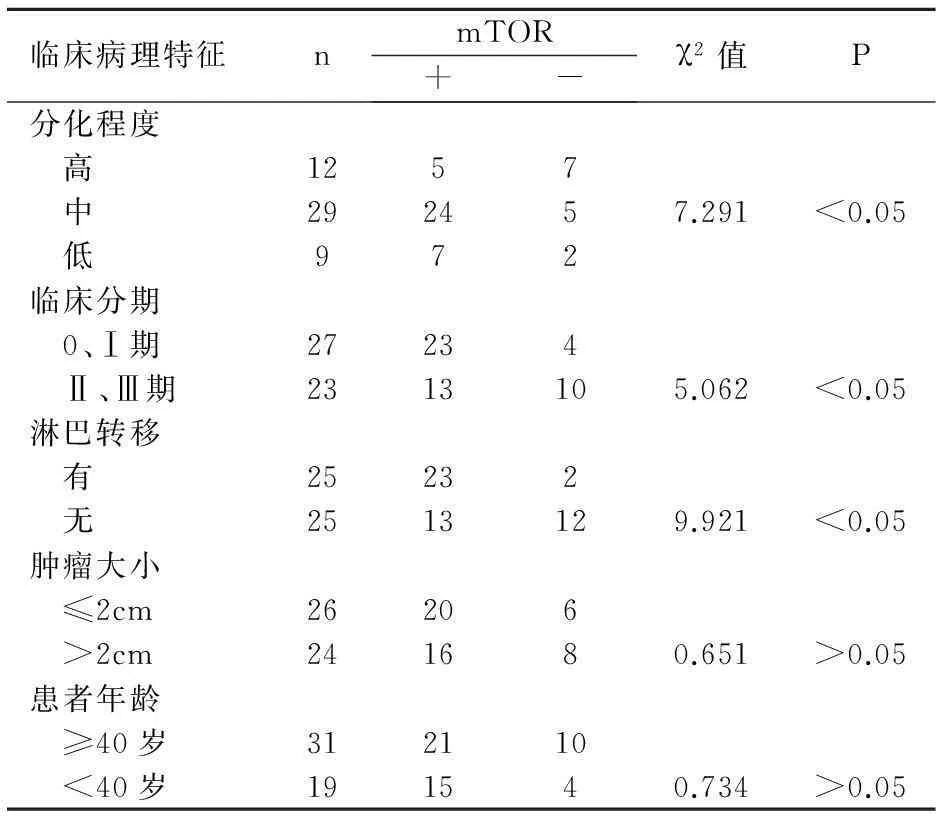
臨床病理特征nmTOR+-χ2值P分化程度 高1257 中292457.291<0.05 低972臨床分期 0、Ⅰ期27234 Ⅱ、Ⅲ期2313105.062<0.05淋巴轉(zhuǎn)移 有25232 無2513129.921<0.05腫瘤大小 ≤2cm26206 >2cm241680.651>0.05患者年齡 ≥40歲312110 <40歲191540.734>0.05
2.5PDCD4與mTOR之間的關(guān)系
經(jīng)分析PDCD4與mTOR表達負相關(guān)(r=-0.355,P=0.011)。見表5。
表5在乳腺癌中PDCD4與mTOR的相關(guān)
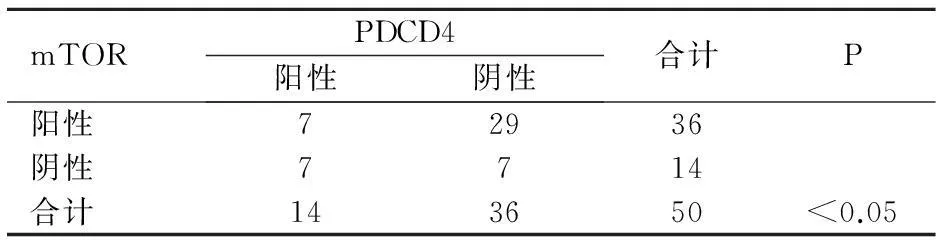
mTORPDCD4陽性陰性合計P陽性72936陰性7714合計143650<0.05
3討論
乳腺癌是現(xiàn)今威脅女性生命健康較常見疾病,盡管普查體系日臻完善,以手術(shù)為主各種綜合治療手段得以實施,但復(fù)發(fā)、轉(zhuǎn)移仍然是導(dǎo)致患者死亡主要原因。因此,研究熱點仍集中在尋找有意義的檢測因子,及尋找新的治療靶點方面。
PDCD4是1995年小鼠實驗時在其體內(nèi)發(fā)現(xiàn),證實為凋亡基因,位于10q24染色體,不少研究認為是新的抑癌基因。CHEN等[4]研究124例肺癌組織PDCD4的表達,發(fā)現(xiàn)下降或者缺失有84例,且與腫瘤惡性程度、預(yù)后有關(guān)。WEI等研究卵巢癌,發(fā)現(xiàn)PDCD4表達高的比低的術(shù)后生存期長。本實驗也發(fā)現(xiàn)PDCD4在癌中明顯低表達,且與組織學(xué),TNM分期,淋巴結(jié)轉(zhuǎn)移有關(guān),而年齡,腫瘤大小不影響其表達。
mTOR是高度保守的絲/蘇氨酸蛋白激酶,表達在神經(jīng)元上[5]。此外,PI3K/AKT通路和AKT/TSC1-TSC2兩條通路都對mTOR有調(diào)控,從而調(diào)節(jié)細胞增殖、生長。因此,mTOR通路任一點異常都可能形成腫瘤,所以可針對此通路開發(fā)抑制腫瘤藥。林萍等[6]研究人結(jié)腸癌,發(fā)現(xiàn)mTOR在癌組織中高表達,且與腫瘤臨床分期,淋巴結(jié)轉(zhuǎn)移,浸潤深度有關(guān)。與患者的年齡,性別無關(guān)。本實驗同樣發(fā)現(xiàn)乳腺癌組織中mTOR蛋白的表達顯著高于癌旁組織,且mTOR蛋白在乳腺癌中的表達與臨床病理之間的關(guān)系與其大體相同。相關(guān)性分析,PDCD4和mTOR表達呈負相關(guān),推測PDCD4與mTOR參與乳腺癌的發(fā)生發(fā)展。
相關(guān)文獻報道,mTOR、cox-2等多種因子對PDCD4有調(diào)控作用,其中mTOR/p7os6k通路起重要作用。Dorrello等發(fā)現(xiàn)在促細胞分裂素作用下,s6k1(核糖體p70s6激酶蛋白)被激活后使PDCD4在ser67處迅速磷酸化,與泛素連接酶SCFβTRCP結(jié)合后,PDCD4泛素化被蛋白酶降解。PDCD4含兩個AKT磷酸化位點,ser67和ser457,無論體內(nèi)或體外,PDCD4的ser67和ser457殘基都能被AKT特異磷酸化,因此AKT也被認為參與PDCD4的磷酸化降解。 由于s6k1的活性主要受上游通路PI3K/AKT/mTOR調(diào)節(jié), 因此任何能引起此此通路活性改變的因子均能通過影響s6k1而間接調(diào)控PDCD4的表達。mTOR是AKT下游重要作用靶點之一,磷酸化后的AKT能直接使TSC2磷酸化而激活mTOR。mTOR 通常是以mTORc1和mTORc2兩種蛋白復(fù)合物形式存在。其中活化的mTORc1可以直接使下游的6k1和4EBP1磷酸化后活化。S6k1可以使核糖體蛋白s6磷酸化其下游的靶點PDCD4。S6k1是目前已知mTORc1直接作用的重要底物,是調(diào)控蛋白質(zhì)翻譯、細胞增殖及大小的重要因子。從以上敘述可看出乳腺癌的發(fā)生發(fā)展復(fù)雜,涉及多因子、信號通路,且各個環(huán)節(jié)相互作用制約,因此乳腺癌的未來治療方向一定是采用針對個基因及多信號通路的共同抑制或激活的手段,才能達理想效果。通過控制PI3K/AKT/mTOR通路及其相關(guān)交叉通路,然后結(jié)合放化療等多層次抑制乳腺癌細胞生長,促進細胞凋亡,已經(jīng)成為治療乳腺癌的新的思路。
參考文獻:
[1]韓曉蓉,吳坤河,郜紅藝,等.不同分子亞型乳腺癌細胞死亡因子4的表達及其與預(yù)后的關(guān)系[J].中國普外基礎(chǔ)與臨床雜志,2004,21(5):577-582
[2]鄭鵬生,冀靜.mTOR信號通路與腫瘤的研究進展[J].西安交通大學(xué)學(xué)報,2010,31(1):1-2
[3]Loper-Kknowles E ,O Toole SA,McNeil CM,et al.PI3K pathway activiation in breast cancer is associated with the basal-like phenotype and cancer-specific mortality[J].Int J cancer,2010, 126(5):1121-1131
[4]Chen Y,Knosel T,Kristiansen Q et al. Loss of PDCD4 expression in human lung cancer correlates with tumour progression and prognosis[J]. J Pathol,2003,200:640-646
[5]王顯鶴,國添玉.發(fā)育期大鼠反復(fù)持續(xù)驚厥對皮層AMPK/mTOR表達及雷帕霉素的干預(yù)作用[J].黑龍江醫(yī)藥科學(xué),2013,36(4):48-49
[6]林萍,鄧濤,葉彥,等.人結(jié)腸直癌組織中mTOR、HIF-1α、PKM2的表達及臨床意義[J].疑難病雜志,2015,14(4):380-383
(收稿日期:2015-05-24)
中圖分類號:R737.9
文獻標識碼:B
文章編號:1008-0104(2016)01-0082-02
作者簡介:王新(1963~)男,黑龍江佳木斯人,碩士,主任醫(yī)師,教授,碩士研究生導(dǎo)師。通訊作者:韓麗麗(1986~)女,山東淄博人,在讀碩士研究生。E-mail:1159518837@qq. com。

