帕金森病患者血清β-淀粉樣蛋白1-42水平及其與病情的關系研究
梁若冰,雷 晶,張小寧
·論著·
帕金森病患者血清β-淀粉樣蛋白1-42水平及其與病情的關系研究
梁若冰,雷 晶,張小寧
目的 了解帕金森病(PD)患者的血清β-淀粉樣蛋白1-42(Aβ1-42)水平,并探討其與病情的關系。方法 選取2014年5月—2015年5月到新疆醫科大學第一附屬醫院神經內科就診的PD患者108例為病例組;另選取同時期在本院體檢中心進行體檢的健康成年人108例為對照組。收集兩組的一般資料,并檢測其血清Aβ1-42水平。以病程、統一帕金森病評定量表(UPDRS)評分及Hoehn-Yahr(H-Y)分級判斷PD患者的病情嚴重程度,分析血清Aβ1-42水平與病情的相關關系。結果 兩組血清Aβ1-42水平比較,差異有統計學意義(P<0.05)。以性別分層,兩組男性受試者的血清Aβ1-42水平比較,差異有統計學意義(P<0.05);而兩組女性受試者的血清Aβ1-42水平比較,差異無統計學意義(P>0.05)。以年齡分層,兩組≤60歲受試者的血清Aβ1-42水平比較,差異無統計學意義(P>0.05);兩組>60歲受試者的血清Aβ1-42水平比較,差異有統計學意義(P<0.05)。以民族分層,兩組漢族受試者的血清Aβ1-42水平比較,差異有統計學意義(P<0.05);兩組維吾爾族受試者的血清Aβ1-42水平比較,差異無統計學意義(P>0.05)。早期和中晚期患者的血清Aβ1-42水平比較,差異無統計學意義(P>0.05)。Spearman秩相關分析顯示,血清Aβ1-42水平與PD患者病程無相關性(rs=0.06,P>0.05);與UPDRS第Ⅰ部分評分(rs=-0.11,P>0.05)、第Ⅱ部分評分(rs=-0.09,P>0.05)、第Ⅲ部分評分(rs=0.10,P>0.05)無相關性;與H-Y分級呈負相關(rs=-0.25,P<0.05)。結論 PD患者血清Aβ1-42水平較低,血清Aβ1-42水平可能為PD臨床診斷中的新型生物學指標,但尚不能作為病情嚴重程度的判斷指標。
帕金森病;淀粉樣蛋白;病情
梁若冰,雷晶,張小寧.帕金森病患者血清β-淀粉樣蛋白1-42水平及其與病情的關系研究[J].中國全科醫學,2016,19(10):1165-1169.[www.chinagp.net]
Liang RB,Lei J,Zhang XN.Level of serum β-amyloid protein 1-42 and its relationship with the disease severity of patients with Parkinson disease[J].Chinese General Practice,2016,19(10):1165-1169.
帕金森病(PD)是一種多發于中老年人,進展較為緩慢的神經系統退變性病變。截至2005年,我國的PD總患病人數已超過172萬[1];預計到2050年將增加至近800萬[2]。PD患者不僅會出現靜止性震顫、肌肉強直、運動遲緩、姿勢步態異常等運動癥狀,也常常會出現嗅覺減退、精神異常、認知功能減退等非運動癥狀。目前,臨床上對于PD的診斷主要根據典型臨床癥狀及對左旋多巴治療有效,存在一定的診斷錯誤率,且當PD患者出現特異性臨床癥狀時其腦內退行性病變已不可逆轉。PD患者的病程較長,當前治療多為改善患者的臨床癥狀,尚不能治愈,因此PD的臨床治療一直是國內外相關領域的研究熱點。有研究顯示,檢測患者的腦脊液(cerebrospinal fluid,CSF)β-淀粉樣蛋白1-42 (Aβ1-42)水平有利于PD診斷[3-4],但國內關于Aβ1-42水平與PD關系的研究較少。本研究旨在了解PD患者的血清Aβ1-42水平,并探討其與患者病情的相關關系,以期為尋找與PD診斷有關的生物學指標及PD的早期干預提供依據。
1 對象與方法
1.1 研究對象 選取2014年5月—2015年5月到新疆醫科大學第一附屬醫院神經內科就診的PD患者108例為病例組。診斷標準參照英國帕金森病協會制定的《腦庫帕金森病臨床診斷標準》[5]。納入標準:(1)病歷資料完整;(2)無PD家族史。排除標準:(1)腦血管病、腦炎、創傷及藥物等導致的PD綜合征、PD疊加綜合征患者;(2)阿爾茨海默病、血管性癡呆等其他智能障礙綜合征患者。另選取同時期在本院體檢中心進行體檢的健康成年人108例為對照組。研究通過了新疆醫科大學第一附屬醫院倫理中心的批準,研究前患者及其家屬均簽署知情同意書。
1.2 研究方法 收集兩組的一般資料,并檢測其血清Aβ1-42水平。以病程、統一帕金森病評定量表(UPDRS)[6]評分及Hoehn-Yahr(H-Y)分級判斷PD患者的病情嚴重程度,分析血清Aβ1-42水平與病情的相關關系。
1.2.1 一般資料收集 通過查閱電子病歷和體檢檔案,收集兩組的一般資料,包括性別、年齡、民族及病例組患者的病程。
1.2.2 血清Aβ1-42水平檢測 分別于病例組入院次日和對照組體檢當日的清晨,抽取兩組空腹外周靜脈血5 ml。采用HC-2518高速離心機(科大創新股份有限公司中佳分公司生產),在4 ℃下,以3 000 r/min離心10 min。分離上清液,分裝于0.5 ml離心管中,置于-80 ℃冰箱中保存。待樣本收集齊后,統一解凍。采用人血清Aβ1-42 ELISA檢測試劑盒(武漢華美公司生產),嚴格按照產品說明書進行Aβ1-42檢測的預試驗和正式試驗。采用BIO-RAD全波長酶標儀在450 nm波長處讀取標準樣品的相應光密度(OD)值,代入Curve Expert 1.3軟件得出標準曲線方程,根據樣本OD值獲得相應Aβ1-42水平。
1.2.3 UPDRS評分 由經過統一培訓的神經內科醫務人員,在PD患者處于安靜狀態下的“開期(癥狀緩解)”,對其進行UPDRS評分。UPDRS共分為6部分,本研究主要選用其中的第Ⅰ、Ⅱ、Ⅲ、Ⅴ部分。(1)第Ⅰ部分為精神、行為及情緒,用于判斷PD患者的精神活動和情感障礙;第Ⅱ部分為日常生活活動,用于判斷PD患者的日常生活能力;第Ⅲ部分為運動檢查,用于判斷PD患者的運動功能。各項目均分為5個等級,計分為0~4分,其中0分表示正常,分數越高表示癥狀越重。(2)第Ⅴ部分為H-Y分級,用于判斷PD患者的疾病發展程度。0級=無疾病體征;1級=單側肢體癥狀;1.5級=單側肢體+軀干癥狀;2級=雙側肢體癥狀,無平衡障礙;2.5級=輕度雙側肢體癥狀,后拉試驗可恢復;3級=輕至中度雙側肢體癥狀,平衡障礙,保留獨立能力;4級=嚴重障礙,在無協助的情況下仍能行走或站立;5級=患者限制在輪椅或床上,需人照料。以H-Y分級<3級為疾病早期,以H-Y分級≥3級為疾病中晚期。
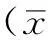
2 結果
2.1 兩組一般資料比較 兩組性別、年齡及民族比較,差異無統計學意義(P>0.05,見表1)。
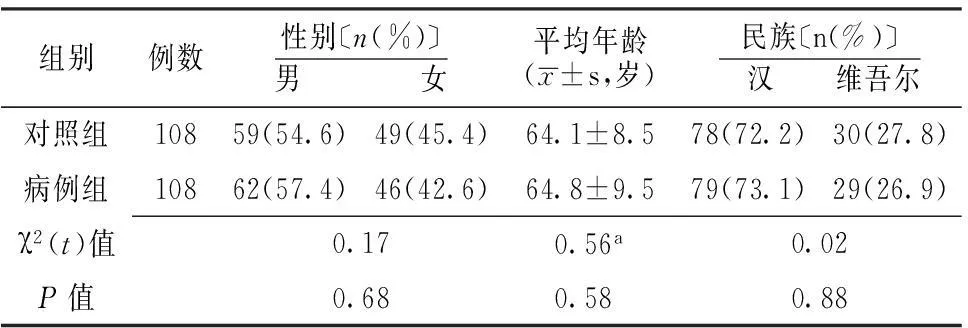
表1 兩組一般資料比較
注:a為t值
2.2 兩組血清Aβ1-42水平比較 對照組和病例組的血清Aβ1-42水平分別為(1.18±0.45)和(1.02±0.47) μg/L,兩組比較,差異有統計學意義(t=2.56,P<0.05)。以性別分層,兩組男性受試者的血清Aβ1-42水平比較,差異有統計學意義(P<0.05);兩組女性受試者的血清Aβ1-42水平比較,差異無統計學意義(P>0.05)。以年齡分層,兩組≤60歲受試者的血清Aβ1-42水平比較,差異無統計學意義(P>0.05);兩組>60歲受試者的血清Aβ1-42水平比較,差異有統計學意義(P<0.05)。以民族分層,兩組漢族受試者的血清Aβ1-42水平比較,差異有統計學意義(P<0.05);兩組維吾爾族受試者的血清Aβ1-42水平比較,差異無統計學意義(P>0.05,見表2)。
Table2ComparisonofserumAβ1-42levelamongsubjectswithdifferentdemographicdata

一般資料例數對照組病例組t值P值性別 男1211.23±0.531.05±0.442.030.04 女951.12±0.330.98±0.511.630.11年齡 ≤60歲691.07±0.311.18±0.660.370.71 >60歲1471.24±0.500.95±0.354.14<0.01民族 漢1571.05±0.360.90±0.322.860.01 維吾爾591.50±0.511.34±0.641.070.29
注:Aβ1-42=β-淀粉樣蛋白1-42
2.3 PD患者的病情 PD患者的平均病程為(3.85±3.97)年;UPDRS第Ⅰ部分平均評分為(2.31±1.88)分,第Ⅱ部分平均評分為(16.89±7.62)分,第Ⅲ部分平均評分為(36.54±16.12)分;H-Y分級顯示為早期患者50例(46.3%),中晚期患者58例(53.7%)。
2.4 PD患者血清Aβ1-42水平與病情的關系 早期患者的血清Aβ1-42水平為(1.04±0.45) μg/L,中晚期患者的血清Aβ1-42水平為(0.99±0.50) μg/L,兩者比較,差異無統計學意義(t=0.51,P>0.05)。Spearman秩相關分析顯示,血清Aβ1-42水平與PD患者病程無相關性(rs=0.06,P>0.05);與UPDRS第Ⅰ部分評分(rs=-0.11,P>0.05)、第Ⅱ部分評分(rs=-0.09,P>0.05)、第Ⅲ部分評分(rs=0.10,P>0.05)無相關性;與H-Y分級呈負相關(rs=-0.25,P<0.05)。
3 討論
淀粉樣前體蛋白(APP)是β-淀粉樣蛋白(Aβ)的前體蛋白。該蛋白基因主要在大腦中表達,外周多種細胞中也均有表達,如血管內皮細胞和血小板[7]。生理情況下,腦內Aβ的生成和降解處于動態平衡,主要依靠β-分泌酶途徑生成胰島素降解酶和腦啡肽酶。同時,血-腦脊液屏障上Aβ可以通過內向轉運和外向轉運維持腦與外周血的Aβ水平平衡,其中起重要作用的是低密度脂蛋白受體相關蛋白1和高級糖基化終產物受體(RAGE)。前者負責將Aβ外向轉運至血液,后者進行內向轉運至腦內,當兩者轉運和表達失衡時,可引起Aβ的異常聚集和沉淀。當編碼APP的基因發生突變或其他原因導致β-分泌酶活性異常增高時,APP則容易被β-分泌酶與γ-分泌酶共同切割產生Aβ,主要生成Aβ1-40和Aβ1-42兩種形式,Aβ1-42亞型雖含量遠低于Aβ1-40,但其更容易聚集,且神經毒性更強。
PD的典型病理特征為中腦黑質致密部多巴胺(dopamine,DA)能神經元變性缺失,張巍等[8]通過研究發現,Aβ可以導致DA能神經元進行性變性,明顯改變DA能神經元形態,呈劑量依賴性。體外細胞培養顯示,一定濃度的Aβ1-42可以誘導產生一氧化氮(NO),從而誘導炎性級聯反應和氧化應激反應,損傷蛋白質及膜性結構,導致神經元壞死或凋亡,這一結論符合PD的神經炎性學說[9]。這些研究均提示,Aβ1-42參與了PD的病理變化。
近年來,Aβ1-42成為國內外關于神經系統退變性疾病生物學標志物的研究熱點,尤其是在PD方面。國際研究結果顯示,PD患者CSF中的Aβ1-42水平低于健康對照者[3,10-11];但也有研究結果顯示,并未發現PD患者和健康對照者的CSF中的Aβ1-42水平存在差異[12]。Maetzler等[13]發現,在13名PD伴阿爾茨海默病患者的血清中,Aβ1-42天然自身抗體的水平高于對照組,但兩者間差異無統計學意義[14]。本研究結果顯示,病例組患者的血清Aβ1-42水平低于對照組。由于Aβ1-42可引起血-腦脊液屏障滲透性增強,緊密連接蛋白損傷,上調RAGE作用[15],使得血腦屏障上Aβ1-42內向轉運多于外向轉運,患者腦內Aβ1-42水平異常升高,形成聚集沉積,而外周血中的Aβ1-42水平相應減少。臨床和流行病學研究結果顯示,雌激素具有神經保護功能[16];一項大鼠實驗的研究結果顯示,雌激素可以減少Aβ的神經毒性,對大腦中的過量Aβ有清除作用[17]。這可能部分解釋了本研究中男性PD患者的血清Aβ1-42水平較對照組男性低,而兩組女性受試者比較,差異無統計學意義的結果。同時,本研究結果也顯示,年齡>60歲PD患者的血清Aβ1-42水平低于同年齡層對照組受試者。既往研究也顯示,血清Aβ1-42水平降低與Aβ1-42聚集沉積和年齡有相關性[12],提示年齡越大,Aβ1-42越容易聚集,不可溶性Aβ1-42增多,可溶性Aβ1-42減少。另外,本研究發現漢族PD患者的血清Aβ1-42水平較漢族對照組低,而兩組維吾爾族受試者比較,差異無統計學意義。這可能與本研究納入的維吾爾族樣本量較少有關,提示進一步的研究應注意擴大各族患者的樣本量。
目前,臨床上常根據患者的臨床癥狀嚴重程度,按照H-Y分級將PD病程分為早期和中晚期。本研究結果顯示,中晚期PD患者的血清Aβ1-42水平較早期患者低,但兩者比較差異無統計學意義。由于PD晚期患者的皮質和海馬區常同時存在Aβ和α-突觸核蛋白(α-Syn)異常聚集,隨PD病程進展,低聚性Aβ損傷血-腦脊液屏障,內向轉運增強,CSF中可溶性Aβ減少,這可能是血清Aβ1-42水平降低的原因之一。本研究結果還顯示,PD患者血清Aβ1-42水平與UPDRS第Ⅰ、Ⅱ、Ⅲ部分評分均無相關性,推測可能是因為精神、情感及運動的腦病變部位不同,對Aβ1-42的反應機制也不同,但具體原因仍需進一步研究。既往研究結果顯示,病程較長PD患者的CSF中Aβ1-42水平較健康對照者低[18],而本研究結果顯示,PD患者的血清Aβ1-42水平與病程無相關性。但血清Aβ1-42水平與H-Y分級呈負相關,表明隨H-Y分級的增加,PD患者血清Aβ1-42水平會降低。Shi等[19]關于PD患者病程進展的縱向研究結果顯示,PD患者CSF中的Aβ1-42水平與PD嚴重程度呈正相關。說明血清Aβ1-42水平可能是診斷PD的新型生物學指標,但其診斷價值仍有待于進一步研究證實。
綜上所述,PD自發現到現在已有近兩個甲子的研究歷史,國內外研究者均致力于聯合多種族、多地區探索新的、有意義的生物學標志物,但由于其機制復雜,仍未能發現特異性指標。本研究結果表明,PD患者的血清Aβ1-42水平低于對照組,特別是男性、年齡>60歲及漢族患者;病情較重患者的血清Aβ1-42水平較低。本研究為初步橫斷面研究,未來的研究應對患者進行跟蹤隨訪,并進行縱向比較研究,以明確血清Aβ1-42水平在PD診斷和病情評估中的臨床價值。
作者貢獻:梁若冰進行資料收集、試驗實施、撰寫論文、成文并對文章負責;雷晶進行試驗設計與實施、評估;張小寧進行質量控制與審校。
本文無利益沖突。
[1]Rocca WA.Prevalence of Parkinson′s disease in China[J].Lancet Neurol,2005,4(6):328-329.
[2]Zhang LJ,Shao HT,Wang YX,et al.Progress in Parkinson′s disease[J].Chinese Bulletin of Life Sciences,2014,26(6):560-570.(in Chinese)
張麗娟,邵海濤,王躍秀,等.帕金森病研究進展[J].生命科學,2014,26(6):560-570.
[3]Kang JH,Irwin DJ,Chen-Plotkin AS,et al.Association of cerebrospinal fluid β-amyloid 1-42,T-tau,P-tau181,and α-synuclein levels with clinical features of drug-naive patients with early Parkinson disease[J].JAMA Neurol,2013,70(10):1277-1287.
[4]Xu XH,Ma CM,Han YZ,et al.β-amyloid precursor protein expression level in peripheral platelets in patients with Parkinson′s disease and dementia[J].Chinese General Practice,2015,18(21):2507-2510.(in Chinese)
許曉輝,馬聰敏,韓月珍,等.帕金森病癡呆患者外周血血小板β淀粉樣前體蛋白表達水平研究[J].中國全科醫學,2015,18(21):2507-2510.
[5]Joutsa J,Gardberg M,R?ytt? M,et al.Diagnostic accuracy of parkinsonism syndromes by general neurologists[J].Parkinsonism Relat Disord,2014,20(8):840-844.
[6]統一帕金森病評定量表[J].中華老年醫學雜志,1999,18(1):61-62.
[7]Hansson O,Stomrud E,Vanmechelen E,et al.Evaluation of plasma Aβ as predictor of Alzheimer′s disease in older individuals without dementia:a population-based study[J].J Alzheimers Dis,2012,28(1):231-238.
[8]Zhang W,Wang YJ,HONG JS,et al.A mechanistic study of parkinson disease-like clinical characteristics in patients with Alzheimer disease[J].Chinese Journal of Neuroimmunology and Neurology,2008,15(5):334-338.(in Chinese)
張巍,王擁軍,Jau-shyong HONG,等.阿爾茨海默病患者表現帕金森病樣臨床特征的機制[J].中國神經免疫學和神經病學雜志,2008,15(5):334-338.
[9]Qi FT,Zhang XW,Tong YP,et al.Clinical studies on autonomic dysfunction in patients with newly diagnosed Parkinson disease[J].Chinese General Practice,2014,17(9):1001-1004.(in Chinese)
戚飛騰,章小微,童洋萍,等.帕金森病初診患者自主神經功能障礙臨床研究[J].中國全科醫學,2014,17(9):1001-1004.
[10]Bibl M,Mollenhauer B,Esselmann H,et al.CSF amyloid-beta-peptides in Alzheimer′s disease,dementia with Lewy bodies and Parkinson′s disease dementia[J].Brain,2006,129(Pt 5):1177-1187.
[11]Zhang J,Sokal I,Peskind ER,et al.CSF multianalyte profile distinguishes Alzheimer and Parkinson diseases[J].Am J Clin Pathol,2008,129(4):526-529.
[12]Bekris LM,Tsuang DW,Peskind ER,et al.Cerebrospinal fluid Aβ42 levels and APP processing pathway genes in Parkinson′s disease[J].Mov Disord,2015,30(7):936-944.
[13]Maetzler W,Berg D,Synofzik M,et al.Autoantibodies against amyloid and glial-derived antigens are increased in serum and cerebrospinal fluid of Lewy body-associated dementias[J].J Alzheimers Dis,2011,26(1):171-179.
[14]Maerzler W,Anja A,Markus L,et al.Comparable autoantibody serum levels against amyloid-and inflammation-association proteins in Parkinson′s disease patients and controls[J].PLoS One,2014,9(2):e88604.
[15]Wan W,Cao L,Liu L,et al.Aβ(1-42) oligomer-induced leakage in an in vitro blood-brain barrier model is associated with up-regulation of RAGE and metalloproteinases,and down-regulation of tight junction scaffold proteins[J].J Neurochem,2015,134(2):382-393.
[16]Currie LJ,Harrison MB,Trugman JM,et al.Postmenopausal estrogen use affects risk for Parkinson disease[J].Arch Neurol,2004,61(6):886-888.
[17]Guo R,Cao YP.Eliminating effect of estrogen on β amyloid protein of rat hippocampus[J].Chinese Journal of Gerontology,2010,9(30):2602-2604.(in Chinese)
郭蓉,曹云鵬.雌激素對大鼠海馬β-淀粉樣蛋白的清除作用[J].中國老年學雜志,2010,9(30):2602-2604.
[18]Maetzler W,Liepelt I,Berg D,et al.Progression of Parkinson′s disease in the clinical phase:potential markers[J].Lancet Neurol,2009,8(12):1158-1171.
[19]Shi M,Bradner J,Hancock AM,et al.Cerebrospinal fluid biomarkers for Parkinson disease diagnosis and progression[J].Ann Neurol,2011,69(3):570-580.
Level of Serum β-amyloid Protein 1-42 and Its Relationship With the Disease Severity of Patients With Parkinson Disease
LIANGRuo-bing,LEIJing,ZHANGXiao-ning.DepartmentofNeurology,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China
Objective To investigate the level of serum β-amyloid protein 1-42(Aβ1-42) and its relationship with the disease status of patients with Parkinson disease(PD).Methods A total of 108 PD patients who received treatment in the Department of Neurology of the First Affiliated Hospital of Xinjiang Medical University from May 2014 to May 2015 were enrolled as case group.We also enrolled 108 healthy adults who received physical examination in the physical examination center of the hospital during the same period as control group.General data of the two groups were collected,and serum Aβ1-42 level was detected.The disease severity of these PD patients were determined by length of disease,Unified PD Rating Scale(UPDRS) score and Hoehn-Yahr(H-Y) grading,and the correlation between serum Aβ1-42 level and disease severity was investigated.Results The two groups were significantly different in serum Aβ1-42 level(P<0.05).With gender stratification,the two groups were significantly different in the serum Aβ1-42 level of male subjects(P<0.05),and the two groups were significantly different in the serum Aβ1-42 level of female subjects(P>0.05).With age stratification,the two groups were not significantly different in the serum Aβ1-42 level of patients aged ≤60(P>0.05),and the two groups were significantly different in the serum Aβ1-42 level of patients aged >60(P<0.05).With nationality stratification,the two groups were significantly different in the serum Aβ1-42 level of Han subjects(P<0.05),and the two groups were not significantly different in the serum Aβ1-42 level of Uygur subjects(P>0.05).Patients at early stage and patients at middle and late stage were not significantly different in serum Aβ1-42 level(P>0.05).Spearman correlation analysis showed that serum Aβ1-42 level had no correlation with the length of disease of PD patients(rs=0.06,P>0.05),had no correlation with part Ⅰ score(rs=-0.11,P>0.05),part Ⅱ score(rs=-0.09,P>0.05),part Ⅲ score of UPDRS(rs=0.10,P>0.05),and had negative correlation with H-Y grading(rs=-0.25,P<0.05).Conclusion PD patients have lower serum Aβ1-42 level,and serum Aβ1-42 level may become a new biological index for the clinical diagnosis of PD,but can not be used as a diagnostic index for disease severity.
Parkinson disease;Amyloid;Disease severity
新疆維吾爾自治區高技術研究發展項目(201417101)
830054 新疆維吾爾自治區烏魯木齊市,新疆醫科大學第一附屬醫院神經內科
張小寧,830054 新疆維吾爾自治區烏魯木齊市,新疆醫科大學第一附屬醫院神經內科;E-mail:zxn-1960@163.com
R 742.5
A
10.3969/j.issn.1007-9572.2016.10.013
2015-12-05;修回日期:2016-02-18)
王鳳微)

