CD55和CD59檢測在陣發性睡眠性血紅蛋白尿診斷中的意義
吳瓊,王小中
(南昌大學第二附屬醫院檢驗科,江西南昌330006)
?
CD55和CD59檢測在陣發性睡眠性血紅蛋白尿診斷中的意義
吳瓊,王小中
(南昌大學第二附屬醫院檢驗科,江西南昌330006)
摘要:目的探討應用流式細胞術檢測CD55和CD59在陣發性睡眠性血紅蛋白尿(PNH)診斷中的應用價值。方法應用流式細胞術檢測貧血患者及健康對照組外周血紅細胞和粒細胞的表面抗原CD55、CD59的表達水平,并同時做Ham試驗、糖水試驗和尿Rous試驗。結果健康對照組紅細胞和粒細胞CD55-、CD59-的測定結果均小于5%。7例PNH患者紅細胞和粒細胞CD55-、CD59-的測定結果均大于5%;20例AA患者中有2例紅細胞CD55-、CD59-測定結果大于5%;粒細胞CD55-、CD59-大于5%的有1例;部分IDA患者紅細胞CD55-、CD59-大于5%,而粒細胞的結果全部正常;MA和AIHA患者的紅細胞和粒細胞CD55-、CD59-的測定結果均正常。7例PNH患者中,Ham試驗2例陰性,尿Rous試驗1例陰性,而其紅細胞和粒細胞CD55-、CD59-的測定結果均大于5%。結論利用流式細胞術同時檢測外周血中紅細胞和粒細胞CD55和CD59的表達對PNH的診斷具有無可比擬的優勢,利于PNH的早期發現,是目前診斷PNH最敏感的方法。
關鍵詞:陣發性睡眠性血紅蛋白尿;CD55;CD59;流式細胞術
陣發性睡眠性血紅蛋白尿(paroxysmal nocturnal hemoglobinuria,PNH)是一種獲得性造血干細胞基因突變導致的血液病,常在睡眠時加重,可伴隨有間歇性血紅蛋白尿、全血細胞減少和反復血栓形成等癥狀。傳統方法可通過糖水試驗、酸溶血實驗(Ham)診斷[1],但敏感性、特異性較差。近年來研究發現,在正常細胞的膜表面均有多種GPI錨蛋白,主要為補體調節蛋白C3轉化酶衰變加速因子(DFA,CD55)和反應性溶血膜抑制物(MIRL,CD59),這兩種蛋白能夠保護紅細胞免于補體介導的溶血。因此,CD55及CD59這兩種蛋白質的缺失將直接導致血管內溶血及血紅蛋白尿[2]。PNH患者的多數臨床表現均可歸結于受累細胞表面該類蛋白的缺失[3]。因此,通過檢測細胞表面CD55、CD59的缺乏可作為診斷PNH最直接的證據。但有文獻報導健康人及常見的其他貧血性疾病也存在不同程度的表達下降[4],鑒于此,筆者對我院79例各種貧血患者進行CD55、CD59免疫表型觀察研究,探討PNH診斷的敏感指標,現報告如下。
1 對象與方法
1.1對象收集2011年8月-2014年10月門診、住院病人79例,其中男31例,女48例,年齡14~86歲,平均42歲。各種貧血診斷均參照《血液病診斷及療效標準》[4];正常對照選擇醫院健康體檢者30例,其中男18例,女12例,年齡18~49歲,平均37歲,均無貧血史。
1.2方法
1.2.1主要設備和試劑BD公司FACSCalibur流式細胞儀;FITC標記的CD59單克隆抗體,PE標記的CD55單克隆抗體及相應的同型對照IgG2a和溶血素均購自美國BD公司。
1.2.2標本采集和處理采集晨起空腹靜脈血2mL,用EDTA-K2抗凝,采血后6h內檢測。
1.2.3標本檢測
1.2.3.1紅細胞標記方法設樣品管和對照管,樣品管中分別加入CD55-PE和CD59-FITC各20μl,對照管中分別加入IgG2a-PE和IgG2a-FITC 各20μl。每管中加入全血20μl,充分混勻,室溫下避光孵育30min。加入0.5mlPBS緩沖液,避光待測。流式細胞儀分析應用Cell Quest軟件,在FSCSSC散點圖上選定紅細胞群,設門圈出欲分析的細胞群體,計算紅細胞CD55和CD59的表達。
1.2.3.2粒細胞標記方法設樣品管和對照管,樣品管中加入CD55-PE、CD59-FITC和CD45-Percp 各20μl,對照管中加入IgG2a-PE、IgG2a-FITC和CD45-Percp各20μl。分別加入全血50μl,充分混勻,室溫下避光孵育30min。加入溶血素1ml,充分混勻,室溫下避光反應10min后1200r/min轉離心5min,棄上清,PBS洗滌2次后加入0.5mLPBS重懸細胞,避光待測。在CD45-SSC散點圖上選定粒細胞群,設門圈出欲分析的細胞群體,計算粒細胞上CD55和CD59的表達。
1.2.3.3 Ham試驗、糖水試驗和尿Rous試驗等溶血檢測指標,按照國內外統一溶血檢驗操作規程[5]。
1.2.3.4判斷標準以正常人紅細胞和粒細胞的CD55、CD59表達設定陰性閾值,CD55-、CD59-百分率小于5%認為正常,CD55-、CD59-的百分率大于5%認定為有PNH克隆[6-8]。
2 結果
2.1紅細胞和粒細胞CD55、CD59的表達率貧血患者及健康對照組外周血細胞CD55和CD59測定結果見表1。所有健康人中紅細胞和粒細胞的CD55-和CD59-百分率均小于5%;7例PNH患者紅細胞和粒細胞CD55-、CD59-的測定結果均大于5%;20例再生障礙性貧血(aplastic anemia,AA)患者中有2例AA患者紅細胞CD55-、CD59-測定結果大于5%;粒細胞CD55-、CD59-大于5%的有1例;33例缺鐵性貧血(iron deficiency anemia,IDA)患者中有2例患者紅細胞CD55-、CD59-測定結果大于5%,而粒細胞的結果全部正常;巨幼細胞性貧血(megaloblastic anemia,MA)和自身免疫溶血性貧血(autoimmune hemolytic anemia,AIHA)患者紅細胞和粒細胞CD55-、CD59-的測定結果均在正常范圍。
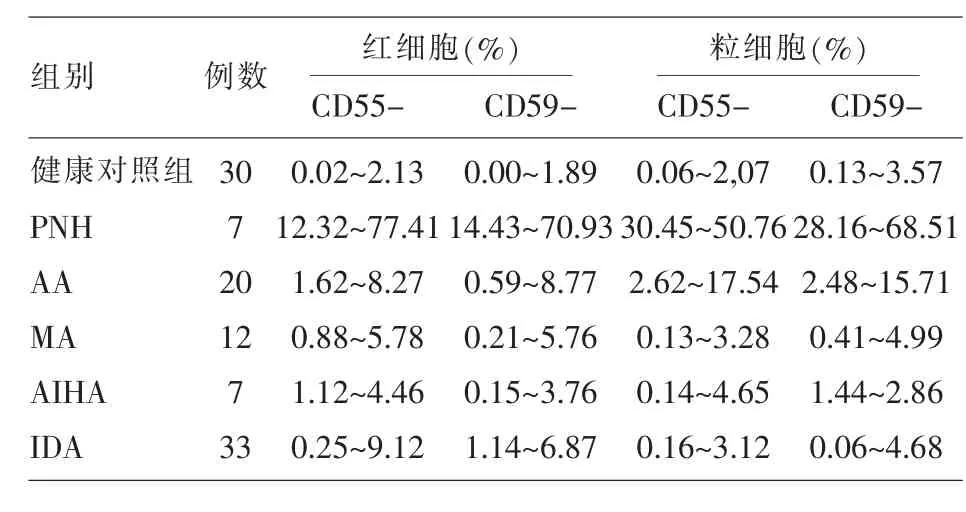
表1 健康對照組及貧血患者外周血CD55-和CD59-細胞檢測結果
2.2糖水試驗、Ham試驗、尿Rous試驗的結果比較糖水試驗、Ham試驗和尿Rous試驗的測定結果見表2。7例PNH病人糖水試驗全是陽性;酸溶血試驗2例陰性;尿Rous試驗1例陰性。20例AA患者中有6例糖水試驗陽性;Ham試驗和尿Rous試驗均是陰性。其余病人糖水試驗、Ham試驗、尿Rous試驗均陰性。
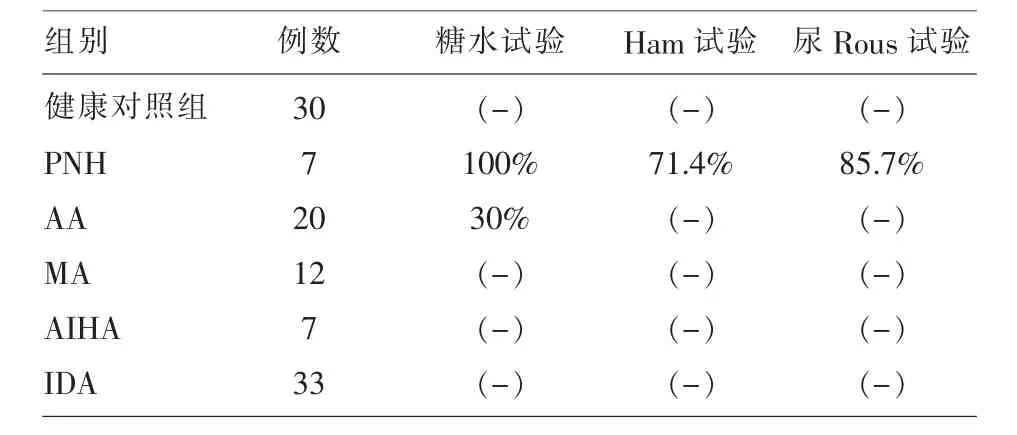
表2 健康對照組和貧血患者其他檢測指標比較
3 討論
PNH是一種獲得性造血干細胞克隆缺陷性疾病,病變細胞X染色體上PIG-A基因發生突變,引起糖基磷脂酰肌醇錨合障礙,導致GPI錨鏈蛋白(GPI-AP)表達減少或者缺失,使得異常細胞對補體敏感而被破壞,出現持續性血管內溶血[9]。而傳統診斷PNH的方法有賴于一系列特殊的溶血試驗檢測,糖水試驗試驗敏感性高,但特異性差,只能用于初步篩查;Ham試驗特異性高,但敏感性差,PNH患者中陽性率只有60%~80%[10],是否陽性取決于PNH患者對補體敏感的異常紅細胞數量,只有PNH患者外周血受累紅細胞數量達到一定比例才有可能陽性。近年來應用流式細胞術檢測CD55、CD59抗體標記已成為臨床診斷PNH的一個新的特異手段。其具有敏感性高,特異性強、結果準確、重復性高等特點,結合特異性單抗,可同時檢測細胞表面兩種主要GPI錨定蛋白的缺失,并能發現少量PNH克隆,有報道稱應用流式細胞術可檢測出僅占3%的異常細胞存在[11]。因此,通過檢測細胞表面CD55、CD59的缺乏可以作為診斷PNH最直接的證據。
目前已經證實PNH克隆可累及幾乎所有的血細胞[12],不同系列細胞表面的CD55、CD59缺乏或減少的程度不一,其累及造血細胞次序為粒細胞、單核細胞、紅細胞、淋巴細胞[13]。有報導指出PNH患者出現嚴重溶血,剛剛接受輸血治療或正處于恢復期時。因為紅細胞壽命較長,異常細胞被破壞和正常細胞增多會導致異常細胞相對減少,因此若只檢測紅細胞的CD55-、CD59-可能出現假陰性[14]。本實驗結果表明,所有健康人紅細胞和粒細胞CD55-、CD59-的百分比均小于5%;7例PNH患者中,Ham試驗2例陰性,尿Rous試驗1例陰性,而其紅細胞和粒細胞CD55-、CD59-的百分比均大于5%,存在PNH克隆,檢出率為100%。這說明CD55、CD59檢測的敏感性要明顯優于Ham試驗、尿Rous試驗,提示CD55-和CD59檢測可以用于PNH早期診斷及鑒別診斷;另外,糖水試驗中除了7例PNH患者陽性外,我們發現有6例AA患者也被檢測出陽性,容易出現假陽性而做出誤診,而20例AA患者中除一位患者紅細胞和粒細胞CD55-、CD59-的百分比均大于5%,小于10%外,均沒有檢測出PNH克隆,這說明CD55、CD59檢測的特異性要好于糖水試驗。我們后期跟蹤發現這位AA患者最終轉化為PNH,證實了AA和 PNH關系密切,部分AA患者可以轉化為PNH[15]。同時我們在2例IDA患者紅細胞上也檢測出了少量PNH克隆,其程度比PNH患者輕,而粒細胞正常,其機制目前尚不清楚。
綜上所述,利用流式細胞術同時檢測外周血中紅細胞和粒細胞CD55和CD59的表達對PNH的診斷具有無可比擬的優勢,利于PNH的早期發現,是目前診斷PNH最敏感的方法。
參考文獻
[1]肖作森,余路虎,李志紅,等.簡易“PNH三項”檢查對貧血類型鑒別的應用[J].實驗與檢驗醫學,2013,31(1):69-71
[2]Okuda K,Kanamaru A,Ueda E. Membrane expression of decay-accelerating factor on neutrophils from normal individuals and patients with paroxysmal nocturnal hemoglobinuria [J]. Blood,1990,75(5):1186-1191.
[3]曹文俊,王枕亞,石厚榮,等. CD55/CD59缺陷檢測及其在陣發性睡眠性血紅蛋白尿診斷中的意義[J].診斷學理論與實踐,2004,3(6):416-419.
[4]魯家才,黃瑩,莫揚.貧血患者外周血CD55-和CD59-細胞檢測結果及其意義[J].細胞與分子免疫學雜志,2014,30(4):424-425. [5]王永才.血液骨髓細胞檢驗診斷學[M].大連:大連出版社,1995. 2-10.
[6]呂照江,張立南,李達.從再生障礙性貧血患者檢出陣發性血紅蛋白尿癥異常細胞的觀察[J].中華血液學雜志,1997,18(10):521-524.
[7]Hall SE,Rosse WF. The use of monoclonal antibodies and flow cytometry in the diagnosis of paroxysmal nocturnal hemoglobinuria[J]. Blood,1996,87(12):5332-5340.
[8]朱明清,耿美菊,陳黎,等. CD55、CD59檢測陣發性睡眠性血紅蛋白尿癥標準方法建立[J].中國血液流變學雜志,2006,16(3):447-448.
[9]Rachidi S,Musallam KM,Taher AT. A closer look at paroxysmal nocturnal hemoglobinuria [J]. Eur J Inter Med,2010,14 (4):260-267.
[10]黎緯明,李菁媛,鄒萍.干細胞缺陷性疾病患者兩種GPI-錨蛋白表達及臨床意義[J].中國臨床醫學,2007,14(4):606-608.
[11]Hillmen P,Lewis SM,Bessler M. Natural history of paroxysmal nocturnal hemoglobinuria[J]. N EngI J Med,1995,333(19):1253-1258.
[12]劉淑媛,萬臘根,聞芳,等. FLAER檢測及其在陣發性睡眠性血紅蛋白尿癥診斷中的意義[J].實驗與檢驗醫學,2015,33(1):4-6. [13]金冬巖,陸春偉,佟海俠,等.流式細胞術檢測貧血患者血細胞CD55和CD59的及臨床意義[J].中國醫學工程,2011,19(6):161-162.
[14]Pieeras J,Lopez KX. Flow cytometric analysis of glyeosylphosphatidylinositol-anchored proteins to assess paroxysmal nocturnal hemoglobinuria clone size[J]. Cytometry,2000,42(2):234-238.
[15]鐘瓊,馬麗. GPI錨定蛋白抗體CD55、CD59及RET在貧血診斷中的意義探討[J].中國實驗診斷學,2009,13(11):1566-1569.
·實驗研究·
The application of CD55 and CD59 expression in the diagnosis of paroxysmal nocturnal hemoglobinuria syndrome
WU Qiong,WANG Xiaozhong. Department of Clinical Laboratory,the Second Affiliated Hospital of Nanchang University,Nanchang 330006,China.
Abstract:Objective To study on the application of CD55 and CD59 expression detected by flow cytometry in the diagnosis of paroxysmal nocturnal hemoglobinuria syndrome (PNH). Methods Flow cytometry was used to detect the expression of the peripheral erythrocytes and granulocytes surface antigen CD55,CD59 in anemia patients and healthy control group,and at the same time doing Ham test,sugar intake test and urine Rous test were done. Results The expression of the erythrocytes and granulocytes surface antigen CD55,CD59 in healthy control group were less than 5%. Seven PHN patients’expression of the erythrocytes and granulocytes surface antigen CD55,CD59 were more than 5%. Two of the twenty AA patients’expression of the erythrocytes surface antigen CD55,CD59 was more than 5%,and only one of them the expression of the erythrocytes and granulocytes surface antigen CD55,CD59 were all more than 5%. Part of the IDA patients’expression of the erythrocytes surface antigen CD55,CD59 were more than 5%,while the expression of the granulocytes is normal. MA and AIHA patients’expression of CD55,CD59 were normal. In the seven PHN patients,two of them Ham test were negative,one of them urine rous test was negative,but all of them the the expression of the erythrocytes and granulocytes surface antigen CD55,CD59 were more than 5%. Conclusion Using flow cytometry to detect the expression of the peripheral erythrocytes and granulocytes surface antigen CD55,CD59 has unexampled advantages in the diagnosis of PNH,and it has been helpful and the most sensitive method to the early detection of PNH.
Key words:PNH;CD55;CD59;Flow cytometry
(收稿日期2015-12-09;修回日期2016-02-03)
通信作者:王小中,男,1973年12月生,博士,研究生導師,主任技師,教授,研究方向:主要從事臨床檢驗診斷學。
基金項目:江西省自然科學基金項目,項目編號:2014ZBAB205010
作者簡介:吳瓊,女,1984年6月生,碩士學位,主管技師,研究方向:流式細胞術。
DOI:10.3969/j.issn.1674-1129.2016.02.006
中圖分類號:R556.6+4,R446.62
文獻標識碼:A
文章編號:1674-1129(2016)02-0146-03

