高考復習中結構不良氧化還原反應方程式書寫的策略探討
陶杰 李遠蓉
摘要:在分析結構不良氧化還原反應方程式書寫障礙的基礎上,運用分解策略將結構不良氧化還原反應方程式分為兩個“電極反應”,分別配平后根據得失電子守恒將兩個“半反應”合起來得到完整的反應方程式。將電子守恒的配平放在最后一步,克服了“化合價升降法”的缺點,也為氧化還原反應與電化學的融合復習提供借鑒。
關鍵詞:學習情景;探究式學習;原則;方法
文章編號:1008-0546(2016)06-0011-03 中圖分類號:G633.8 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2016.06.003
Reitman(1965)首次從認知心理學的角度區分了結構良好問題和結構不良問題,前者是初始狀態、目標狀態和算子都很明確的問題,而后者則是上述三者至少有一個沒有明確界定的問題[1]。學生在化學課堂上遇到的常常是具有預設性的結構良好問題,而現實生活中客觀存在的卻大多是結構不良問題。這種由模擬與實際之間的差異性鑄成的壁壘阻礙了學生知識與能力之間的相互轉化,將學生的課堂知識與實際生活無形地割裂開來。可喜的是隨著課改的深入,結構不良問題在化學教學中得到了應有的重視,最直接的體現就是高考化學越來越趨向于對結構不良問題解決能力的考查。氧化還原反應屬于高中化學重要的知識,其與生活實際的密切聯系為其以結構不良問題的形式出現于高考信息題中奠定了基礎,這對學生知識與能力間的轉換機制提出了新挑戰。
一、 結構不良氧化還原反應方程式書寫的障礙分析
結構不良氧化還原反應方程式的書寫應遵循結構不良問題的解決過程,即問題框架表征、問題解決、監控與評價等,該過程涉及到認知、元認知、非認知變量、辯護能力等成分。基于題目線索,學生對問題框架的表征和監控評價通常不存在缺失,但在問題解決階段存在著不同程度的障礙,仔細分析學生的錯誤,將障礙確定為如下幾點:
1. 出現子問題再表征障礙,反應物或產物判斷不全
在對問題框架進行表征及確定問題空間之后,需根據元素守恒、電荷守恒、質量守恒等原則初步判斷出氧化還原反應的反應物和產物。但由于一些反應物或產物(通常為H2O、OH-、H+、O2等)具有模糊性而使學生出現子問題的再表征障礙。而運用氧化還原反應理論對所給的信息進行精細加工是障礙突破成為可能的必要條件之一。遺憾的是受認知成分中氧化還原反應具體知識結構化程度較低等因素的影響,學生無法通過類比已有的結構良好問題解決圖式對子問題信息進行精細加工,從而無法生成解決結構不良問題的新圖式,最終表現為由于反應物或產物判斷不全而無法書寫方程式。
例如,(2013重慶,11) 化學在環境保護中有著十分重要的作用,催化反硝化法和電化學降解法可用于治理水中硝酸鹽的污染。
(1) 催化反硝化法中,H2能將NO3-還原為N2,25℃時,反應進行10min,溶液的pH由7變為12。
②上述反應離子方程式為 。
本問題只給出了主要反應物和產物,屬于典型的結構不良問題。學生對本問題框架的表征較為順暢,根據信息和元素守恒也較容易寫出主要反應物和產物,得出離子方程式基本框架:H2+NO3-—N2+OH-,但學生根據化合價升降等常規配平方法進行配平時發現無法配平,使得本題無法解答,原因在于從表面上看,該框架中反應物與產物元素已經守恒,無法再表征出隱含的產物H2O。
2. 知識結構較零散,容易忽視溶液環境對反應的影響
對于水溶液體系中的氧化還原反應而言,溶液環境對其影響可謂是首當其沖的。但在解決結構不良氧化還原反應問題時,學生容易顧此失彼,忽視溶液環境對氧化還原反應的影響,從而導致出錯。這也許與平時教學中教師忽視分析環境對物質化學性質也有較大的影響有關。
例如,1.1例子中學生發現無法配平之后,開始尋求另一做法,將離子反應基本框架改為H2+H++NO3- —N2+H2O,配平后將離子方程式確定為:2H2+2H++ 2NO3-N2↑+3H2O,由于學生知識結構呈現出零散狀態,只能以能否配平作為衡量方程式書寫正確與否的標準,從而忽視本題溶液體系為中性,沒有可直接參與反應的游離H+,導致本問題無法正確解決。
3. 對氧化還原反應理論的認知水平較低,無法配平方程式
研究發現只有當學生氧化還原反應理論達到理解和應用水平時,才能促進其對復雜化學方程式的學習[2]。結構不良氧化還原反應方程式屬于“三重表征”中的符號表征,其書寫理應建立在對氧化還原反應客觀事實(宏觀表征)和微觀過程(微觀表征)的本質學習基礎之上。然而學生由于對氧化還原反應理論的認知水平較低,不能促進其對結構不良反應方程式的學習,進而不能將結構不良氧化還原反應方程式與其對應的微觀過程和現象聯系起來,最終無法配平系數較大的方程式。
二、分解策略在結構不良氧化還原反應方程式書寫中的運用
認知靈活理論將學習劃分為初級學習和高級學習,前者針對的是結構良好領域的知識,后者針對結構不良知識[3]。高級學習需要高級思維的參與,分解策略在其中起著舉足輕重的作用。原電池是根據氧化還原反應設計而成的裝置,因此氧化還原反應方程式的書寫可借鑒電極反應的書寫方式。先根據元素守恒、電荷守恒、質量守恒將反應分為兩個電極反應且配平后,再根據電子得失守恒,將電極反應合起來即得到總反應。下面結合例子談談如何運用分解策略將結構不良氧化還原反應分解為兩個電極反應,最終合成完整方程式。
1. 酸性環境中
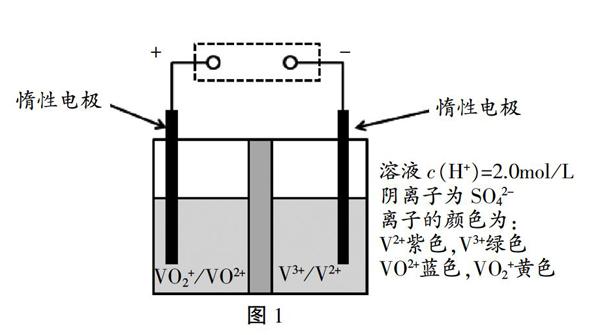
例1.(2010重慶高考)釩(V)及其化合物廣泛應用于工業催化、新材料和新能源等領域。全釩液流儲能電池是利用不同價態離子對氧化還原反應來實現化學能和電能相互轉化的裝置,其原理如圖1所示。
當左槽溶液逐漸由黃變藍時,其電極反應式為
。
分析:該問題只給出了主要反應物和生成物,屬于常見的結構不良問題。
典型的解法 [4]是先將反應方程式框架確定為:VO2+-VO2+,再分析出V元素化合價由+5價變為+4價,得到1個電子,在反應式的左邊加上1個電子得:VO2++e—VO2+。常規的電極反應多屬于“化合物或單質生成離子”型,所以到這一步后,只要根據溶液的酸堿性在缺電子或多電子的一端補上OH-或H+以平衡電荷,最后根據元素守恒在另一端加上H2O來平衡之前加的H+或OH-即可(氧元素會由于H2O的加入而自動平衡)。但本題屬于“離子生成離子”型,學生按這種方法寫出VO2++e—VO2+后,會由于電荷已經守恒而無法進行“加H+或OH-來平衡電荷”這一步,導致學生思維混亂。即使學生識別出需要在右邊加一個H2O來平衡氧元素,但由于同時右邊會多出2個H元素,需要再重新配平,過程較為復雜,不利于問題的解決。
策略:
第1步,寫出反應式主要框架,配平所有除氧、氫元素以外的其他元素:
VO2+—VO2+
第2步,無論酸性還是堿性環境都在少氧的一端加H2O去平衡,得:
VO2+—VO2+ + H2O
第3步,由于H2O的加入使得左邊少2個H元素,且溶液為酸性環境,有可參加反應的游離H+,因此只需在左端加2個H+去平衡便可,得:
2H++VO2+—VO2++H2O
第4步,根據電荷守恒在左邊加上2個電子即可:2H++VO2++eVO2++H2O
第5步,根據元素守恒進行檢驗。
例2.(2013蘇北三市(徐州、淮安、宿遷)調研,18(2))已知:黃鐵礦(FeS2)中的硫元素在酸性條件下被ClO3-氧化成SO42-,寫出制備二氧化氯的離子方程式:
分析:本題依舊屬于結構不良問題,通常學生的做法是根據信息及元素守恒確定出方程式基本框架:FeS2+ClO3-—SO42-+Fe3++ClO2,由于從元素守恒看生成物基本包含了反應物的所有元素,所以到此有學生就已經開始試著運用化合價升降法對反應框架進行配平。出現配平障礙后,學生考慮到溶液顯酸性,可能H+也參與了反應,就把H+加在反應物一邊,同時也在右邊加上了H2O以平衡H元素,使得框架變成:H++ FeS2+ClO3-—SO42-+Fe3++ClO2+H2O。學生又開始用化合價升降法配平,但由于系數太大,耗時較久甚至無法得出答案。
策略:
第1步,將氧化反應和還原反應獨立開來,把除氫、氧元素外的其他元素配平,得:
氧化反應:FeS2—2SO42-+Fe3+,
還原反應:ClO3-— ClO2。
第2步,在少氧的一端加H2O平衡,氧化反應的左端少了8個氧,加8個H2O;還原反應的右端少1個氧,加1個H2O,得:
氧化反應:FeS2+8H2O— 2SO42-+Fe3+,
還原反應:ClO3-—ClO2+H2O。
第3步,該反應處于酸性環境中,因此有可參與反應的游離H+。所以在氧化反應的右端加16個H+,還原反應左端加2個H+,得:
氧化反應:FeS2+8H2O—2SO42-+Fe3++16H+ ,
還原反應:2H++ClO3-—ClO2+H2O。
第4步,氧化反應右端缺了15個電子,加15個電子;還原反應右端缺了1個電子,加1個電子,得:
氧化反應:FeS2+8H2O—2SO42-+Fe3++16H++15e,
還原反應:2H++ClO3-+e —ClO2+H2O。
第5步,氧化、還原反應得失電子數目要相等,所以氧化反應乘以系數1,還原反應乘以系數15,得:
氧化反應:FeS2+8H2O—2SO42-+Fe3++16H++15e,
還原反應:30H++15ClO3-+15e —15ClO2+15H2O。
第6步,二者相加得到總反應方程式,將“同類項”合并,得:
FeS2+14H++15ClO3-2SO42-+Fe3++15ClO2↑+7H2O。
2.中性、堿性環境中
中性、堿性環境與酸性環境不同之處在于前兩者只能靠H2O來提供反應所需的H+,而H2O是弱電解質,在離子反應中不可拆,這將會導致方程式附加上相應數目的OH-。為了平衡要在另一端加上多余的OH-;而中性與堿性環境不同點在于產物中若有H+生成,中性環境里H+可以游離地存在,而堿性環境中只能與OH-反應生成H2O。
例3.(2013重慶,11)化學在環境保護中起著十分重要的作用,催化反硝化法和電化學降解法可用于治理水中硝酸鹽的污染。
(1) 催化反硝化法中,H2能將NO3-還原為N2,25℃時,反應進行10min,溶液的pH由7變為12。
②上述反應離子方程式為 。
策略:
第1步,將氧化反應和還原反應獨立開來,把除氫、氧元素外的其他元素配平,得:
氧化反應:H2 —, 還原反應:2NO3- —N2 。
第2步,氧化反應的右端少2個H原子,中性環境H+可以游離存在,所以右邊加2個H+;還原反應右端少6個O原子,加6個H2O,得:
氧化反應:H2—2H+,
還原反應:2NO3-—N2+ 6H2O。
第3步,根據pH可得出,溶液起初為中性,因此還原反應左邊少的12個H,只能由12個H2O提供,同時在右端加上多余的12個OH-,這剛好符合了溶液pH隨著反應的進行而增加的事實,得:
氧化反應:H2—2H+,
還原反應:12H2O + 2NO3- —N2+6H2O+12OH- 。
第4步,氧化反應的右端加2個電子,還原反應的左端加10個電子,合并“同類項”,得:
氧化反應:H2—2H++2e,
還原反應:6H2O+2NO3-+ 10e —N2+12OH-。
第5步,根據得失電子守恒,氧化反應乘以系數5,得:
氧化反應:5H2—10H++10e ,
還原反應:6H2O+2NO3-+10e —N2+12OH-。
第6步,二者相加,消除電子,合并“同類項”得總反應(生成的H+要與生成的OH-結合),得:5H2+ 2NO3-N2+4H2O+2OH-。
例4.(2012新課標全國卷26 (4))FeCl3和 KClO 在強堿性條件下反應可制取 K2FeO4,其反應的離子方程式為 。
策略:
第1步,將氧化反應和還原反應獨立開來,把除氫、氧元素外的其他元素配平,得:
氧化反應:Fe3+—FeO42- ,
還原反應:ClO- — Cl- 。
第2步,氧化反應右端加4個H2O平衡氧,還原反應的右端加1個H2O平衡氧,得:
氧化反應: 4H2O+Fe3+—FeO42-,
還原反應:ClO-— Cl-+ H2O。
第3步,氧化反應右邊少了8個H+,若是中性、酸性環境,則生成8個H+即可,但堿性環境H+不能共存,應該結合OH-成為8個H2O,把附加的8個OH-補在左邊,合并“同類項”;同理還原反應的左邊加上2個H2O后,再在右邊補上附加的2個OH-,得:
氧化反應:8OH-+Fe3+—FeO42-+4H2O,
還原反應:H2O+ClO-—Cl-+2OH-。
第4步,氧化反應右端加3個電子,還原反應左端加2個電子,得:
氧化反應:8OH-+Fe3++3e—FeO42-+4H2O,
還原反應:H2O+ClO-+2e—Cl-+2OH-。
第5步,電子得失守恒,氧化反應乘以系數2,還原反應乘以系數3,二式相加,合并“同類項”,得
10OH-+2Fe3++3ClO-2FeO42-+5H2O+3Cl-。
三、結語
學生對結構良好方程式的單純記憶,并不能促進學生有效地生成解決結構不良氧化還原反應問題的圖式,因為結構不良問題的解決需要學生高級思維的參與,需要學生有較高的氧化還原反應理論認知水平。在氧化還原反應理論與電化學嚴重分離的中學階段,采用分解策略,靈活運用化學方程式書寫的三原則將氧化還原反應方程式與電極反應式的書寫結合起來,無疑是將知識抽象成氧化還原反應大概念或將氧化還原反應理論科學本質明細化的良方。
參考文獻
[1] 李同吉,吳慶麟.論解決結構不良問題的能力及其培養[J]. 華東師范大學學報(教育科學版),2006,24(1):63
[2] 姬廣敏,畢華林.高中生氧化還原反應理論認知水平對其化學方程式學習影響的研究[J].化學教育,2012,(12):35
[3] 宋婷.基于認知靈活理論的高中化學概念教學策略研究[D].重慶:西南大學,2014:7
[4] 經志俊.新課程實踐中“氧化還原反應方程式配平”的教學策略[J].化學教學,2013,(4):39-41

