高膽固醇對小鼠原代成骨細胞Akt/NF-κB信號通路的影響
鄧莉,宋丹
(湖北省丹江口市第一醫院檢驗科,湖北丹江口442700)
?
高膽固醇對小鼠原代成骨細胞Akt/NF-κB信號通路的影響
鄧莉,宋丹
(湖北省丹江口市第一醫院檢驗科,湖北丹江口442700)
摘要:目的觀察高膽固醇對原代成骨細胞Akt/NF-κB信號通路的影響。方法將小鼠原代成骨細胞按1×105接種于6孔板上,待細胞融合至80%左右,分別加入0μg/ml、12.5μg/ml、25μg/ml和50μg/ml的膽固醇溶液培養基繼續培養24 h。采用蛋白質免疫印跡法(Western blot)的方法,檢測成骨細胞核轉錄因子kappa B (NF-κB)和蛋白激酶B(Akt)的蛋白表達;采用實時熒光定量PCR方法,檢測成骨細胞中人白細胞介素1α (IL-1α)、人白細胞介素6(IL-6)和腫瘤壞死因子α(TNF-α)的信使RNA(mRNA)表達;采用酶聯免疫吸附法,檢測細胞培養上清中IL-1α、IL-6和TNF-α的蛋白水平。結果膽固醇誘導成骨細胞中NF-κB的增加和Akt磷酸化水平降低,增加IL-1α、IL-6與TNF-α的mRNA和蛋白表達,且呈一定的劑量依賴性。結論高膽固醇可以通過Akt/NF-κB信號通路及其介導的炎癥因子表達參與成骨細胞的調節。
關鍵詞:成骨細胞;NF-κB;Akt;膽固醇
膽固醇水平與骨質疏松直接相關[1-3],高膽固醇血癥增加骨吸收、降低骨形成[4]。高膽固醇與原發性骨質疏松有一定關系,如對絕經期、老年性原發骨質疏松患者激素替代治療可以減少骨質流失,提高骨密度,同時可見膽固醇降低[5-7]。高膽固醇對繼發性性骨質疏松也有一定的作用,如糖皮質激素導致的股骨頭壞死可見膽固醇升高[8],膽固醇升高還可作為前列腺癌骨轉移的臨床指標[9]。膽固醇及其代謝產物可以抑制成骨細胞活性、降低骨鹽沉積最終導致骨質疏松[10-11]。他汀類藥物可降低血清膽固醇,刺激骨形成、減少骨流失,與骨形態發生蛋白2基因(bone morphogenetic protein 2,BMP2基因)表達增加有關,適當劑量的他汀類藥物可用于治療骨質疏松[12]。成骨細胞對骨組織的生長發育、骨代謝平衡、骨量平衡和骨損傷修復有著關鍵作用。因此,在高膽固醇血癥導致骨質疏松病理生理過程中,其對成骨細胞的影響起著重要作用。本實驗利用原代成骨細胞體外培養觀察高膽固醇對Akt/NF-κB信號通路的影響從而探討高膽固醇誘導骨質疏松發生的作用和可能的分子機制。
1 材料與方法
1.1一般材料
C57BL/6小鼠購自重慶醫科大學實驗動物中心。DMEM培養基、胎牛血清(fetal bovine serum,FBS)均購自美國Gibico公司,RNA提取試劑Trizol和熒光試劑SYBR Premix Ex TaqTMⅡ均購自日本TaKaRa公司,蛋白提取試劑RIPA、PMSF、NaF、Na3VO4和BCA蛋白測定試劑均購自上海碧云天生物技術有限公司,NF-κB抗體購自美國Abcam公司,蛋白激酶B(protein kinase B,Akt)及p-Akt抗體均購自美國CST公司,β-actin抗體、HRP標記二抗購自北京中杉金橋生物技術有限公司。IL-1α、IL-6和TNF-α酶聯免疫試劑盒購自晶美生物工程有限公司。
1.2方法
1.2.1小鼠成骨細胞的培養及鑒定取20只出生24 h內的小鼠,引頸處死,75%酒精浸泡10 min。無菌的條件下取出顱蓋骨浸泡在D-Hanks液中。分別剪成0.1 mm×0.1 mm×0.1 mm的組織塊,加入10 ml 0.25%的胰蛋白溶液,37℃孵育30 min。1 000 r/min離心5 min,棄上清液。加入0.2%膠原酶10 ml,37℃孵育2 h,每5 min震蕩1次。1 000 r/min離心5 min,棄上清。用DMEM培養基沖洗3次。200目濾網過濾去除骨碎片。收獲細胞以完全培養基(含10%胎牛血清、100 u/ml青霉素、100μg/ml鏈霉素的DMEM培養液)重懸,吹打均勻,接種至多個25 cm2培養瓶。放入37℃,5%二氧化碳CO2培養箱培養。每48h換液1次,細胞融合成單層至80%以上時,0.25%胰酶消化制成細胞懸液,采用差速貼壁法進行成骨細胞純化。倒置相差顯微鏡觀察細胞形態變化,堿性磷酸酶活性檢測鑒定成骨細胞。
1.2.2細胞處理分組實驗中細胞主要按照以下分組進行處理,收集第4代細胞進行實驗,將原代成骨細胞按1×105接種于6孔板上。將膽固醇溶于乙醇溶液,待細胞生長至80%融合狀態時加入不同濃度的膽固醇溶液,膽固醇終濃度為0μg/ml,12.5μg/ml,25μg/ml,50μg/ml,乙醇濃度為0.25%,對照組為只含有10%FBS的DMEM培養基。
1.2.3實時熒光定量PCR(quantitative real-time PCR,RT-PCR)細胞按上述分組進行處理,用不同濃度膽固醇溶液培養基培養24 h,離心管收集培養上清液備用,用預冷的PBS洗滌細胞兩次,用Trizol法提取原代成骨細細胞總RNA,逆轉錄合成cDNA。采用RT-PCR檢測目的基因,用2-ΔΔCt值計算目的基因的相對表達量。其中人白細胞介素6 (interleukin 6,IL-6)基因引物正向序列:5'-GAAATC GTGGAAATGAG-3';反向:5'-TAGGTTTGCCGAGTA GA-3'。腫瘤壞死因子(tumor necrosis factor α,TNF-α)基因正向引物:5'-CTGTGAAGGGAATGGGTGTT -3';反向:5'-CAGGGAAGAATCTGGAAAGGTC-3'。人白細胞介素1α(interleukin 1α,IL-1α)基因引物正向序列:5'-CTCTAGAGCACCATGCTACAG-3';反向:5'-TTGGAATCCAGGGGAAACACT-3'。內參β-actin基因引物正向序列:5'-GCTGTCCCTGTATG CCTCT-3';反向:5'-GATGTCACGCACGATTTCC-3'。
1.2.4酶聯免疫分析(Elisa)采用酶聯免疫試劑盒,按試劑說明進行檢測,酶標儀測定450 nm波長處光密度(optical density,OD)值,以標準品濃度和OD值作標準曲線,樣品濃度根據標準曲線得出。
1.2.5蛋白質免疫印跡分析(Western blot)提取原代成骨細胞蛋白并用BCA法測定蛋白濃度。取60μg蛋白上樣,SDS-PAGE電泳分離蛋白后轉膜到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脫脂牛奶室溫封閉1 h,一抗4℃孵育過夜,TBST 洗3次,HRP標記的二抗室溫孵育1 h,TBST洗3次后加ECL試劑反應,顯像、成像。用目的條帶與β-actin的灰度值比較表示目的蛋白的相對表達量。
1.3統計學方法
采用SPSS 19.0統計軟件進行數據分析,計量資料用均數±標準差(±s)表示,組間比較用單因素ANOVA分析,用LSD-t檢驗或SNK-q檢驗進行兩兩比較,P<0.05為差異有統計學意義。
2 結果
2.1膽固醇對成骨細胞IL-1α、IL-6和TNF-α mRNA表達的影響
按上述方法分離小鼠原代成骨細胞進行堿性磷酸酶活性檢測鑒定,可見大量染色陽性細胞,細胞膜及細胞漿內顆粒染色呈藍黑色顆粒,鑒定結果見圖1。成功分離的成骨細胞接種6孔板,并用不同濃度的膽固醇刺激成骨細胞24 h,實時熒光定量PCR測定IL-1α、IL-6和TNF-α mRNA表達。0μg/ml組與對照組比較各炎癥因子的表達基本無變化,說明酒精溶酶基本不影響本實驗中炎癥因子的表達。不同濃度膽固醇顯著誘導IL-1α、IL-6及TNF-α 的mRNA水平,且呈現一定的劑量依賴性,見圖2。本結果提示在成骨細胞中膽固醇與炎癥因子IL-1α、IL-6和TNF-α的mRNA水平呈正相關。

圖1 成骨細胞第2代堿性磷酸酶染色(×400)

圖2 不同濃度的膽固醇對成骨細胞IL-1α、IL-6和TNF-α mRNA的影響
2.2膽固醇對成骨細胞IL-1α、IL-6和TNF-α分泌水平的影響
如附表所示,不同濃度的膽固醇刺激成骨細胞24 h后,酶聯免疫吸附法測定細胞培養液上清中分泌IL-1α、IL-6和TNF-α的水平變化。0μg/ml組與對照組比較,IL-1α、IL-6及TNF-α均無明顯變化;12.5μg/ml、25μg/ml和50μg/ml組均能顯著誘導IL-1α、IL-6及TNF-α的水平。說明膽固醇可以促進IL-1α、IL-6和TNF-α的分泌,且IL-6的分泌與膽固醇濃度呈正相關。
2.3膽固醇對成骨細胞Akt和NF-κB信號通路的影響
如圖3A與3B所示,膽固醇刺激成骨細胞后Western blot測定不同處理組蛋白變化,與對照組比較,12.5μg/ml、25μg/ml和50μg/ml 3組中NF-κB水平均顯著增加(P<0.01),而p-Akt水平顯著降低(P<0.01)。提示:成骨細胞中膽固醇濃度與NF-κB蛋白表達一定范圍內呈正相關(P<0.01),膽固醇濃度與成骨細胞Akt磷酸化水平一定范圍內呈負相關(P<0.01),統計結果見圖3C與3D。
附表 不同濃度的膽固醇對成骨細胞分泌IL-1α、IL-6 和TNF-α的影響(n=8,pg/ml,±s)
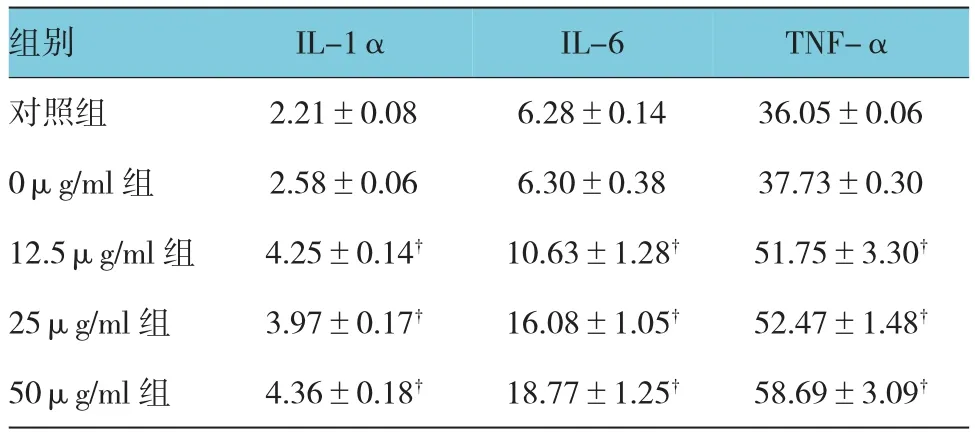
附表 不同濃度的膽固醇對成骨細胞分泌IL-1α、IL-6 和TNF-α的影響(n=8,pg/ml,±s)
注:?與對照組比較,P<0.01
組別 IL-1α IL-6 TNF-α對照組 2.21±0.08 6.28±0.14 36.05±0.06 0μg/ml組 2.58±0.06 6.30±0.38 37.73±0.30 12.5μg/ml組 4.25±0.14? 10.63±1.28? 51.75±3.30?25μg/ml組 3.97±0.17? 16.08±1.05? 52.47±1.48?50μg/ml組 4.36±0.18? 18.77±1.25? 58.69±3.09?

圖3 不同濃度膽固醇對成骨細胞Akt和NF-κB信號通路的影響
3 討論
Akt信號通路及靶基因對骨分化、骨形成和骨重建都有著關鍵調控作用。血漿網膜素-1 (omentin-1)和胰島素可以通過增加Akt的磷酸化水平,促進成骨細胞的增殖。敲除Akt1/Akt2的小鼠骨化延遲,敲除Akt2對BMP2沒有影響,但可通過對骨特異性轉錄因子(Runx2)基因的調控阻斷骨髓基質細胞或間充質干細胞向成骨細胞的分化[13]。Akt磷酸化可以抑制糖皮激素誘導的成骨細胞凋亡。NF-κB廣泛表達于多種組織細胞中,其激活后參與許多基因的轉錄調控,在免疫、炎癥、氧化應激、細胞增殖、細胞凋亡等生理病理過程中發揮重要調控作用。NF-κB與骨代謝密切相關,γ射線可導致NF-κB活化,促進成骨細胞凋亡。NF-κB p50激活后也可刺激成骨細胞和破骨細胞分泌集落刺激因子1(colony-stimulating factor 1,CSF-1),其在骨的重建中有著重要作用。TNF-α可以刺激成骨細胞NF-κB蛋白與其內源性抑制因子核因子抑制蛋白-κB(nuclean factor-kappa B,IκBα)的解離,短時間可見核周NF-κB蛋白濃度增加,并迅速入核調控目的基因,導致成骨細胞凋亡[14]。NF-κB的抑制劑PMMA可以有效阻斷間質細胞向成熟破骨細胞的分化[15],骨保護素(osteoclastogenesis inhibitory factor,OPG)與NF-κB配體核因子KB受體活化因子配體(receptor activator of nuclear factor-κB ligand,RANKL)結合使基質金屬蛋白酶9(matix metalloproteinase 9,MMP9)表達增高,阻斷破骨細胞的生成、抑制骨的再吸收。本研究結果顯示,膽固醇濃度與Akt的磷酸化水平負相關,與NF-κB的表達正相關,提示膽固醇可能通過NF-κB與Akt信號通路介導成骨細胞分化過程。
PI3K/Akt是調節NF-κB及下游基因表達的重要信號通路。過表達的胰島素受體底物1(insulin receptor 1,IRS1)可通過PI3K/Akt信號通路抑制NF-κB和其下游BAX基因(Bcl2-associated X protein,BAX)的表達促進成骨細胞增殖,且上述作用可以被PI3K的抑制劑LY294002所逆轉[16]。PI3K/Akt磷酸化后,激活NF-κB及其調控下游細胞因子和炎癥介質TNF-α、IL-1α及IL-6的釋放[17]。TNF-α、IL-1α、IL-6等炎癥介質的分泌可以促進炎癥反應,不僅對破骨細胞性骨吸收有明顯促進作用,而且還能影響成骨細胞性骨形成。TNF-α能夠抑制膠原合成、堿性磷酸酶(alkaline phosphatase,AKP)活性和骨鈣素合成,同時可以通過NF-κB途徑增加IL-6、IL-1α和ICAM1基因的表達從而增加骨質流失。IL-6在骨更新中有著重要作用,成骨細胞分泌的IL-6與多種細胞因子共同作用促進骨吸收和骨重建[18,19]。本研究觀察結果顯示,高膽固醇促進TNF-α、IL-1α與IL-6表達,而且表達水平與膽固醇濃度正相關,提示高膽固醇可能通過Akt/NF-κB信號通路促進炎癥反應,從而影響成骨細胞分化過程。
綜上所述,高膽固醇可能通過抑制Akt活性激活NF-κB信號通路,進一步誘導炎癥因子的釋放,從而影響成骨細胞分化,最終導致成骨細胞與破骨細胞的動態失衡而增加骨質疏松發病風險。
參考文獻:
[1]TRIMPOU P,ODéN A,SIMONSSON T,et al. High serum to-tal cholesterol is a long-term cause of osteoporotic fracture[J]. Osteoporosis International,2011,22(5):1615-1620.
[2]YOU L,SHENG Z Y,TANG C L,et al. High cholesterol diet increases osteoporosis risk via inhibiting bone formation in rats[J]. Acta Pharmacologica Sinica,2011,32(12):1498-1504.
[3]MAKOVEY J,CHEN JS,HAYWARD C,et al. Association between serum cholesterol and bone mineral density[J]. Bone,2009,44(2):208-213.
[4]MAJIMA T,SHIMATSU A,KOMATSU Y,et al. Increased bone turnover in patients with hypercholesterolemia[J]. Endocrine Journal,2008,55(1):143-151.
[5]LI M,WANG A,HU L,et al. Climacteric:the Journal of the International Menopause Society[J]. Climacteric,2015,18(2):214-218.
[6]MA Y L,BRYANT H U,ZENG Q,et al. Long-term dosing of arzoxifene lowers cholesterol,reduces bone turnover,and preserves bone quality in ovariectomized rats[J]. Journal of Bone and Mineral Research,2002,17(12):2256-2264.
[7]DELMAS P D,BJARNASON N H,MITLAK B H,et al. Effects of raloxifene on bone mineral density,serum cholesterol concentrations,and uterine endometrium in postmenopausal women[J]. Obstetrical & Gynecological Survey,1998,53(5):293-294.
[8]SANBE T,TOMOFUJI T,EKUNI D,et al. Oral administration of vitamin C prevents alveolar bone resorption induced by high dietary cholesterol in rats[J]. Journal of Periodontology,2007,78 (11):2165-2170.
[9]THYSELL E,SUROWIEC I,H?RNBERG E,et al. Metabolomic characterization of human prostate cancer bone metastases reveals increased levels of cholesterol[J]. PLoS One,2010,5(12):Doi:10.1371/journal.pone.0014175.
[10]PARHAMI F,TINTUT Y,BEAMER W G,et al. Atherogenic high-fat diet reduces bone mineralization in mice[J]. Journal of Bone and Mineral Research,2001,16(1):182-188.
[11]JEONG T D,LEE W,CHOI S E,et al. Relationship between serum total cholesterol level and serum biochemical bone turnover markers in healthy pre-and postmenopausal women[J]. Bio Med Research International,2014,2014:Doi:10.1155/2014/ 398397.
[12]MUNDY G,GARRETT R,HARRIS S,et al. Stimulation of bone formation in vitro and in rodents by statins[J]. Science,1999,286(5446):1946-1949.
[13]MUKHERJEE A,WILSON E M,ROTWEIN P. Selective signaling by Akt2 promotes bone morphogenetic protein 2-mediated osteoblast differentiation[J]. Molecular and Cellular Biology,2010,30(4):1018-1027.
[14]KITAJIMA I,SOEJIMA Y,TAKASAKI I,et al. Ceramide-induced nuclear translocation of NF-κB is a potential mediator of the apoptotic response to TNF-α in murine clonal osteoblasts[J]. Bone,1996,19(3):263-270.
[15]CLOHISY J C,HIRAYAMA T,FRAZIER E,et al. NF-kB signaling blockade abolishes implant particle-induced osteoclastogenesis[J]. Journal of Orthopaedic Research,2004,22(1):13-20.
[16]ZHANG W,SHEN X,WAN C,et al. Effects of insulin and insulin-like growth factor 1 on osteoblast proliferation and differentiation:differential signalling via Akt and ERK[J]. Cell Biochemistry and Function,2012,30(4):297-302.
[17]EHRHARDT C,LUDWIG S. A new player in a deadly game:influenza viruses and the PI3K/Akt signalling pathway[J]. Cellular Microbiology,2009,11(6):863-871.
[18]GIULIANI N,PEDRAZZONI M,PASSERI G,et al. Bisphosphonates inhibit IL-6 production by human osteoblast-like cells[J]. Scandinavian Journal of Rheumatology,1998,27(1):38-41.
[19]YOKOTA K,SATO K,MIYAZAKI T,et al. Combination of tumor necrosis factor-α and interleukin-6 induces mouse osteoclast-like cells with bone resorption activity both in vitro and in vivo[J]. Arthritis & Rheumatology,2014,66(1):121-129.
(張蕾編輯)
論著
Effects of high-level cholesterol on Akt/NF-κB signaling pathway of mouse primary osteoblasts
Li Deng,Dan Song
(Department of Laboratory,Danjiangkou First Hospital,Danjiangkou,Hubei 442700,China)
Abstract:Objective To observe the effects of high-level cholesterol on Akt/NF-κB signaling pathway of primary osteoblasts. Methods Mouse primary osteoblasts were seeded at 1×105to 6-well plates. At 80%fusion,the cells were stimulated with 0 μg/ml,12.5 μg/ml,25 μg/ml and 50 μg/ml cholesterol solution culture medium respectively for 24 hours. The protein levels of NF-κB and phosphorylation of Akt were detected by Western blot. The levels of IL-1α,IL-6 and TNF-α were detected by RT-qPCR and ELISA. Results High-level cholesterol increased the NF-κB protein level and decreased phosphorylation of Akt. High-level cholesterol increased not only the mRNA levels but also protein levels of IL-1α,IL-6 and TNF-α. Conclusions Together,these results have uncovered a role of cholesterol in osteoblasts and provided the evidence that treatment with cholesterol at a high dosage may influence the levels of inflammatory factors through Akt/NF-κB signaling pathway in osteoblasts.
Keywords:osteoblast;NF-κB;AKT;cholesterol
中圖分類號:R589.9;R-332
文獻標識碼:A
DOI:10.3969/j.issn.1005-8982.2016.10.002
文章編號:1005-8982(2016)10-0006-05
收稿日期:2015-10-26

