快速PCR介導的NeuroD—3′UTR的定點突變研究
趙金艷+盧宏+張振武+梁洋


摘要:糖尿病是一種由遺傳和環境因素共同引起的代謝紊亂綜合征。與肝細胞核因子有關的幼年發病的成人型糖尿病(MODY) 屬于特殊類型的糖尿病,分為6型,其中Ⅵ 型MODY 為bHLH 家族轉錄因子NeuroD 突變引起的疾病。在體內NeuroD能夠與A類bHLH的轉錄因子E47結合,進而形成二聚體。這種二聚體能夠與胰島素基因的E盒高親和力結合,從而激活胰島素相關基因的轉錄表達;因此,NeuroD對胰腺β細胞的生理功能有很重要的影響。本試驗利用PGMT-NeuroD-3′UTR質粒,通過一次PCR方法使NeuroD-3′UTR上的多個位點發生定點突變,并篩選出突變的目的片段;隨后將突變的片斷連接到螢光素酶報告載體PGL3-CONTROL上,構建了PGL3-3′NeuroD突變載體。該結果可為探討NeuroD基因在胰腺β細胞發育中的生理功能,及進一步治療糖尿病的研究提供了試驗基礎。
關鍵詞:NeuroD;PCR;突變;載體構建;糖尿病
中圖分類號: Q754
文獻標志碼: A
文章編號:1002-1302(2016)04-0087-03
糖尿病(diabetes mellitus)是一種代謝性疾病,其特征為由于胰島素分泌不足、胰島素功能障礙或兩者同時存在而導致的,以慢性高血糖并伴有碳水化合物、脂肪和蛋白質代謝紊亂[1]。糖尿病是一種由多種因素導致的疾病,這些因素包括遺傳因素、自身因素(自身免疫)及環境因素[2]等。
神經分化因子1 (NeuroD-1) 是一種bHL H蛋白[3] 。在生物學中,NeuroD-1又稱為β細胞E盒轉錄激活因子2 (Beta-2) 。NeuroD-1/Beta-2對靶基因的轉錄激活/抑制作用主要通過和靶基因中的特異性序列結合來實現的。同時,NeuroD-1/Beta-2也能夠與其他靶基因的轉錄因子發生作用,協同調節靶基因的活性狀態,進而影響相關基因的生理功能。隨著生物學的不斷發展,相關研究表明NeuroD-1/Beta-2基因發生突變時,對糖尿病的發生有一定的影響[4]。在利用模式生物小鼠研究NeuroD-1/Beta-2的生物學功能時發現,當NeuroD-1/Beta-2 基因缺失時,小鼠發生嚴重的糖尿病,并且這些患有嚴重糖尿病的小鼠在圍產期發生死亡。在NeuroD-1/Beta-2基因純合缺失的小鼠中表現的酮尿證實,這種嚴重的糖尿病是由于β細胞功能發生異常導致的[5]。因此,NeuroD-1/Beta-2 基因對研究胰腺發育和糖尿病機制具有重要的意義。
基因突變技術常用于研究基因調控、表達和蛋白質的結構功能等,其中,定點突變技術已經越來越被生物學家廣泛應用于基因工程、蛋白質工程研究。目前使用較廣泛的主要有重組PCR法、重疊延伸法、U模版法和大引物突變法等。其中,重疊延伸的方法和大引物突變的方法均需要多次PCR和多對引物,才能使得目標突變率高,這種方法操作復雜并且步驟繁瑣。快速PCR介導的定點突變方法僅需1次PCR 反應,目標突變效率高,操作簡單,節約成本[6]。
本試驗為了構建NeuroD-3′UTR的定點突變,進一步研究NeuroD基因與糖尿病之間的生物學機制,采用快速PCR定點突變的方法,對NeuroD-3′UTR同時進行多個位點的突變,并篩選出突變的目的片段,構建了PGL3-3′NeuroD 突變載體,為探討NeuroD基因在胰腺β細胞發育中的生理功能,及進一步治療糖尿病的研究提供試驗基礎。
1 材料與方法
1.1 試驗材料
PGMT-NeuroD和PGL3-CONTROL載體由筆者所在實驗室保存。
JM109感受態細胞,D2000 Plus DNA ladder購自北京索萊寶科技有限公司;1 kb DNA Ladder Marker購自于北京艾德萊生物技術有限公司;限制性內切酶XbaⅠ與FseⅠ(NEB公司),T4 DNA連接酶(TaKaRa公司);DNA凝膠回收試劑盒、快速質粒小量提取試劑盒均購自Omega公司;瓊脂糖購自Biowest公司,其余試劑為國產分析純試劑;PCR引物、質粒測序均由上海英駿生物技術有限公司完成。
1.2 試驗方法
1.2.1 突變引物設計與合成 根據NeuroD的編碼序列(GenBank序列號:gi:226493587)(粗體為突變位點)設計上游引物P1,序列為:5′-GAAAAAAAACCAACAAATTCGTCAATTTGAGCAATTCATCT-3′,下游引物P2,序列為:5′-AGATGAATTGCTCAAATTGACGAATTTGTTGGTTTTTTTTC-3′。
1.2.2 快速PCR介導的突變 以PGMT-NeuroD-3′UTR為模板,采用PCR方法使NeuroD-3′UTR發生多個位點的定點突變。PCR反應體系為20 μL,反應條件為:94 ℃初始變性5 min,16個循環( 94 ℃ 1 min,58 ℃ 40 s,72 ℃ 5 min),72 ℃ 延伸10 min,4 ℃ 保存。擴增片段大小應為 3 432 bp,純化PCR擴增的產物。
1.2.3 NerouD-3′UTR突變質粒構建及鑒定 回收產物用DPN1酶消化模版,消化時間為8 h。消化反應體系為:PGMT-NerouD-3′UTR(PCR回收)17.5 μL,10×DNP1 buffer 2 μL,DNP 1 (10 U/μL)1 μL。將消化產物轉化進JM109大腸桿菌感受態細胞,篩選得到陽性克隆,經菌液PCR驗證后提取質粒,所提質粒經PCR驗證后用XbaⅠ與FseⅠ酶進行雙酶切檢測,用瓊脂糖凝膠驗證突變片段正確后,將獲取的目的DNA 送上海英駿生物技術有限公司測序鑒定。
1.2.4 PGL3-3′UTR載體的構建與鑒定 用XbaⅠ與FseⅠ酶分別對Pgmt-NeuroD-3′UTR和 PGL3-CONTROL進行雙酶切處理,1% 瓊脂糖凝膠電泳后,用膠回收試劑盒回收相應目的DNA和質粒酶切片段。DNA片段與酶切的PGL3-CONTROL載體采用T4 DNA 連接酶16 ℃ 過夜連接,轉化后經菌液PCR驗證所提質粒,XbaⅠ與FseⅠ雙酶切鑒定后,將重組質粒命名為PGL3/NeuroD-3′UTR載體。
2 結果與分析
2.1 PCR介導的PGMT-NeuroD-3′UTR突變
設計突變引物P1/P2,以實驗室自存PGMT-NeuroD為模板,采用一次快速PCR方法將PGMT-NeuroD-3′UTR上多個堿基突變。將擴增產物進行1%瓊脂糖凝膠電泳,鑒定結果顯示,擴增產物約為3 432 bp左右的DNA條帶且特異性較高,同預期片段的大小符合(圖1)。
2.2 PCR介導的PGMT-NeuroD-3′UTR突變檢測
將突變產物經DPN1消化后轉入大腸桿菌感受態細胞JM109中,挑取克隆,通過菌液PCR檢驗克隆的準確性,將菌液PCR鑒定正確的菌液用質粒提取試劑盒提取突變質粒,利用引物P1/P2對所提取的質粒進行PCR檢測,PCR產物約為417 bp,通過1%瓊脂糖凝膠電泳檢驗,條帶大小符合預計(圖2)。
同時利用XbaⅠ與FseⅠ對所提質粒進行雙酶切檢測,經1%瓊脂糖凝膠電泳,短片段約417 bp,長片段3 000 bp左右,符合預計大小(圖3)。
將突變完成的質粒送到公司測序,測序結果顯示正確,目標位置成功突變,位于1854、1855、1856位置的堿基由TTGCACA變成TTCGTAC,并且沒有出現其他堿基的突變(圖4)。
2.3 PGL3-NeuroD3′UTR突變載體的構建
將表達載體PGL3-CONTROL與突變完成的質粒用XbaⅠ與FseⅠ雙酶切,并膠回收,1%瓊脂糖凝膠電泳檢驗酶切膠回收結果,條帶大小符合預計(圖5)。連接轉化后挑取4 個單克隆菌落培養過夜,通過菌液PCR檢驗克隆的準確性,引物為P1/P2,全長為417 bp,通過1%瓊脂糖凝膠電泳檢驗,有2個克隆的條帶大小符合預計(圖6)。
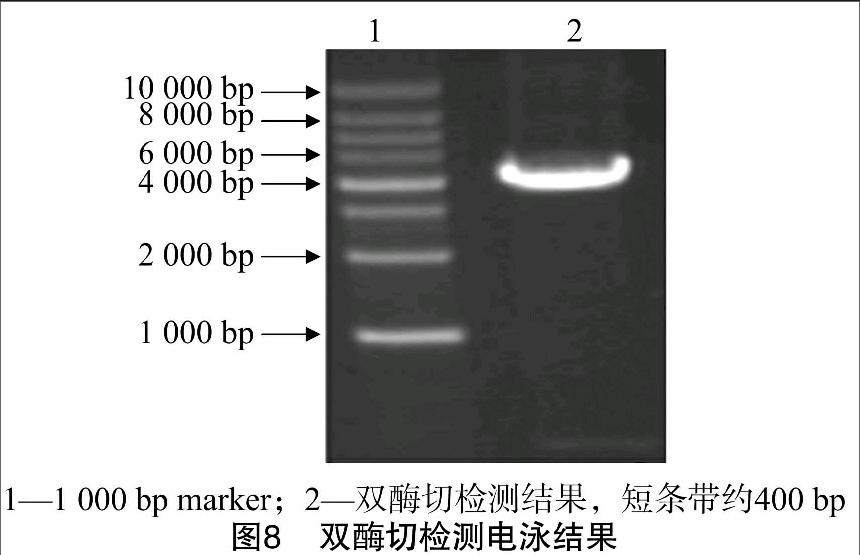
將菌液PCR鑒定正確的菌液用質粒提取試劑盒提取質粒,利用提取的質粒,通過擴增引物P1/P2,做質粒PCR,條帶位于400~500 bp之間(圖7),符合預計大小。同時利用XbaⅠ與FseⅠ雙酶切檢測所提取的質粒,條帶符合預計大小(圖8),顯示PGL3-NeuroD-3′UTR突變載體構建成功。
3 討論
糖尿病(diabetes mellitus)是一組由于胰島素分泌不足、胰島素功能障礙或兩者同時存在而導致的代謝性疾病。其特征為慢性高血糖并伴有碳水化合物、脂肪和蛋白質代謝紊亂。糖尿病是一種由多種因素導致的疾病,這些因素包括遺傳因素、自身因素(自身免疫)及環境因素。NeuroD-1/Beta-2對靶基因的轉錄激活/抑制作用主要通過和靶基因中的特異性序列結合來實現的。同時,NeuroD-1/Beta-2也能夠與其他靶基因的轉錄因子發生作用,協同調節靶基因的活性狀態,進而影響相關基因的生理功能,調節靶基因的最終活性狀態[7]。前期研究表明NeuroD-1/Beta-2基因發生突變時,對糖尿病的發生有一定的影響,且Beta-2作為一種轉錄因子能夠激活磺脲類受體基因1(SUR-1) [8]。在生物體中,β細胞胰島素的分泌情況受SUR-1的調節,這種調節機理主要是NeuroD-1 能夠和SUR-1的E3元件結合,進而誘導相關的組織發生特異性表達。研究發現MEK-ERK 信號通路在葡萄糖刺激下能夠影響NeuroD-1 的活性,NeuroD-1發生入核,促進了胰島素相關基因的轉錄表達[9]。因此,NeuroD-1基因對研究和治療糖尿病具有重要的意義。
基因突變技術應用很廣泛,這種技術制備的突變體可用于研究基因的調控表達情況、蛋白質的結構與功能[10]。隨著定點突變技術的發展,蛋白質的結構與功能主要通過突變體研究來實現。寡聚核苷酸引物與靶DNA 雜合分子中間的單個堿基的錯配并不影響擴增效率,因此利用引物區域的錯配使PCR 產物定點突變的方法可以導致DNA的定點突變。近年來,產生了一種新型定點突變的PCR方法,該方法是把需要突變的基因克隆到質粒載體上,用2個突變引物同時擴增質粒DNA,用限制性內切酶對模板DNA進行消化,然后轉入大腸桿菌并篩選陽性克隆。由于該方法僅需1次PCR 反應,很大程度地降低了反應時間,所以被稱為快速PCR法,這種新的PCR方法減少了反應中因堿基錯配而造成的非特異突變,提高了目標突變率。
本試驗即根據上述原理,采用一次快速PCR定點突變方法,對NeuroD-3′UTR的多個位點進行定點突變,經PCR檢測及測序鑒定,目標位置突變成功,1854、1855、1856位置的堿基由TTGCACA變成TTCGTAC(圖4),測序結果顯示,沒有出現其他堿基的突變,降低了堿基錯配的概率,提高了突變效率。隨后將突變片段連接到螢光素酶報告載體PGL3-CONTROL上,經PCR和酶切鑒定,成功構建了PGL3-NeuroD-3′UTR突變載體(圖7、圖8),為后續NeuroD基因的研究,以及通過該基因為糖尿病的研究奠定了基礎。
參考文獻:
[1]Lee J E. Basic helix-loop-helix genes in neural development [J]. Curr Opin Neurobi,1997,7(1):13-20.
[2]Naya F J . Tissue-specific regulation of the insulin gene by a novel basic helix-loop-helix transcription factor [J]. Genes Dev,1995,9(8):1009-1019
[3]Suzuki A,Nakauchi H,Taniguchi H. Prospective isolation of multipotent pancreatic progenitors using flow-cytometric cell sorting [J]. Diabetes,2004,53(8):2143-2152.
[4]Zhou J,Wang X,Pineyro M A,et al . Glucagon-like peptide 1 and exendin-4 convert pancreatic AR42J cells into glucagon-and insulin-producing cells [J]. Diabetes,1999,48(12):2358-2366.
[5]Cho J H,Tsai M J . The role of BETA2/NeuroD1 in the development of the nervous system [J]. Mol Neurobiol,2004,30(1):35-47.
[6]高 川,韓維濤,宋云揚,等. 一種改進的快速PCR定點突變技術[J]. 生物技術通報,2006(3):99-103.
[7]Means A L,Ray K C,Singh A B,et al . Overexpression of heparin-binding EGF-like growth factor in mouse pancreas results in fibrosis and epithelial metaplasia [J]. Gastroenterology,2003,124(4):1020-1036.
[8]Hirabayashi J,Kasai K. The family of metazoan metal-independent β-galactoside-binding lectins:structure,function and molecular evolution[J]. Glycobiology,1993,3(4):297-304.
[9]Vacelet J. Etude en microscopie electronique de lassociation entre bacteries et spongiaires du genre Verongia (Dictyoceratida) [J]. Microsc Biol Cell,1975,23(3):271-288.
[10]Kumar M,Jordan N,Melton D,et al . Signals from lateral plate mesoderm instruct endoderm toward a pancreatic fate[J]. Dev Biol,2003,259(1):109-122.劉 穎,葉生鑫,彭 強,等. 水稻穗長和有效穗數的QTL定位分析[J]. 江蘇農業科學,2016,44(4):86-89.

