右美托咪定對布比卡因所致神經細胞毒性的保護作用
陳根殷,王旭光
?
右美托咪定對布比卡因所致神經細胞毒性的保護作用
陳根殷,王旭光
摘要:目的探討右美托咪定對布比卡因所致神經細胞毒性的保護作用。方法體外培養小鼠神經母細胞瘤細胞株N2a細胞,取對數期細胞分為4組:對照組細胞培養液不加任何藥物;布比卡因組細胞中加入1 000μmol/L布比卡因;50、200μmol/L右美托咪定濃度組細胞中加入1 000μmol/L布比卡因后,再分別加入50、200μmol/L右美托咪定。各組細胞加入藥物后繼續培養24 h,以MTT法檢測細胞存活率;流式細胞術檢測細胞凋亡、活性氧(ROS)水平、線粒體膜電位及Caspase-3的表達。結果在1 000μmol/L布比卡因作用下,各藥物組N2a細胞的存活率明顯降低,同時線粒體膜電位顯著下降,而細胞的凋亡率、胞內ROS水平和Caspase-3表達則顯著升高;50、200μmol/L右美托咪定可抑制布比卡因引起的N2a細胞毒性,使細胞的存活率及線粒體膜電位均明顯升高,同時降低細胞的凋亡率、胞內ROS水平和Caspase-3表達,200μmol/L右美托咪定的變化較50μmol/L更為明顯。結論右美托咪定可減輕布比卡因對N2a細胞的毒性作用,其可能是通過抑制ROS的生成、改變線粒體膜電位、降低Caspase-3的表達,從而抑制細胞的凋亡來實現的。
關鍵詞:右美托咪定;布比卡因;細胞凋亡;活性氧;流式細胞術;神經損傷;線粒體膜電位
布比卡因作為一種酰胺類局部麻醉藥,因具有良好的麻醉和鎮痛效果而被廣泛應用于硬膜外鎮痛、神經阻滯和椎管內麻醉。然而研究發現其對神經元有一定的損傷作用,布比卡因神經毒性的機制尚未完全闡明,有研究認為與其引起神經細胞內源性抗凋亡分子表達下調或活性下降,從而導致神經元壞死和凋亡有關,其神經毒性已引起麻醉學與疼痛治療學領域的廣泛關注[1-2]。右美托咪定是一種新型高選擇性的α2腎上腺素能受體激動劑,具有鎮靜、鎮痛、抗焦慮及抑制交感神經活性,減少應激反應等特性。有研究表明右美托咪定可通過增加抗凋亡蛋白生成和減少促凋亡蛋白生成,降低神經細胞的凋亡,從而增強神經細胞的生存能力[3-5]。但右美托咪定對布比卡因誘導的神經細胞凋亡是否也有影響,目前尚少見報道。本研究探討右美托咪定對布比卡因所致神經損傷的影響,并進一步探討其可能作用機制。
1 材料與方法
1.1實驗材料小鼠神經母細胞瘤細胞株N2a細胞購自上海通派生物科技有限公司;右美托咪定購自江蘇恒瑞制藥有限公司;MEM細胞培養基和胎牛血清購自美國Gibco公司;布比卡因和MTT購自美國Sigma公司;細胞凋亡檢測試劑盒、活性氧(ROS)檢測試劑盒、線粒體膜電位檢測試劑盒、Caspase-3檢測試劑盒和流式細胞儀(型號:FACSCantoⅡ)均購自美國BD公司。
1.2細胞培養用含有10%胎牛血清的MEM培養基培養N2a細胞,到80%單層融合時傳代。
1.3MTT法檢測神經細胞增殖取對數生長期細胞,1×105cell/mL接種于96孔培養板,每孔加100μL,在37℃、5% CO2條件下培養24 h后,分別加入1 000μmol/L布比卡因和不同濃度的右美托咪定(0、10、20、50、100、200、400μmol/L),對照組加入相應體積的PBS,每組設8個平行孔。用藥后繼續培養24 h,然后每孔加入20μL MTT(5 g/L),繼續培養4 h。傾去培養液,每孔加入100μL DMSO溶解,以測定波長為570 nm,參考波長為450 nm于酶標儀測定其吸光度,重復3次。根據公式計算存活率:細胞存活率(%)=處理組吸光度/對照組吸光度×100%。
1.4實驗分組根據MTT及預實驗結果,本實驗設4組,對照組:細胞培養液不加任何藥物。布比卡因(Bup)組:細胞中加入1 000μmol/L布比卡因。50μmol/L右美托咪定濃度(Dex1)組、200μmol/L右美托咪定濃度(Dex2)組:細胞中加入1 000μmol/L布比卡因后再分別加入50、200μmol/L右美托咪定。
1.5流式細胞術檢測細胞凋亡細胞加藥培養24 h后收集細胞,取約5×105重懸的細胞,加入500μL Annexin V-FITC結合液混勻,再加入5μL Annexin V-FITC,然后加入5μL PI染色液,混勻后避光室溫放置15 min,隨即進行流式細胞儀檢測。
1.6細胞內ROS的測定細胞于6孔培養板加藥培養24 h后,每孔加入濃度為10 μmol/L的DCFH-DA,37℃細胞培養箱內孵育20 min,用無血清細胞培養液洗細胞3次,然后收集細胞,流式細胞術檢測細胞內的熒光強度。
1.7線粒體膜電位檢測細胞于6孔培養板加藥培養24 h后,每孔加入500μL JC-1染色工作液(5 mg/L),充分混勻,繼續37℃培養20 min,收集細胞,加500μL JC-1染色緩沖液,用流式細胞儀檢測。較高線粒體膜電位時,JC-1形成聚合體,產生紅色熒光;較低線粒體膜電位時,JC-1聚合體分解成單體,產生綠色熒光。以JC-1單體與聚合體的熒光強度比值來衡量線粒體膜電位的變化。
1.8流式細胞術檢測Caspase-3表達的變化收集各組細胞,加入2%多聚甲醛于冰上孵育30 min,300×g離心5 min去上清;0.5 mL 0.2%的Tween緩沖液重懸細胞,室溫下孵育15 min。離心收集細胞,加入50μL染色緩沖液和10μL Alexa Flour 647標記的Caspase-3抗體,避光孵育30 min,加入1 mL 0.1%Tween緩沖液。離心去上清,加入500μL染色緩沖液,然后上機檢測。
1.9統計學方法采用SPSS 17.0軟件進行統計學分析,計量數據用均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間多重比較采用LSD-t法。P<0.05為差異有統計學意義。
2 結果
2.1MTT實驗結果與對照組相比,濃度為1 000 μmol/L的布比卡因明顯抑制細胞的增殖,具有較強的細胞毒性作用;應用20~400μmol/L右美托咪定作用于細胞能明顯抑制布比卡因的細胞毒性,提高N2a細胞的存活率,與布比卡因組(即0μmol/L濃度組)比較差異有統計學意義(F=9.109,P<0.05)。見圖1。

Fig.1 Effects of different doses of dexmedetomidine on bupivacaine-induced neurotoxicity圖1 右美托咪定對布比卡因細胞毒性的影響
2.2右美托咪定對N2a細胞凋亡的影響布比卡因作用24 h后,與對照組相比,各藥物組N2a細胞的凋亡率顯著增高(P<0.01)。Dex1組和Dex2組細胞的凋亡率較Bup組均明顯下降,Dex2組較Dex1組下降更為明顯,差異均有統計學意義(均P<0.01),見表1、圖2。
2.3右美托咪定對N2a細胞內ROS的影響與對照組相比,各藥物組N2a細胞內的ROS水平顯著增高(P<0.01)。Dex1組和Dex2組ROS水平較Bup組下降,Dex2組較Dex1組下降更為明顯,差異均有統計學意義(均P<0.01),見表1、圖3。
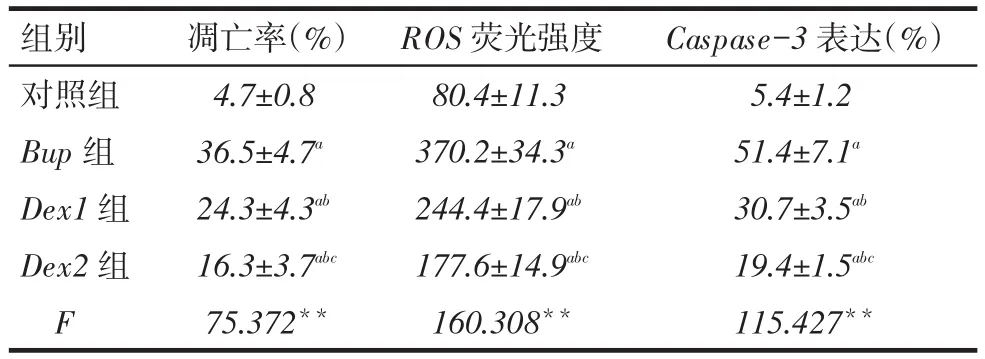
Tab.1 The rate,ROS activity,and expression level of Caspase-3 in N2a cells detected by FCM表1 流式細胞術檢測N2a細胞的凋亡率、ROS水平及Caspase-3表達 (n=5,x±s)
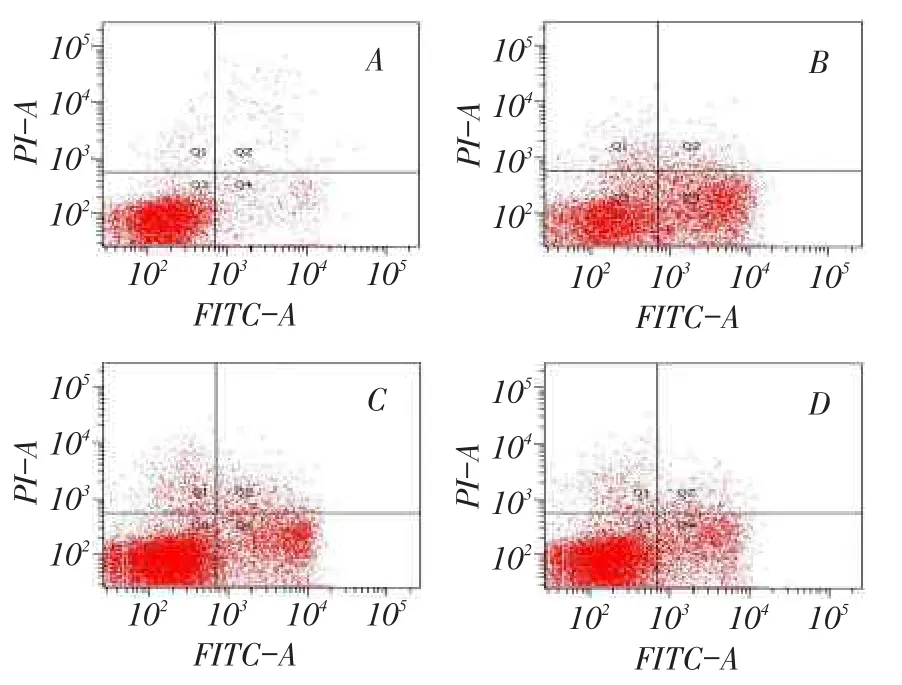
Fig.2 The apoptotic rates of four groups measured by FCM圖2 流式細胞術檢測各組細胞的凋亡

Fig.3 The ROS activity measured by FCM圖3 流式細胞術檢測細胞ROS的變化
2.4右美托咪定對N2a細胞線粒體膜電位的影響與對照組相比,各藥物組N2a細胞內線粒體膜電位顯著下降(P<0.01)。Dex1組和Dex2組細胞線粒體膜電位較Bup組明顯上升,Dex2組較Dex1組上升更為顯著,差異均有統計學意義(均P<0.01),見表2、圖4。

Tab.2 The mitochondrial membrane potential(MMP)measured by FCM表2 流式細胞術檢測各組細胞線粒體膜電位 (n=5,x±s)
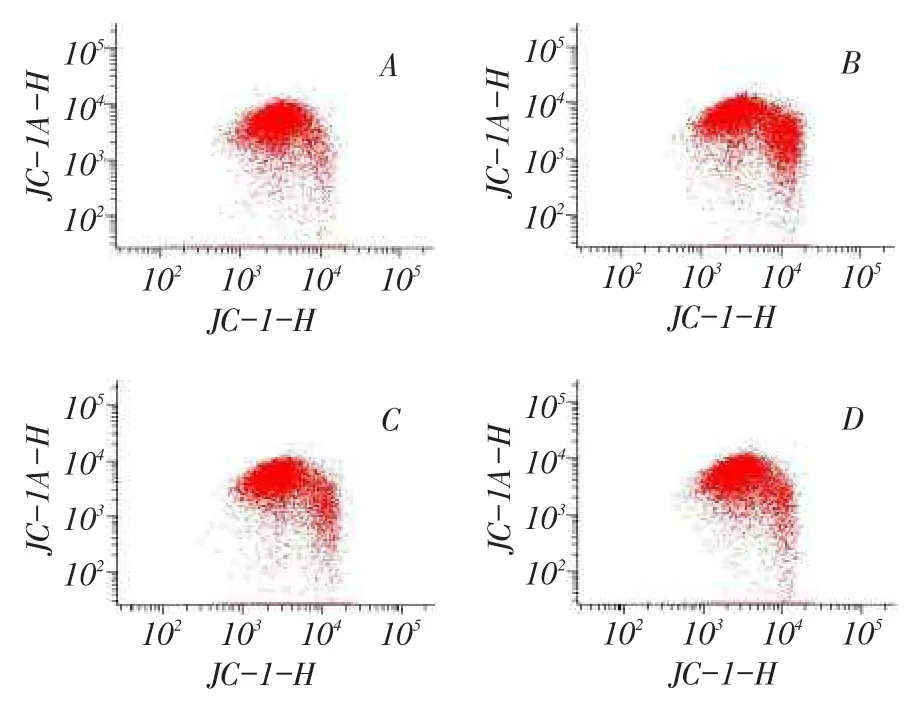
Fig.4 The mitochondrial membrane potential(MMP)measured by FCM圖4 流式細胞術檢測各組細胞線粒體膜電位
2.5右美托咪定對N2a細胞Caspase-3表達的影響與對照組相比,各藥物組N2a細胞Caspase-3表達均顯著增加(P<0.01)。Dex1組和Dex2組N2a細胞Caspase-3表達較Bup組顯著下降,Dex2組較Dex1組下降更顯著,差異均有統計學意義(均P<0.01),見表1、圖5。

Fig.5 Caspase-3 expression of N2acells detected by FCM圖5 流式細胞術檢測Caspase-3的表達
3 討論
臨床和實驗研究均發現布比卡因對神經元具有一定損傷作用,且具有時間和劑量依賴性,并且臨床上常用的劑量就可引起神經損傷。目前布比卡因神經毒性的機制尚未完全闡明,現有研究認為,布比卡因導致患者出現運動和感覺異常的原因在于其可引起神經細胞神經元壞死和凋亡[6-7]。布比卡因可通過干擾氧化磷酸化和抑制線粒體呼吸鏈復合物Ⅰ,使ATP生成減少,并可誘導細胞產生大量ROS,促使電壓依賴性陰離子通道開放,導致Cl-流入線粒體內,使線粒體的滲透壓增高、膜電位降低和通透性增大,釋放促凋亡因子,并激活Caspase-3,導致細胞凋亡[8-9]。
本課題組前期實驗結果顯示,布比卡因可抑制N2a細胞的增殖,并具有劑量依賴性,其半數抑制濃度IC50為1 060μmol/L。本研究采用1 000μmol/L的布比卡因進行實驗。而在右美托咪定系列濃度組中,20μmol/L以上濃度組均可抑制布比卡因的細胞毒性,但在作用機制研究中20μmol/L濃度組和布比卡因組比較差異無統計學意義,所以本實驗采用50μmol/L和200μmol/L濃度組作為低、高兩個濃度進行后續機制實驗。實驗結果顯示,在濃度為1 000 μmol/L布比卡因作用下,N2a細胞的存活率明顯降低,同時凋亡率及線粒體膜電位顯著下降,而胞內ROS水平和Caspase-3表達則顯著升高,提示布比卡因對N2a細胞存在較大的細胞毒性,其原因可能在于布比卡因刺激N2a細胞內產生大量ROS,從而啟動凋亡線粒體途徑,激活Caspase-3,最終導致細胞凋亡。這也與以往研究結果相一致[10]。
多項研究表明,右美托咪定尚具有穩定血流動力學及多器官保護作用[11-12],但其對神經系統的影響和作用機制尚不明確,結果也存在爭議。本研究發現,實驗濃度范圍內的右美托咪定對N2a細胞增殖沒有明顯的抑制作用,且一定濃度的右美托咪定可濃度依賴性地抑制布比卡因引起的細胞毒性,顯著提高N2a細胞的存活率。進一步實驗發現,右美托咪定可降低布比卡因誘導的N2a細胞凋亡。ROS在布比卡因誘導N2a細胞凋亡的過程中起重要作用。本研究顯示,右美托咪定能抑制布比卡因誘導的ROS過度生成,同時升高N2a細胞線粒體膜電位,抑制胞內Caspase-3表達,提示右美托咪定可減輕布比卡因對N2a細胞的毒性作用,其可能是通過抑制ROS的生成,改變線粒體膜電位,降低Caspase-3的表達,從而抑制細胞的凋亡來實現,但具體的作用機制還需進一步研究。
右美托咪定的多器官保護作用已越來越受到人們的關注,尤其在神經保護和心臟保護中,右美托咪定已顯示出其獨特的優越性。但目前針對右美托咪定的用藥劑量及其與其他麻醉藥物的相互作用等問題尚需更多、更細致的研究以使其應用更安全、更有效。
參考文獻
[1]Vallerie SN,Hotamisligil GS.The role of JNK proteins in metabolism[J].Sci Transl Med,2010,2(60):60rv5.doi:10.1126/scitranslmed.3001007.
[2]Park CJ,Park SA,YoonTG,et al.BuPivaeaine induces apoptosis via ROS in the Schwann cell line[J].JDent Res,2005,84(9):852-857.
[3]Zhu YM,Wang CC,Chen L,et al.Both PI3K/Akt and ERK1/2 pathways participate in the protection by dexmedetomidine against transient focal cerebral ischemia/reperfusion injury in rats[J].Brain Res,2013,1494:1-8.doi:10.1016/j.brainres.2012.11.047.
[4]Dahmani S,Rouelle D,Gressens P,et al.Characterization of the postconditioning effect of dexmedetomidine inmouse organotypic hippocampal slice cultures exposed tooxygen and glucose deprivation[J].Anesthesiology,2010,112(2):373-383.doi:10.1097/ ALN.0b013e3 181ca6982.
[5]Ma R,Wang X,Lu C,et al.Dexamethasone attenuated bupivacaine induced injury in vitro through a threonine serine protein kinse B-dependent mechanism[J].Neuroscience,2010,167(2):329-342. doi:10.1016/j.neuroscience.2009.12.049.
[6]Liu L,Zhang X,Qian B,et al.Over-expression of heat shock protein 27 attenuates doxorubicin-induced cardiac dysfunction in mice [J].Eur JHeart Fail,2007,9(8):762-769.
[7]Sakaguchi M,Murayama K,Yabe K,et al.β-Casomorphin-5 stimulates neurite outgrowth in a mouse neuroblastoma cell line(Neuro-2a)[J].Neurosci Lett,2008,251(2):97-100.
[8]Lirk P,Haller I,Myers RR,et al.Mitigation of direct neurotoxic effects of Iidoeaine and amitriptyline by inhibition of P38 mitogen-activated protein kinase in vitro and invivo[J].Anesthesiolog,2009,104(6):1266-1273.
[9]Zorov DB,Juhaszova M,Sollott SJ.Mitoehondrial ROS-nduced ROS release:an update and review[J].Biochim Bio Phys Acta,2006,1757(5/6):509-517.
[10]Li L,Zhang QG,Lai LY,et al.Neuroprotective effect of ginkgolide B on bupivacaine-induced apoptosis in SH-SY5Y cells[J].Oxid Med Cell Longev,2013,2013:159864.doi:10.1155/2013/159864.
[11]Ibacache M,Sanchez G,Pedrozo Z,et al.Dexmedetomidine preconditioningactivates pro-survival kinasesand attenuatesregional ischemia/reperfusion injury in rat heart[J].Biochim Biophy Acta,2012,1822(4):537-545.doi:10.1016/j.bbadis.2011.12.013.
[12]Hanci V,Yurdakan G,Yurtlu S,et al.Protection effect of dexmedetomidine in a rat model of a-naphthylthiourea induced acute lung injury[J].J Surg Res,2012,178(1):424-430.doi:10.1016/j.jss. 2012.02.027.
(2015-06-01收稿2015-11-03修回)
(本文編輯陳麗潔)
Protective effects of dexmedetomidine on bupivacaine-induced neurotoxicity
CHEN Genyin,WANG Xuguang
The Affiliated Hospital of Guangdong Medical College,Zhanjiang 524001,China Corresponding AuthorE-mail:marvin009@126.com
Abstract:ObjectiveTo investigate the protective effects of dexmedetomidine on bupivacaine-induced neurotoxicity. MethodsMouse neuroblastoma cell line N2a cells were divided into four groups.The cells in the control group were incubated with no drug adding while the cells in bupivacaine group were treated with 1 000μmol/L bupivacaine for 24 h.The cells in the group Dex1 and Dex2 were incubated with 1 000μmol/L bupivacaine and 50μmol/L,200μmol/L dexmedetomidine for 24 h respectively.MTT assay was used to evaluate the cell viability.The reactive oxygen species(ROS)activity,mitochondrial membrane potential(MMP),the expression of Caspase-3 and apoptotic rate of N2a cells were detected by flow cytometry.ResultsThe cell viabilities were significantly decreased after being treated with 1 000μmol/L bupivacaine,MMP was also significantly decreased,and apoptotic rates,levels of ROS and Caspase-3 were significantly increased.The bupivacaine-induced cytotoxicity was inhibited by dexmedetomidine(50 and 200μmol/L),which resulted in the increase in the cell viability and MMP,but decrease in apoptotic rate and levels of ROS and Caspase-3.These effects were more significant in 200μmol/L dexmedetomidine group than those of 50μmol/L dexmedetomidine group.ConclusionDexmedetomidine attenuates bupivacaine-induced cytotoxicity of N2a cells,which may be related with the inhibition of ROS,the decrease in MMPand Caspase-3,and inhibitingappotosis in N2acells.
Key words:dexmedetomidine;bupivacaine;apoptosis;reactive oxygen species;flow cytometry;neurotoxicity;mitochondrial membrane potential
中圖分類號:R614.1
文獻標志碼:A
DOI:10.11958/58574
作者單位:湛江市,廣東醫學院附屬醫院(郵編524001)
作者簡介:陳根殷(1973),女,主任醫師,主要從事麻醉藥物基礎研究
通訊作者E-mail:marvin009@126.com

