大鼠Tmub1基因過表達慢病毒載體的構建*
趙曉彪,李光耀,劉孟剛,范 霞,陳 平△
(第三軍醫大學大坪醫院野戰外科研究所:1.肝膽外科;2.一室,重慶 400042)
?
論著·基礎研究
大鼠Tmub1基因過表達慢病毒載體的構建*
趙曉彪1,李光耀1,劉孟剛1,范霞2,陳平1△
(第三軍醫大學大坪醫院野戰外科研究所:1.肝膽外科;2.一室,重慶 400042)
目的構建Tmub1基因的過表達慢病毒載體(LV-Tmub1),為研究Tmub1蛋白在肝細胞增殖過程中的作用提供實驗材料。方法化學合成Tmub1基因序列,用BamHI/AgeI酶切化學合成含有目的基因的質粒及GV287載體,PCR產物連接入線性化表達的載體。PCR鑒定引物,再對 PCR鑒定陽性的克隆進行DNA測序和比對分析。使用構建的LV-Tmnb1,轉染293T細胞,熒光法檢測構建的慢病毒滴度。結果成功構建了LV-Tmub1,并獲得相應的病毒,病毒滴度為 2×108TU/mL。結論LV-Tmub1為進一步研究Tmub1蛋白在肝細胞增殖中的作用提供了實驗基礎。
Tmub1;基因;過表達慢病毒載體;大鼠
Tmub1(transmemebrance and ubiquitin-like domain containing 1) 基因編碼的Tmub1 蛋白是一個含有類似泛素結構域的能夠在細胞核與細胞質之間穿梭的蛋白質[1-3];在細胞周期的G0期主要位于肝細胞的細胞質內,在細胞增殖后期的G2~S期則幾乎全部穿梭進入肝細胞核內。Della等[4]發現Tmub1蛋白在肝部分切除術后肝再生的過程中明顯高表達,它包含有一個跨膜域和一個類似泛素結構的區域(UBL),該區域包含與UCH、E2和CUE等的反應位點。所以說明它在肝細胞增殖過程中擔負著復雜而又重要的功能。本研究構建Tmub1過表達慢病毒載體(LV-Tmub1),用來轉染肝細胞系及注射入實驗動物體內,為深入了解Tmub1 基因和蛋白在肝細胞增殖和肝再生過程中的作用及分子生物學機制提供實驗基礎。
1 材料與方法
1.1實驗材料
1.1.1主要試劑Thermo Fisher Scientific Lipofectamine 2000及Opti-MEM培養基 ,1 kp DNA ladder Marker(Fermentas),Gibco小牛血清,250 bp DNA ladder Marker(捷瑞生物公司),瓊脂糖(賽百盛公司),限制性內切酶(NEB) ,In-Fusion?PCR Cloning (Kit clontech), Primer(捷瑞生物公司),Plasmid 抽提(Kit Promega),瓊脂糖凝膠DNA回收試劑盒(天根生化),Taq polymerase(SinoBio),dNTP(Takara) ,BRL-3A細胞(上海生命科學研究所)。
1.1.2主要儀器Applied Biosystems公司PCR儀,美季生物技術ABI3730 型positive clone 測序儀,BioRad穩壓DNA電泳儀,天能公司凝膠成像儀,上海實驗設備有限公司細菌搖床,Thermo細菌培養箱,Gibco水浴箱,Gilson移液器,日立高速離心機。
1.2方法
1.2.1目的基因的獲取首先在美國國立圖書館查找大鼠Tmub1基因序列,基因編號:362301。PCR擴增目的基因片段(圖1),5′端GGA TCC為BamHI酶切位點,3′端ACC GGT為AgeI酶切位點。其中藍色標記為美國國立圖書館的大鼠Tmub1基因編碼區。
1.2.2酶切載體工具載體購自吉凱基因,載體名稱:GV287;10.4 kb;元件順序:Ubi-MCS-3FLAG-SV40-EGFP;克隆位點:BamHI/AgeI。酶切反應溫度37 ℃,時間2 h。
1.2.3重組質粒構建
1.2.3.1PCR產物交換入線性化表達載體反應條件為25 ℃反應30 min,然后42 ℃反應15 min。
1.2.3.2CaCl2制備大腸桿菌感受態細胞(1)從新鮮細菌培養平皿中選取一個單菌落,轉到含有 100 mL小牛血清培養基的1 L燒瓶中,在37 ℃條件下劇烈振蕩搖勻培養3 h。(2)將培養后的大腸埃希菌轉移到無菌的60 mL離心管中,在冰上放置10 min,4 000 r/min離心10 min,回收離心后的細胞。(3)緩慢倒出上層培養液,然后用10 mL預冷的0.1 mol/L CaCl2重懸細胞。(4)在40 ℃條件下,4 000 r/min離心10 min,回收沉淀細胞。(5)倒出培養液,每50 mL初始培養細胞用2 mL用冰預冷的0.1 mol/L CaCl2重懸每份細胞沉淀。

圖1 化學合成的基因片段
1.2.3.3轉化(1)取200 μL感受態細胞懸液轉移到500 μL離心管中,管中各加入10 μL連接溶液,放置冰上30 min。(2)然后將每個離心管放到42 ℃的恒溫水浴箱中放置90 s。(3)將離心管快速放置到冰上冷卻細胞1~2 min。(3) 每管中各加入 800 μL小牛血清培養基,放置到37 ℃搖床上培養45 min。(4)分別將150 μL已轉化的各種感受態細胞轉移到AMP抗性的LB瓊脂培養基上。(5)將平板置于室溫條件下直至液體被完全吸收。(6)倒置培養平皿,于37 ℃細胞培養箱中培養16 h。
1.2.3.4陽性克隆的PCR測定采用20 μL反應體系,取2 μL菌液作為模板,選擇合適的引物對其進行PCR擴增,再使用瓊脂糖凝膠電泳檢查PCR產物。陽性克隆結果測序及分析。
1.2.4慢病毒包裝(1)使用2%胰酶消化培養于50 mL培養瓶中對數生長期的293T細胞,DMEM培養基調整細胞密度,光學顯微鏡下計數,當細胞密度為6×105/mL時將細胞密度重新接種于25 mL細胞培養皿中,37 ℃細胞培養箱中培養24 h后顯微鏡下觀察,待細胞密度達到75%~80%時即可用于轉染。(2)滅菌10 mL離心管中加入所制備的各DNA溶液,與相應體積的Opti-MEM混合均勻,室溫下溫育5 min。(3) 取200 μL Lipofectamine 2000轉染試劑與4.8 mL Opti-MEM培養基混合后在室溫下溫育 5 min。(4)將Opti-MEM培養基稀釋后的DNA溶液與稀釋后的Lipofectamine 2000轉染試劑充分混合均勻,在室溫下溫育20 min。(5) 將 DNA溶液與Lipofectamine 2000轉染試劑的混合液快速轉移至293T細胞的培養液中,充分混合均勻,放置入37 ℃,5%CO2細胞培養箱中培養8 h后倒去含有轉染混合物的培養基,各細胞中加入20 mL PBS緩沖液洗滌3次,然后將每瓶細胞中加入含10%胎牛血清的DMEM培養基25 mL后繼續放置于37 ℃,5%CO2細胞培養箱內培養48 h。
1.2.5病毒的收獲及濃縮(1)收集轉染培養48 h后的 293T細胞上清液,在4 ℃,4 000 r/min條件下離心10 min后除去下層沉淀,上清液使用0.45 μm過濾器過濾于50 mL超速離心管中得到病毒提樣液。(2)將得到的病毒提液樣品加入到過濾杯中,然后將過濾杯插到濾過液收集管中,4 000 r/min離心,時間為10~15 min。(3)得到病毒濃縮液后將其分別收集于1.5 mL無菌Ep管中,-80 ℃冰箱保存,隨機取出其中一支,進行病毒生物學滴度測定。
1.2.6熒光法慢病毒滴度測定(1) 調整293T細胞濃度為4×105,使用96孔細胞培養板培養細胞,每個孔加體積為100 μL。(2)10個無菌的Ep管中分別加入90 μL無血清的DMEM培養基。(3) 取待測定的病毒原液10 μL加入到第一個Ep管中,標記為1管,2管中的病毒原液比1管稀釋10倍,3~10管依次稀釋10倍。(4)在96孔培養板中選取所需的細胞孔,吸去其中90 μL培養基后加入90 μL 稀釋好的病毒溶液,放入培養箱37 ℃,5%CO2培養24 h后加入完全培養基100 μL繼續培養96 h后在熒光顯微鏡下觀察慢病毒熒光表達情況。
2 結 果
2.1陽性克隆結果陽性轉化子PCR產物大小921 bp,陰性轉化子PCR產物大小185 bp,見圖2。
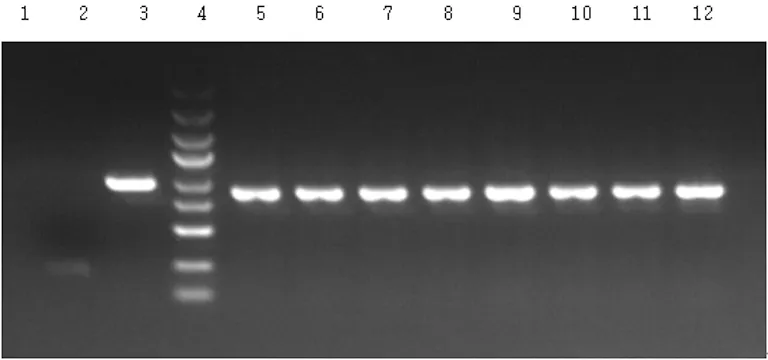
1:陰性對照ddH2O;2:空載自連對照組;3:陽性對照GAPDH;4:Marker,自上而下依次為5.0、3.0、2.0、1.5、1.0 kb,750、500、250、100 bp;5~12:Tmub1基因1~8號轉化子。
圖2PCR產物電泳圖
2.2陽性克隆結果測序同一性為100%,測序結果與目標序列完全一致。
2.3熒光法慢病毒滴度測定結果熒光法測定慢病毒滴度為2×108TU/mL,見圖3。
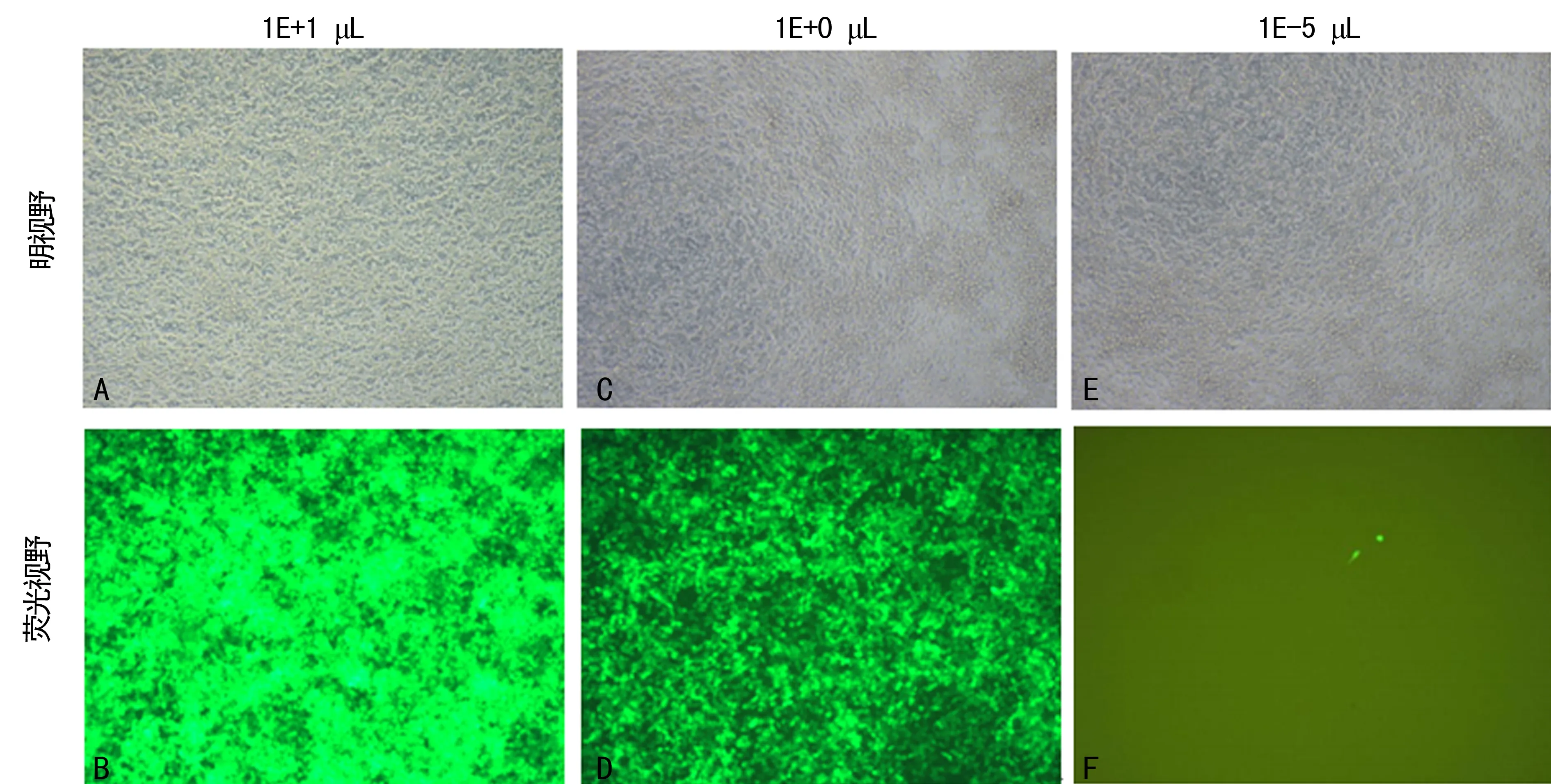
A、B:加入病毒10 μL;C、D:稀釋10倍后的熒光表達情況;E、F:稀釋105倍后的熒光表達情況。
圖3熒光法慢病毒滴度測定(×100)
3 討 論
慢病毒載體是以人類免疫缺陷病毒I型(HIV-1)為基礎發展起來的基因治療載體,它對分裂細胞和非分裂細胞具有感染能力,能夠穩定的轉染多種哺乳動物細胞系和原代細胞[5-8]。目前在實驗室和臨床前研究中以及臨床治療中已廣泛使用。
肝部分切除術后,刺激體內生物信息系統及物理學反饋信號系統使處于靜止期的肝細胞分裂,進入增殖周期,此時體內各種細胞因子、生物因子以及多個臟器參與其調控[9]。其中,Tmub1蛋白在肝部分切除術后的肝再生過程中明顯高表達,能夠在增殖的肝細胞質與細胞核之間穿梭,且具有明顯的生物學規律,說明Tmub1蛋白可能在肝細胞增殖過程中發揮作用[10-11]。為了研究Tmub1蛋白在肝細胞增殖中的作用及其分子生物學機制,需要通過現代基因工程學的方法,構建Tmub1基因過表達的慢病毒載體,用來轉染肝細胞系及注射肝部分切除術后的大鼠。首先在美國國立圖書館網站查到目標基因大鼠Tmub1序列,然后通過基因擴增技術克隆該目標序列,再利用已有的質粒載體,把Tmub1目標序列整合到該質粒中,所得到的陽性克隆序列經過基因測序與目標序列完全一致。再經過滴度檢測及分裝保存,收獲了Tmub1過表達慢病毒載體。
Tmub1基因過表達慢病毒載體的成功構建,對下一步研究Tmub1基因及蛋白在大鼠肝部分切除術后肝再生和體外BRL-3A肝細胞系增殖中的作用提供實驗依據及實驗基礎,并且為了解生物體內的其他細胞增殖的分子生物學機制提供幫助。通過對其更加深入的研究,還可能為臨床預防和治療肝切除術后肝功能衰竭提供基因治療的新思路。
[1]Castelli M,Pieroni S,Brunacci C,et al.Hepatocyte odd protein shuttling(HOPS) is a bridging protein in the nucleophosmin-p19( Arf) network[J].Oncogene,2013,11,32(28):3350-3358.
[2]Liu M,Liu H,Wang X,et al.IL-6inductionof hepatocyte proliferation through the Tmub1-regulated gene pathway[J].Int J Mol Med,2012,29(6):1106-1112.
[3]Zhang W,Savelieva KV,Suwanichkul A,et al.Transmembraneand ubiquitin-likedomain containing1 (Tmub1) regulates locomotoractivity and wakefulness in mice and interacts with CAMLG [J].PLoSOne,2010,5(6):e11261.
[4]Della FM,Castelli M,Bartoli D,et al.HOPS:a novel cAMP-dependent shuttling protein involved in protein synthesis regulation [J].J Cell Sci,2005,118(Pt 14):3185-3194.
[5]Krzysztof P,Marta MK.Use of HIV as a gene transfer vector [J].Acta Biochim Pol,2009,56(4):531-595.
[6]Vijaykumar TS,Avindra N,Ashok C,et al.Chloroquine mediated molecular tuning of astrocytes for enhanced permissiveness to HIV infection[J].Virology,2008,381(1):1-5.
[7]Ng CT,Jaworski JP,Sutton WF,et al.Passive neutralizing antibody controls SHIV viremia and enhances B cell responses in infant macaques[J].Nat Med,2010,16(10):1117-1119.
[8]Concalves MAFV,Janssen JM,Holker M,et al.Rapid and Sensitive Lentivirus Vector-Based Conditional Gene Expression Assay to Monitor and Quantify Cell Fusion Activity[J].PLoS ONE,2010,5(6):e10954.
[9]Fujiyoshi M,Ozaki M.Molecular mechanisms of liver regeneration and protection for treatment of liver dysfunction and diseases[J].J Hepatobiliary Pancreat Sci,2011,18(1):13-22.
[10]Yamada Y,Webber EM,Kirillova I,et al.Analysis of liver regeneration in mice lacking type 1 or type 2 tumor necrosis factor receptor:requirement for type 1 but not type 2 receptor[J].Hepatology,1998,28(4):959-970.
[11]Teoh N,Leclercq I,Pena AD,et al.Low-dose TNF-α protects against hepatic ischemia-reperfusion injury in mice:implication for preconditioning[J].Hepatology,2003,37(1):118-128.
Construction of lentivirus vectors of rat Tmub1 gene overexpression*
ZhaoXiaobiao1,LiGuangyao1,LiuMenggang1,FanXia2,ChenPing1△
(1.DepartmentofHepatobiliarySurgery;2.DepartmentofFirstLaboratory,ResearchInstituteofSurgery,DapingHospital,ThirdMilitaryMedicalUniversity,Chongqing400042,China)
ObjectiveTo construct the lentiviral vector with overexpression Tmub1 gene to provide the experimental materials in the research of Tmub1 protein function in the process of the hepatocyte proliferation.MethodsThe Tmub1 gene sequences was constructed through chemical synthesis,plasmid containing the purpose gene and GV287 vectors were digested with BamHI/AgeI enzyme,the PCR products were connected into the linearized expression vector.PCR confirmed the primers,the positive clones identified by PCR DNA were sequenced and performed the comparative analysis.The constructed lentiviral vectors of Tmub1 gene overexpression was used to transfect 293T cell lines.Then the lentivirus titer was detected by the fluorescence method.ResultsThe lentiviral vector with Tmub1 gene overexpression was successfully constructed and the corresponding virus was obtained,the virus titer was 2×108TU/mL.ConclusionLV-Tmub1 expressing lentiviral vector provides the experimental foundations for the further study of the role of Tmub1 protein in hepatocyte proliferation.
Tmub1;gene;LV-Tmub1;rats
10.3969/j.issn.1671-8348.2016.13.005
國家自然科學基金面上項目(81270523)。作者簡介:趙曉彪(1979-),碩士,主治醫師,主要從事肝切除術后肝再生的相關研究。△
,E-mail:chenping@263.com。
R575
A
1671-8348(2016)13-1744-03
2015-11-26
2015-12-30)

