中藥菩人丹對OLETF大鼠視網膜磷酸化c-Jun氨基末端激酶和半胱氨酸天冬氨酸激酶-3表達的干預作用
張自然, 董志軍, 董微麗, 張鐵民, 賈璐瑤, 戴 慧, 邢 薇(承德醫學院附屬醫院眼科,河北承德067000)
?
中藥菩人丹對OLETF大鼠視網膜磷酸化c-Jun氨基末端激酶和半胱氨酸天冬氨酸激酶-3表達的干預作用
張自然, 董志軍*, 董微麗, 張鐵民, 賈璐瑤, 戴 慧, 邢 薇
(承德醫學院附屬醫院眼科,河北承德067000)
目的 探討菩人丹超微粉 (PRD)對糖尿病大鼠視網膜磷酸化c-Jun氨基末端激酶 (p-JNK)和半胱氨酸天冬氨酸激酶-3(Caspase-3)表達的影響。方法 以自發性雄性2型糖尿病大鼠模型OLETF大鼠和其同系非糖尿病對照鼠LETO雄性大鼠為實驗對象,血糖峰值>16.7mmo1/L和負荷后120min血糖>11.1mmo1/L作為成模標準,將24只成模雄性OLETF大鼠隨機分為模型組、菩人丹超微粉治療組,每組12只,同周齡12只雄性LETO大鼠為空白對照組。模型成功建立后,菩人丹超微粉治療組大鼠給予菩人丹超微粉 [1.8 g·(kg·d)-1]灌胃2個月。HE染色觀察視網膜形態結構的變化;采用脫氧核糖核苷酸末端轉移酶介導的缺口末端標記法 (TUNEL)檢測大鼠視網膜神經細胞的凋亡情況;SP免疫組織化學染色法和Western b1ot法檢測視網膜磷酸化JNK(p-JNK)、Caspase-3蛋白的表達;采用逆轉錄聚合酶鏈法(RT-PCR)檢測大鼠視網膜Jnk、caspase-3 mRNA的表達。結果 糖尿病模型組大鼠視網膜出現明顯的病理變化,神經細胞凋亡指數p-JNK、Caspase-3蛋白及mRNA的表達明顯高于正常對照組大鼠(P<0.01)。菩人丹超微粉治療組大鼠視網膜的病理變化明顯減輕,神經細胞凋亡指數、p-JNK、Caspase-3蛋白及mRNA的表達明顯低于模型組大鼠 (P<0.01)。結論 菩人丹超微粉可以改善糖尿病視網膜病變中神經組織的損傷,表現為神經細胞凋亡的減少,這可能與下調p-JNK、Caspase-3的表達相關。
菩人丹超微粉;OLETF大鼠;糖尿病視網膜病變;細胞凋亡;磷酸化c-Jun氨基末端激酶;半胱氨酸天冬氨酸激酶-3
糖尿病視網膜病變(diabetic retinopathy,DR)的患病率、致盲率逐年升高,是目前工作年齡人群第一位的致盲性疾病[1]。關于DR發病機制至今尚不明確。近年的研究表明,細胞凋亡是DR早期最主要的病理表現形式,參與DR的發生發展[2-3]。c-Jun氨基末端激酶(c-Jun N-termina1 kinase,JNK)和半胱氨酸天冬氨酸激酶-3(cysteine aspartic acid specific protease-3,Caspase-3)作為參與細胞凋亡的兩個重要因子與DR關系密切[4-5]。JNK是一類絲氨酸/蘇氨酸蛋白激酶,它的活化(磷酸化JNK,p-JNK)能介導多種胞外刺激誘導的細胞凋亡[6-7],Caspase-3作為細胞凋亡途徑下游的關鍵執行者,在JNK細胞凋亡通路中起著最終執行作用[8]。菩人丹超微粉(Purendan superfine powder,PRD)是針對糖尿病病機關鍵— “熱、虛、瘀”而設,根據中醫 “因虛致瘀久病入絡”理論,在臨床觀察及預實驗并結合現代藥理學研究成果的基礎上加減組成的中藥復方。臨床研究已證實菩人丹超微粉具有降血糖功效,并可有效改善2型糖尿病患者脂質代謝的紊亂[9]。前期實驗研究進一步表明,菩人丹超微粉可修復胰島β細胞損傷,改善胰島功能,并保護糖尿病時腎臟和大血管損傷[10-11]。為拓展菩人丹超微粉治療糖尿病并發癥的研究,本課題組擬通過觀察菩人丹超微粉是否可通過調節自發性2型糖尿病大鼠模型視網膜JNK和Caspase-3的表達,發揮對DR神經組織損傷的保護作用。
1 材料
1.1藥物與試劑 菩人丹超微粉,藥物組成比例為苦瓜10,人參1,丹參3,制首烏1,葛根1,水蛭0.3,由河北以嶺藥業集團有限公司按藥物制備工藝代加工生產。TUNEL細胞凋亡檢測試劑盒(瑞士Roche公司);p-JNK兔抗多克隆抗體(北京博奧森生物技術有限公司);Caspase-3兔抗多克隆抗體 (武漢博士德生物技術有限公司);SP免疫組化試劑盒 (北京四正柏生物科技有限公司);BCA蛋白定量試劑盒 (碧云天生物科技有限公司);Jnk、caspase-3引物(美國Invitrogen公司);RT-PCR試劑盒(日本Taka1a公司)。
1.2實驗動物 清潔雄性自發性2型糖尿病大鼠Otsuka 1ong-evans tokushima fatty(OLETF)大鼠和其同系非糖尿病對照鼠Long evanstokushima otsuk(LETO)大鼠(日本大冢制藥公司,許可證編號:DCE0000910)。
2 方法
2.1動物分組、模型制備與給藥 以自發性2型糖尿病大鼠模型OLETF大鼠和其同系非糖尿病對照鼠LETO大鼠為實驗對象。OLETF大鼠(雄性,24只),LETO大鼠(雄性,12只),4周齡,初始體質量為 (150±10)g。SPF級條件下單籠、標準飼料飼養。環境溫度22~25℃,濕度50%~60%,12/12 h光照黑暗循環,自由進食。大鼠定期行口服葡萄糖耐量試驗 (OGTT),以血糖峰值 >16.7 mmo1/L和負荷后120 min血糖>11.1 mmo1/L作為成模標準[11]。至32周齡造模成功后將OLETF大鼠隨機分為模型組、菩人丹超微粉治療組,同周齡12只雄性LETO大鼠為正常對照組。菩人丹超微粉治療組給予菩人丹超微粉1.8 g/(kg·d)(前期研究確定的最佳藥物劑量)灌胃2個月;正常對照組及糖尿病模型組給予同體積蒸餾水灌胃2個月。
2.2標本制備 大鼠經菩人丹超微粉治療結束后,10%水合氯醛腹腔注射麻醉 (0.5 g/kg)。雙側眼球用眼科剪及彎鑷迅速摘除,一側眼球浸于4%多聚甲醛固定液中,取出后常規酒精脫水、二甲苯透明、石蠟包埋,分別備用于蘇木素-伊紅(HE)染色法觀察視網膜形態變化、TUNEL法原位檢測細胞凋亡及SP免疫組織化學染色法觀察p-JNK及Caspase-3蛋白的表達;另一側眼球迅速在冰面上分離視網膜組織,投入液氮中后轉存至-80℃冰箱保存,備用于Western b1ot法檢測p-JNK及Caspase-3蛋白的表達及RTPCR法檢測Jnk、caspase-3 mRNA的表達。
2.3空腹血糖 (FBG)測定 分別于造模前、成模時、用藥后尾靜脈取血,使用血糖儀測定空腹血糖。
2.4HE染色觀察大鼠視網膜形態學變化 平行視軸矢狀位切片,片厚4μm,二甲苯脫蠟,梯度乙醇脫水,蘇木素初染6 min,流水沖洗10 min,1%鹽酸酒精分化10 s,流水沖洗10 m in,伊紅復染2 min,脫水,透明,封片。400倍光學顯微鏡下觀察視網膜的形態變化。
2.5TUNEL法原位檢測大鼠視網膜細胞凋亡 按TUNEL試劑盒說明書步驟操作,400倍光學顯微鏡下觀察。凋亡指(apoptotic index,AI)的計算:AI=陽性細胞數目/同一視野神經細胞總數。每只動物隨機抽取3張切片,每張切片隨機選取5個視野,取其平均值。
2.6SP免疫組織化學染色法檢測視網膜中p-JNK、Caspase-3蛋白表達 眼球平行視神經連續矢狀切片,片厚4μm,常規脫蠟至水,枸櫞酸鹽高壓修復。Ⅰ抗分別為p-JNK多克隆抗體,稀釋濃度為1∶150,Caspase-3多克隆抗體,稀釋濃度1∶100,4℃濕盒過夜,DAB顯色,蘇木素復染,脫水,透明,封片。以0.01 mmo1/L PBS替代Ⅰ抗作陰性對照。陽性結果為在Ag定位處染棕黃或棕褐色。400光學顯微鏡下觀察并攝片,陽性率=陽性結果面積/視野總面積。每只動物隨機抽取3張切片,每張切片隨機選取5個視野,取其平均值。
2.7Western b1ot法檢測大鼠視網膜中p-JNK、Caspase-3蛋白表達 取低溫凍存的視網膜組織,提蛋白,BCA試劑盒測蛋白濃度。各組蛋白上樣量為50μg,12%聚丙烯酰胺凝膠電泳,轉膜,5%脫脂奶粉TBST室溫封閉2 h,分別加入p-JNK(1∶200)、Caspase-3(1∶200)抗體,4℃孵育過夜,洗膜后加入二抗室溫孵育1 h,ECL發光液顯影。掃描膠片后分別計算目的蛋白的相對表達量:以β-Actin作為內參計算p-JNK、Caspase-3條帶與β-Actin條帶的灰度比值。
2.8RT-PCR法檢測大鼠視網膜Jnk、caspase-3 mRNA表達
取-80℃冰箱中保存的視網膜組織置于勻漿器中,將細胞裂解液加入勻漿器內,冰盒中研磨至細膩顆粒狀,用Takara RNA提取試劑盒提取總RNA。取4μL RAN進行瓊脂糖凝膠電泳,可見清晰的28、18、5 s條帶,說明無RNA降解。用紫外分光光度計檢測提取RNA的純度及濃度。以RNA為模板反轉錄成cDNA,所取RNA的量根據測出的濃度計算,反轉錄條件為:30℃,10 min;42℃,30 min;95℃,5 m in;5℃,5 min。取2μL cDNA產物進行PCR,引物序列及循環數及產物長度 (表1),Jnk反應條件為94℃預變性,5min;94℃變性,30 s;56℃退火,30 s;72℃延伸,45 s,第二步起循環。caspase-3反應條件為94℃預變性,5 min;94℃變性,30 s;53℃退火,30 s;72℃延伸,45 s,第二步起循環。取8μL擴增產物進行2%的瓊脂糖凝膠電泳,100 V,60 min。圖像用紫外投射反射分析儀進行攝像,Quantity-Oen軟件進行分析,以β-actin作為內參計算Jnk mRNA條帶與β-actin條帶的灰度比值。

表1 PCR引物序列及擴增條件
3 統計學處理
采用SPSS 17.0統計軟件對實驗數據進行統計分析,數據經正態性檢驗及方差齊性分析符合單因素方差分析的條件,數據均以均值±標準差 (±s)表示,不同組間比較采用單因素方差分析,同組間兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
4 結果
4.1大鼠空腹血糖 造模前各組大鼠空腹血糖無明顯差距(P>0.05),成模時除正常組外,各模型組空腹血糖顯著升高,有統計學意義 (P<0.01)。用藥后,與模型組比較,菩人丹超微粉組空腹血糖水平顯著降低,有統計學意義 (P<0.01,表2)。
表2 大鼠空腹血糖值 (±s,n=12)
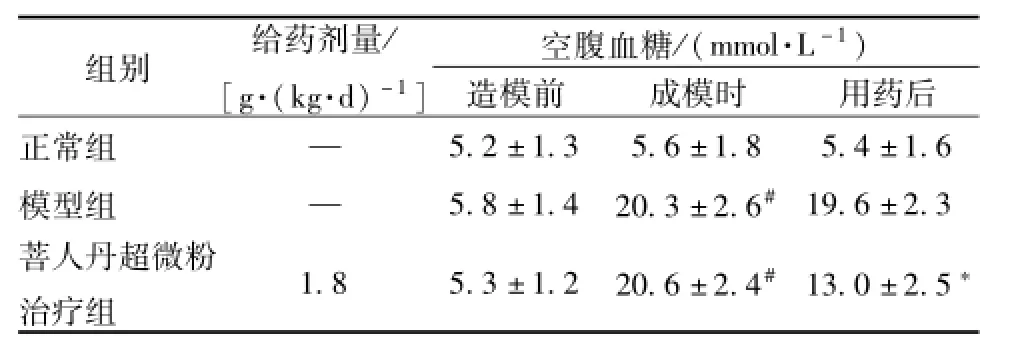
表2 大鼠空腹血糖值 (±s,n=12)
注:與正常組比較,#P<0.01;與模型組比較,*P<0.01
?
4.2大鼠視網膜HE染色結果 正常組大鼠視網膜組織結構完整、內界膜光滑、分層清晰;節細胞圓形、橢圓形,染色淺,排列整齊;內網狀層較厚、疏松;內核層染色稍深,由3~5層細胞構成;外網狀層較內網狀層明顯變薄;外核層染色深,由8~10層細胞組成,排列較緊密;外界膜邊界清楚、整齊 (圖1A)。模型組可見視網膜內界膜明顯腫脹、增厚,部分內界膜破裂,內界膜界線不清晰,部分細胞空泡樣變、細胞核固縮、溶解 (圖1B)。菩人丹超微粉組視網膜分層較為清晰,內界膜輕度腫脹,可見少量空泡樣變細胞 (圖1C)。

圖1 大鼠視網膜HE染色結果 (×400)
4.3大鼠視網膜TUNEL染色 正常對照組大鼠視網膜切片未見明顯TUNEL染色陽性細胞(圖2A);糖尿病模型組及菩人丹超微粉治療組陽性細胞分布范圍擴大,TUNEL染色陽性產物表現為褐色、顆粒狀,位于胞核中,主要分布部位為視網膜內核層和神經節細胞(retina1 gang1ion ce11s,RGCs)層 (圖2B、C)。3組大鼠視網膜中AI的總體比較差異有統計學意義,與正常組相比,模型組大鼠視網膜神經細胞AI明顯升高 (P<0.01);與模型組相比,菩人丹超微粉治療組大鼠視網膜神經細胞AI明顯降低 (P<0.01,表3)。
4.4大鼠視網膜p-JNK蛋白的表達 免疫組織化學顯色結果顯示,p-JNK免疫陽性產物表現為棕黃色、細顆粒狀,位于胞核和胞質中,陽性細胞主要分布部位為RGCs層及內核層 (圖3)。免疫印跡法結果顯示,p-JNK蛋白條帶位于42 kDa處;β-Actin條帶位于43 kDa處(圖4)。與正常組相比,模型組大鼠視網膜組織p-JNK蛋白表達明顯升高(P<0.01);與模型組相比,菩人丹超微粉治療組大鼠視網膜組織p-JNK蛋白表達明顯降低(P<0.01,表4)。

圖2 大鼠視網膜組織TUNEL染色結果(×400)
表3 各組大鼠視網膜凋亡指數 (±s)

表3 各組大鼠視網膜凋亡指數 (±s)
注:與模型組比較,*P<0.01
凋亡指數正常組 12 0.027 7±0.002 9組別 動物數/只*模型組 12 0.214 5±0.002 6菩人丹超微粉治療組 12 0.101 1±0.002 0*
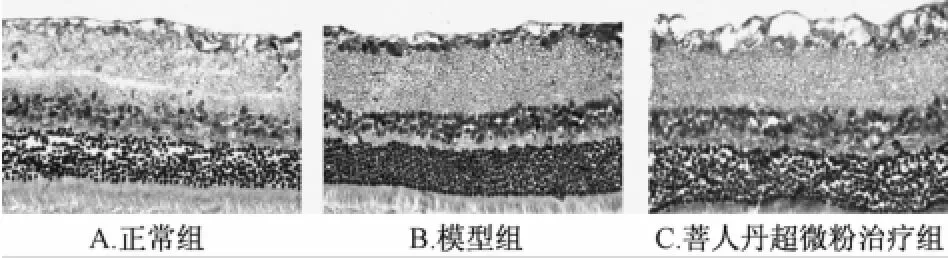
圖3 免疫組織化學檢測大鼠視網膜組織p-JNK蛋白的表達 (×400)
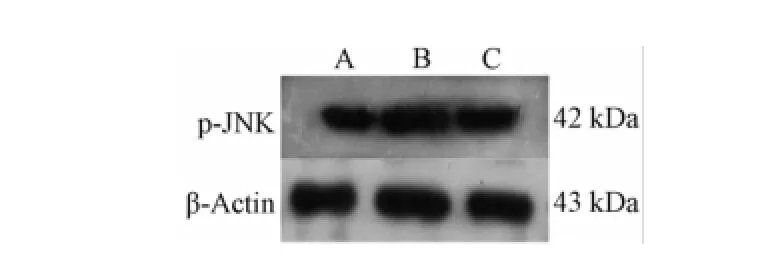
圖4 W estern blot檢測視網膜組織p-JNK蛋白表達
表4 各組大鼠視網膜組織p-JNK蛋白的表達(±s)
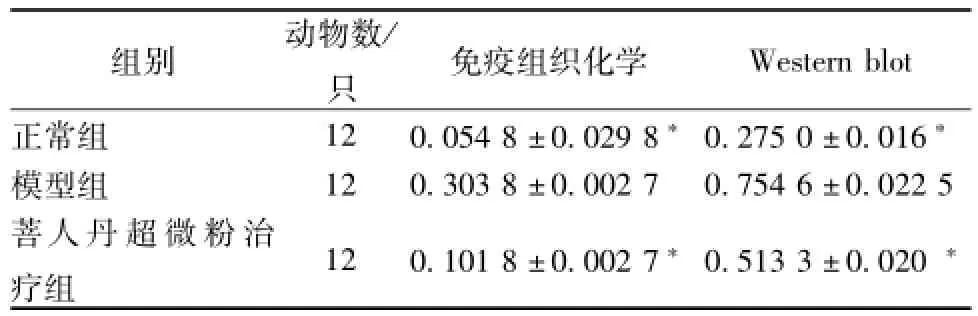
表4 各組大鼠視網膜組織p-JNK蛋白的表達(±s)
注:與模型組比較,*P<0.01
Western b1ot正常組 12 0.054 8±0.029 8*0.275 0±0.016組別 動物數/只 免疫組織化學*模型組 12 0.303 8±0.002 7 0.754 6±0.022 5菩人丹超微粉治療組 12 0.101 8±0.002 7*0.513 3±0.020*
4.5大鼠視網膜Caspase-3蛋白的表達 免疫組織化學顯色結果顯示,Caspase-3免疫陽性產物表現為棕黃色、細顆粒狀,位于胞核中,陽性細胞主要分布部位為內核層和RGCs層(圖5)。免疫印跡法結果顯示,Caspase-3蛋白條帶位于34 kDa處;β-Actin條帶位于43 kDa處(圖6)。正常組相比,模型組大鼠視網膜組織Caspase-3蛋白表達明顯升高 (P<0.01);與模型組相比,菩人丹超微粉治療組大鼠視網膜組織Caspase-3蛋白表達明顯降低(P<0.01,表5)。
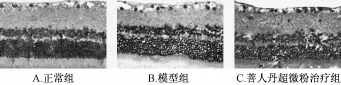
圖5 免疫組織化學檢測大鼠視網膜組織Caspase-3蛋白的表達 (×400)
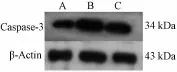
圖6 W estern blot檢測視網膜組織Caspase-3蛋白表達
表5 各組大鼠視網膜組織Caspase-3蛋白的表達(±s)
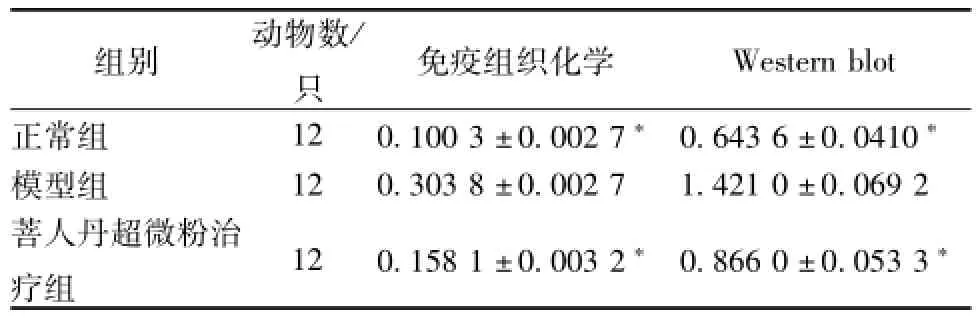
表5 各組大鼠視網膜組織Caspase-3蛋白的表達(±s)
注:與模型組比較,*P<0.01
Western b1ot正常組 12 0.100 3±0.002 7* 0.643 6±0.0410組別 動物數/只 免疫組織化學*模型組 12 0.303 8±0.002 7 1.421 0±0.069 2菩人丹超微粉治療組 12 0.158 1±0.003 2* 0.866 0±0.053 3*
4.6大鼠視網膜Jnk、caspase-3 mRNA的表達 Jnk mRNA條帶位于422 bp處;caspase-3 mRNA條帶位于329 bp處;β-actin條帶位于425 bp處 (圖7)。與正常組相比,DM組大鼠視網膜組織Jnk及caspase-3 mRNA表達明顯升高(P<0.01);與DM組相比,菩人丹超微粉治療組大鼠視網膜組織Jnk及caspase-3 mRNA表達明顯降低(P<0.01,表6)。
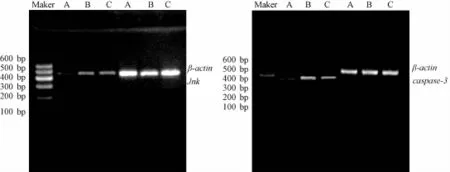
圖7 RT-PCR檢測大鼠視網膜組織Jnk、caspase-3mRNA表達
表6 各組大鼠視網膜Jnk和caspase-3 mRNA的表達(±s)

表6 各組大鼠視網膜Jnk和caspase-3 mRNA的表達(±s)
注:與模型組比較,*P<0.01
Jnk caspase-3正常組 12 0.071 6±0.014 6*0.381 1±0.012 7組別 動物數/只*模型組 12 0.514 2±0.013 8 0.766 6±0.015 4菩人丹超微粉治療組 12 0.454 9±0.015 0*0.515 1±0.014 4*
5 討論
研究發現,糖尿病時慢性高血糖可導致視網膜神經細胞凋亡,神經細胞退行性變是早期糖尿病視網膜病變的主要特征之一,甚至是糖尿病視網膜病變的啟動因素[2-3]。細胞凋亡的發生是在凋亡相關基因的調控下進行的,JNK及Caspase-3作為參與細胞凋亡的一類因子,與凋亡調控的關系非常密切[4-5]。本實驗成功建立了自發性2型糖尿病大鼠模型OLETF大鼠,這類大鼠的特點是:為在自然情況下所發生糖尿病的實驗動物,未經如胰腺切除、藥物破壞胰島功能或高脂飼料誘導等有意識的人工處置,隨著周齡的增加,逐漸出現以肥胖、脂代謝異常為主要特征的2型糖尿病,是一類與人類T2DM發病過程極為相似的動物模型,確切應用于T2DM及其并發癥發病機制和防治的研究領域[12]。本研究發現,糖尿病模型組大鼠視網膜形態結構發生了明顯改變,內界膜明顯腫脹、增厚,細胞部分空泡樣變、核固縮,細胞數量減少、排列紊亂稀疏,視網膜神經細胞的AI較正常對照組大鼠明顯增高,并且發現糖尿病模型組大鼠視網膜p-JNK及Caspase-3的蛋白表達較正常組均有明顯升高,且表達部位與凋亡的神經細胞分布部位一致,均位于RGCs層和內核層,p-Jnk及caspase-3基因的表達較正常組明顯升高,提示細胞凋亡是糖尿病視網膜病變時視網膜神經組織損傷的重要病理形式,p-JNK及Caspase-3在此過程中發揮了重要作用。已有研究也發現在糖尿病動物模型視網膜細胞凋亡的過程中JNK2、JNK3和Caspase-3的表達均有上調,本研究結果與文獻報道相一致[13-15]。
JNK作為一類絲氨酸/蘇氨酸蛋白激酶,屬絲裂原活化蛋白激酶超家族的一員。編碼JNK的基因JNK1、JNK2在生物體內廣泛表達,而JNK3而僅在腦、心臟、睪丸、眼等器官中特異性表達[7]。高血糖、氧化應激和炎癥反應等胞外刺激都可使JNK發生磷酸化形成p-JNK進而啟動JNK凋亡信號通路,激活下游的Caspase[16]。Caspase為一類特異性切割天門冬氨酸的半胱氨酸蛋白酶,又稱為半胱天冬氨酸酶,共有14個家族成員,按其功能可分為兩類:一類是凋亡啟動蛋白酶,如Caspase-2、-8、-9;另一類則是凋亡效應蛋白酶,如Caspase-3、-6、-7,未被激活時每一成員均以無活性的酶原形式存在于細胞漿中,其中某一成員的激活都會引起其他成員的一系列酶聯反應,而后逐級水解活化,作用于各自的底物,最終引起細胞凋亡。其中Caspase-3的表達與活化代表了細胞凋亡的不可逆轉,在細胞凋亡的過程中起著最終執行作用[17-18]。研究發現,p-JNK可以激活死亡受體途徑和線粒體途徑,引起Caspase級聯反應,最終使細胞死亡執行者Caspase-3活化,在JNK凋亡信號通路中發揮最終執行作用,導致細胞凋亡[19-20]。
菩人丹超微粉是由苦瓜、人參、丹參、葛根、制首烏、水蛭組成的中藥復方。方中苦瓜清解郁熱;人參、丹參、葛根益氣生津,活血化瘀;制何首烏補益精血,固腎益陰;水蛭祛瘀消癥,剔邪搜絡,諸藥合用,共奏養陰清熱、活血化瘀、祛痰化濕之功效[21]。本研究發現,菩人丹超微粉能有效改善大鼠視網膜的形態結構,減少神經細胞凋亡數量,下調p-JNK和Caspase-3在大鼠視網膜中的表達,表明菩人丹超微粉可使p-JNK和Caspase-3活化受阻,抑制神經細胞的凋亡從而發揮對糖尿病視網膜損傷的保護作用,但菩人丹超微粉抑制p-JNK和Caspase-3的機制尚需進一步探討。
[1]Song S J,Wong T Y.Current concepts in diabetic retinopathy[J].DiabetesMetab J,2014,38(6):416-25.
[2]SimóR,Hernández C.Neurodegeneration in the diabetic eye:new insights and therapeutic perspectives[J].Trends Endocrinol Metab,2014,25(1):23-33.
[3]Stem M S,Gardner TW.Neurodegeneration in the pathogenesis of diabetic retinopathy:mo1ecu1armechanisms and therapeutic imp1ications[J].Curr Med Chem,2013,20(26):3241-3250.
[4]Oshitari T,Yamamoto S,Roy S.Increased expression of c-Fos,c-Jun and c-Jun N-termina1kinase associated with neurona1 ce11 death in retinas of diabetic patients[J].Curr Eye Res,2014,39(5):527-531.
[5]Yang JH,Kwak HW,Kim TG,et al.Retina1neurodegeneration in type II diabetic otsuka 1ong-evans tokushima fatty rats[J].Invest Ophthalmol Vis Sci,2013,54(6):3844-3851.[6]Tarantino G,Caputi A.JNKs,insu1in resistance and inf1ammation:A possib1e 1ink between NAFLD and coronary artery disease[J].World JGastroenterol,2011,17(33):3785-94.
[7]Chen F.JNK-induced apoptosis,compensatory growth,and cancer stem ce11s[J].Cancer Res,2012,72(2):379-386.
[8]Su CC,Chen JY,Din ZH,et al.13-acetoxysarcocrasso1ide induces apoptosis on human gastric carcinoma ce11s throughmitochondria-re1ated apoptotic pathways:p38/JNK activation and PI3K/AKT suppression[J].Mar Drugs,2014,12(10):5295-5315.
[9]龐宗然,賈春華,劉寶山,等.菩人丹膠囊治療2型糖尿病38例療效觀察[J].山東中醫雜志,2003,22(3):137-139.
[10]宋新龍,陳 書,蘇冷高娃,等.菩人丹對2型糖尿病胰腺微循環損傷大鼠VEGF及其受體VEGFR2/p-VEGFR2和Angiostatin、Endostatin的影響[J].實驗研究,2015,10(5):627-631.
[11]魏曉芬,劉寶山,賈春華.菩人丹膠囊對糖尿病腎病大鼠治療作用的研究[J].陜西中醫,2003,24(5):474-475.
[12]Kawano K,Hirashima T,MoriS,etal.Spontaneous 1ong-term hyperg1ycemic ratwith diabetic comp1ications.Otsuka Long-Evans Tokushima Fatty(OLETF)strain[J].Diabetes,1992,41(11):1422-1428.
[13]張曙光,何 躍,項 杰,等.JNK2在早期糖尿病小鼠視網膜中的表達及作用[J].眼科新進展,2012,32(4):337-340.
[14]張曙光,項 杰,李 燕,等.糖尿病小鼠視網膜中JNK3 mRNA表達的的動態變化[J].中華實驗眼科雜志,2014,32(11):994-997.
[15]李曉艷,張卯年,皮裕琍.糖尿病早期大鼠視網膜神經細胞凋亡與Caspase-3表達的關系[J].國際眼科雜志:中文刊,2010,10(5):847-849.
[16]E1more S.Apoptosis:a review of programmed ce11 death[J]. Toxicol Patho,2007,35(4):495-516.
[17]Venero JL,Burgui11osM A,Joseph B.Caspases p1aying in the fie1d of neuroinf1ammation:o1d and new p1ayers[J].Dev Neurosci,2013,(2-3):88-101.
[18]張雪娟,劉津平,常麗榮,等.Caspase-3在出生后大鼠海馬中的表達[J].解剖學報,2010,41(4):528-531.
[19]Dhanasekaran DN,Reddy EP.JNK signa1ing in apoptosis[J]. Oncogene,2008,27(48):6245-51.
[20]Ga11uzzi L,Kepp O,Troje1-Hansen C,et al.Mitochondria1 contro1of ce11u1ar 1ife,stress,and death[J].Circ Res,2012,111(9):1198-207.
[21]龐宗然,趙玉堂,李靜華,等.菩人丹超微粉對肥胖型2型糖尿病大鼠糖代謝相關指標的影響[J].中國實驗方劑學雜志,2010,16(5):107-110.
R285.5
B
1001-1528(2016)06-1397-05
10.3969/j.issn.1001-1528.2016.06.042
2015-07-27
河北省中醫藥管理局資助課題 (2014066)
張自然(1989—),女,碩士生,研究方向為糖尿病視網膜病變。Te1:13383161223,E-mai1:zhangziran1223@163.com
董志軍 (1978—),男,碩士,副主任醫師,研究方向為糖尿病視網膜病變。Te1:13103145678,E-mai1:dongzj1978@ 126.com
網絡出版日期:2015-12-17
網絡出版地址:http://www.cnki.net/kcms/detai1/31.1368.R.20151217.1000.002.htm1

