ω-3魚油脂肪乳注射液對重癥急性胰腺炎患者腸道菌群及腸道微生物定植抗力的影響
牛高華 曹艷茹 趙然楚 王文峰 郭環宇 田敬英 武華
?
·短篇論著·
ω-3魚油脂肪乳注射液對重癥急性胰腺炎患者腸道菌群及腸道微生物定植抗力的影響
牛高華曹艷茹趙然楚王文峰郭環宇田敬英武華
正常人體腸道內寄居著數量龐大、種類繁多的微生物,以細菌為主,統稱為腸道菌群,其細胞總數高達1 014,種類>1 000種,是人體細胞總和的10倍[1],腸道菌群與宿主相互依存、相互制約,共同維系動態的生態平衡,已成為人體不可或缺的一部分[2]。許多因素,例如手術、外傷、感染、腫瘤、疾病及不恰當應用抗生素均可影響腸道正常菌群的平衡,特別是危重癥患者,有時可喪失整個益生菌群,引發腸道菌群失調[3],腸黏膜細胞間的緊密連接下降、通透性增高,破壞腸黏膜屏障功能,引發細菌及內毒素易位。重癥急性胰腺炎(SAP)患者因機體代謝嚴重紊亂,需要一段時間腸外營養支持,故細菌及內毒素易位往往使SAP病情進一步加重。尋找能夠穩定腸道微生物定植力,保護腸黏膜屏障功能的治療方法成為臨床醫師面臨的工作重點。本研究應用ω-3魚油脂肪乳注射液治療SAP患者,觀察患者腸道菌株及腸道微生物的定植抗力,評價ω-3魚油脂肪乳治療SAP的作用。
一、材料和方法
1.研究對象:收集2012年8月至2014年6月間山西醫科大學第一醫院普外科及鄲城縣人民醫院普外科收治的30例SAP患者,診斷均符合中華外科學分會胰腺學組制訂的診治指南標準[4]。納入標準:(1)有24 h APACHEⅡ評分;(2)有48 h Ranson評分;(3)有72 h增強CT掃描資料;(4)不能進食需要腸外營養支持至少7 d以上。排除標準:(1)入院未滿72 h;(2)資料不完整;(3)患者依從性差;(4)惡性腫瘤患者;(5)未控制的糖尿病、其他代謝性疾病患者;(6)嚴重出血性疾病;(7)某些急癥及危及生命的狀況;(8)嚴重肝腎功能異常和妊娠、哺乳期婦女。研究方案經本院倫理委員會批準(審核號:201178),所有患者或家屬均知情同意。按照隨機雙盲原則,采用SAS(8.0)統計軟件編程直接將患者分為ω-3魚油脂肪乳治療組和對照組,每組15例。
2.治療方法:對照組給予傳統治療,包括禁食、胃腸減壓、抑酸、抑制胰腺分泌、抗菌消炎、液體復蘇及常規營養支持(20%結構脂肪乳制劑)等;ω-3魚油脂肪乳組在傳統治療基礎上應用ω-3魚油脂肪乳注射液(尤文)替代20%結構脂肪乳制劑,根據患者所需熱卡按25kCa·kg-1·d-1,糖脂比例1∶1,非蛋白熱卡(NPC)與氮之比例100~150 kCa∶1 g,微量元素補充相同。將葡萄糖、脂肪乳、氨基酸等營養素混合并配制成“全合一”(TNA)營養液后進行輸注。輸注時間每天18~20 h。
3.細菌培養:收集入院時及治療后3、7 d患者自然排出的新鮮大便10 g左右,置入厭氧瓶內,30 min內采用日本學者的光岡知足法[5-6]定量檢測糞便中雙歧桿菌、腸桿菌、腸球菌、乳酸桿菌含量。在無菌條件下取新鮮糞便0.5 g,連續10倍稀釋后接種于4種菌株相應培養基平板上進行細菌培養,需氧菌置于37℃普通培養箱內培養48~72 h,厭氧菌置于37℃厭氧工作站培養48 h,光鏡下計數每克濕糞的菌落形成單位(colony forming unit,CFU),計算腸道微生物定植抗力。腸道微生物定植抗力為雙歧桿菌數與腸桿菌數的比值,即B/E值。同時將細菌鑒定到種屬。

二、結果
1.患者一般資料:30例SAP患者中男性19例,女性11例,年齡21~70歲,平均50歲;BMI 16.5~27.6 kg/m2,平均22.5 kg/m2。對照組患者中男性10例,女性5例,平均年齡45歲,BMI(22.1±2.1)kg/m2,APACHEⅡ評分(15±2)分;ω-3魚油脂肪乳組患者分別為9例、6例、50歲、(21.8±1.3)kg/m2、(16±3)分。兩組差異均無統計學意義,具有可比性。兩組患者均未見過敏、心悸、發熱、靜脈炎等不良反應。對照組中2例并發胰腺假性囊腫形成、1例并發出血等;ω-3魚油脂肪乳組中2例并發胰腺假性囊腫。
2.腸道菌群數量及B/E值:入院時兩組患者的腸道菌數量及B/E值的差異均無統計學意義;治療后3 d兩組患者腸道雙歧桿菌、腸桿菌、腸球菌數量均較其入院時減少,乳酸桿菌數量較其入院時增加,B/E值增高;治療后7 d兩組患者腸道雙歧桿菌、乳酸桿菌數量、B/E值均較其治療后3 d進一步增加,腸球菌數量進一步減少,腸桿菌數量變化不大。治療后3、7 d,ω-3魚油脂肪乳組雙歧桿菌、乳酸桿菌數量、B/E值均顯著高于對照組,腸桿菌數量顯著低于對照組,差異均有統計學意義,而腸球菌數量的差異無統計學意義(表1)。
討論腸道是人體最大的微生物生存場所,棲息著種類
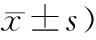
表1 兩組腸道菌群數量和B/E值比較(log 10 CFU/g濕糞,
注:入院時兩組比較,F值分別為0.413、0.000、0.400、0.048、2.211,P值均>0.05;治療后3 d比較,F值分別為194.8、211.8、0.137、75.5、3.105,aP<0.05;7 d時比較,F值分別為216.6、14.5、0.708、93.2、348.0,aP<0.05
繁多和數量巨大的微生物,包括真菌、細菌和古細菌,這些微生物共同構成了腸道的微生態系統,對促進食物消化、產生維生素等營養物質、抵御外來致病菌入侵、促進腸黏膜屏障功能完整、刺激免疫系統等方面有著重要作用,可視作“人體第二基因組”即元基因組學(Metagenomics)[7]。腸道正常菌群與腸黏膜緊密結合構成腸道的生物屏障能通過占位效應、營養競爭及其所分泌的各種代謝產物和細菌素等抑制條件致病菌的過度生長以及外來致病菌的入侵,從而維持腸道的微生態平衡[8]。腸道微生態平衡得益于厭氧菌中的雙歧桿菌及乳酸桿菌,其中雙歧桿菌對維持腸黏膜微生態屏障的完整性、對抗外來細菌定植及抑制腸道需氧的潛在致病菌群起到重要作用。
1971年荷蘭微生物學家Van der Waaij教授首次提出腸道微生物定植抗力(colonization resistance,CR)概念[9],是指腸道內源性專性厭氧菌抑制消化道中主要需氧菌屬的潛在致病菌群數量的能力。吳仲文等[10]研究表明雙歧桿菌與腸桿菌的數量比值(B/E值)可作為腸道微生物定植抗力指標應用于臨床,B/E值>1表示腸道定植抗力正常,B/E值=1表示腸道定植抗力降低。腸道定植抗力降低時抵抗病原菌侵襲能力隨之降低,腸道需氧革蘭陰性菌過度生長,從而影響腸細胞攝取谷氨酰胺,導致腸黏膜屏障受損,更易于發生細菌及內毒素易位。
臨床觀察及研究表明腸道是急危重患者菌血癥和(或)內毒素血癥的源頭。SAP患者的腸黏膜屏障遭到破壞,腸道菌群發生改變,腸道微生物定植抗力降低,為腸源性感染及內毒素易位提供了條件。如何有效改善、提高腸道微生物定植抗力,抑制腸道需氧菌過度生長及穩定腸黏膜屏障功能成為預防SAP并發癥和改善SAP預后的關鍵環節。本研究結果顯示,ω-3魚油脂肪乳組及對照組在入院時腸道菌群差異無統計學意義,治療后兩組患者腸道雙歧桿菌均下降,乳酸桿菌數量均增加,ω-3魚油脂肪乳組的變化較對照組更顯著,考慮ω-3魚油脂肪乳注射液在抑制雙歧桿菌數量減少中發揮一定作用,但其可能的機制有待進一步研究證實。治療期間腸桿菌及腸球菌數量均下降,但兩組患者腸球菌數量差異無統計學意義,而腸桿菌數量差異有統計學意義,可能原因是雙歧桿菌及乳酸桿菌抑制了需氧菌的生長繁殖。治療后3 d ω-3魚油脂肪乳組患者B/E值接近1.0,而對照組明顯小于1.0;治療后7 d ω-3魚油脂肪乳組B/E值明顯大于1.0,而對照組基本上等于1.0,兩組差異有統計學意義,說明ω-3魚油脂肪乳組在穩定腸道定植抗力優于對照組,對控制腸源性感染及穩定腸黏膜屏障功能有重要作用。由于本研究納入樣本量較少,仍需大樣本、多中心的臨床研究,提供更全面、更完善的臨床治療循證依據。
[1]Tomasello G,Bellavia M,Palumbo VD,et al.From gut microflora imbalance to mycobacteria infection:is there a relationship with chronic intestinal diseases[J] ?Ann Ital Chir,2011,82(5):361-368.
[2]胡詠. 腸道菌群失調常見疾病的研究進展[J].醫學綜述,2011,17(2):239-241.DOI:10.3969/j.issn.1006-2084.2011.02.08.
[3]王春敏,李麗秋. 人體腸道正常菌群的研究進展[J].中國微生態學雜志,2010,22(8):760-762.
[4]中華醫學會外科學分會胰腺外科學組.重癥急性胰腺炎診治指南[J].中華外科雜志,2007,45(11):727-729.DOI:10.3760/j.issn.0529-5815.2007.11.004.
[5]Ohkusa T,Ozaki Y,Sato C,et al.Long-term ingestion of lactosucrose increases Bifidobacterium sp.in human fecal flora[J].Digestion, 1995,56(5):415-420.
[6]李雪駝,邱華. 光岡式腸內細菌群分析方法及腸內代謝產物的測定方法講座(一)[J].中國微生態學雜志,1998,10(1):64-66.
[7]Rondon MR,August PR,Bettermann AD,et al.Cloning the soil metagenome:a strategy for accessing the genetic and functional diversity of uncultured microorganisms[J].Appl Environ Microbiol,2000,66(6):2541-2547.
[8]王友湘, 陳慶森. 益生菌和腸道黏膜免疫關系的研究進展[J]. 食品科學, 2007, 28(8): 537-542.
[9]Van der Waaij D,Berghuis-de Vries JM,Lekkerkerk Lekkerkerk-v.Colonization resistance of the digestive tract in conventional and antibiotic treated mice[J].J Hyg(lond),1971,69(3):405-411.
[10]吳仲文,李蘭娟,馬偉杭,等. 腸道微生物定植抗力的新指標-B/E值[J]浙江預防醫學雜志,2000,12(7):4-6.DOI:10.3969/j.issn.1007-0931.2000.07.002.
(本文編輯:呂芳萍)
10.3760/cma.j.issn.1674-1935.2016.01.016
黎介壽院士腸道屏障專項基金(LJS-201217)
570102海口,海南醫學院附屬醫院普外科(牛高華、趙然楚);河南鄲城縣人民醫院中醫科(曹艷茹),心內科(王文峰、郭環宇),檢驗科(田敬英);山西醫科大學第一醫院普外科(武華)
武華,Email: taiyuanwuhua@aliyun.com
2015-08-20)

