嗜熱菌β-葡萄糖苷酶A基因的克隆表達及轉化大豆異黃酮糖苷
王銳麗,孫 偉,薛業敏
(1.信陽農林學院 生物與制藥工程學院,河南 信陽 464000;2.南京師范大學 金陵女子學院,江蘇 南京 210097)
嗜熱菌β-葡萄糖苷酶A基因的克隆表達及轉化大豆異黃酮糖苷
王銳麗1,孫偉1,薛業敏2
(1.信陽農林學院 生物與制藥工程學院,河南 信陽 464000;2.南京師范大學 金陵女子學院,江蘇 南京 210097)
對嗜熱厭氧乙醇菌(Thermoanaerobacter ethanolicus)JW200基因組DNA中β-葡萄糖苷酶A基因(Te-BglA)進行PCR擴增,構建重組質粒pET-20b-Te-BglA,并對純化的重組酶Te-BglA的酶學性質和動力學參數進行研究。結果表明,基因Te-BglA在Escherichia coli細胞中成功表達,獲得重組酶Te-BglA,該酶的最適溫度和pH值分別為80℃和7.0。以對硝基苯酚-β-葡萄糖苷(pNPG)為底物時,Km值為(0.78±0.02)mmol/L,Kcat/Km值為(6.86±0.16)×104L/(mol·s);以天然底物水楊苷為底物時,Km值為(5.18±0.10)mmol/L,Kcat/Km值為(2.04±0.02)×104L/(mol·s),兩者比較可知,重組酶Te-BglA表現出對pNPG更好的親和力和更高的催化效率常數。該酶在80℃保溫1 h后相對于冰浴中(未保溫)的酶活仍有70.1%的殘留,在pH 4.5~8.0區間仍保持較高的pH穩定性。酶解大豆粉的結果表明,重組酶Te-BglA在80℃作用3 h后,大豆黃素和染料木素的產量分別達到35.9 mg/g和59.1 mg/g。
β-葡萄糖苷酶;酶學性質;大豆異黃酮糖苷;苷元
大豆異黃酮因具有抗腫瘤作用、緩解更年期綜合征、抗輻射、延緩衰老等功效而成為國內外研究熱點[1-3]。目前研究發現的12種大豆異黃酮根據結構的不同分為兩大類:游離型苷元(染料木素、大豆素和黃豆黃素,占有比例少)和結合型糖苷,約占總量的97%~98%。藥理學研究發現,大豆異黃酮的作用特點與虎仗中的白藜蘆醇苷等中藥類糖苷類似[4-6],即被人體腸道吸收的是它的苷元形式,糖苷形式必須轉化為相應的苷元才能真正發揮藥效。常用的轉化方法有酸水解法、微生物發酵法和酶水解法等。酸水解雖然高效,但污染環境。大豆異黃酮糖苷水解酶(β-葡萄糖苷酶)水解或相關微生物發酵因條件溫和而成為一種理想的轉化途徑[7-9]。雖有很多來源于細菌或真菌轉化大豆異黃酮糖苷β-葡萄糖苷酶的報道,但有關耐熱性高效水解糖苷的β-葡萄糖苷酶的報道卻很少。耐熱性酶在生物轉化過程中具有減少污染、加快反應速度、提高底物溶解度和易于大規模生產等優勢。SUZUKI H等[10]研究發現大豆根含β-葡萄糖苷酶是對異黃酮糖苷專一性最高的,但該酶穩定性不高。來源于嗜熱菌ThermoanaerobacterpseudethanolicusATCC 33223的β-葡萄糖苷酶A具有很好的轉糖苷活性和熱穩定性[11]。嗜熱厭氧乙醇菌(Thermoanaerobacter ethanolicus)JW200菌株與T.pseudethanolicusATCC 33223屬于同屬不同種的菌株,為獲得具有高熱穩定性和高效轉化大豆異黃酮糖苷的β-葡萄糖苷酶,本研究根據GenBank公布的T.pseudethanolicusATCC 33223的BglA基因序列設計引物,利用基因工程的方法實現T.ethanolicusJW200的β-葡萄糖苷酶A在大腸桿菌中的重組表達,并對重組酶(Te-BglA)的酶學性質、動力學參數和酶解大豆粉中大豆異黃酮糖苷作用進行研究,為β-葡萄糖苷酶A的工業應用提供理論基礎。
1 材料與方法
1.1材料與試劑
嗜熱厭氧乙醇菌(T.ethanolicus)JW200由美國佐治亞大學微生物系分離;大腸桿菌(Escherichia coli)DH10B(用于質粒擴增和分子克隆等過程)、E.coliJM109(DE3)(作為目的基因的表達宿主):均購于普洛麥格生物技術有限公司。
限制酶XbaⅠ、XhoⅠ:日本TAKARA公司;水楊苷(salicin)、對硝基苯酚-β-D-葡萄糖苷(pNPG)、染料木素(genistein,G)、染料木苷(gensitin,Gin)和大豆黃苷(daidzin,Din):美國Sigma公司;丙二酰基染料木苷(6-malonyl-gensitin,M-Gin)、大豆黃素(daidzein,D)、丙二酰基大豆黃苷(6-malonyl-daidzin,M-Din):伊普瑞斯科技有限公司。
液體LB培養基:胰蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L。
1.2儀器與設備
Hybaid聚合酶鏈反應(polymerasechainreaction,PCR)擴增儀:美國Thermo公司;MicroPulser基因導入電穿孔儀:美國Bio-Rad公司;Scientific Sorvall Stratos高速冷凍離心機:美國Thermo公司;1200系列高效液相色譜(high-performance liquid chromatography,HPLC)儀:美國Agilent公司;DYCP-31CN瓊脂糖水平電泳儀:北京新諾立華儀器有限公司。
1.3方法
1.3.1重組質粒pET-20b-Te-BglA的構建
根據GenBank公布的海棲熱袍菌(Thermotoga maritime)MSB8基因組序列上的BglB基因序列和Thermoanaerobacter pseudethanolicusATCC 33223的BglA基因序列設計相應引物P1:5′GCTCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATACATATGATAAAATTT CCAAAAGA3′和引物P2:5′CCCCTCGAGCTCAATAGA ATTTTTCTGT3′,以T.ethanolicusJW200基因組為模板進行PCR擴增。PCR擴增參數設定為:先在95℃變性5 min,加Pyrobest DNA聚合酶1 μL;然后94℃變性30 s,52℃退火40s,72℃延伸2min,循環30次后,72℃保溫10min。PCR產物經回收柱純化后用XbaⅠ和XhoⅠ雙酶切,插入到用XbaⅠ和XhoⅠ雙酶切后的質粒pET-20b中,于16℃連接過夜,將連接液電轉化感受態細胞E.coliDH10B。挑取陽性克隆,提取質粒,用雙酶切驗證。送至上海美吉生物技術公司測序,正確的轉化子命名為pET-20b-Te-BglA。
1.3.2重組酶的表達和純化
將重組質粒pET-20b-Te-BglA電轉化于E.coliJM109(DE3),挑取單菌落接入含氨芐霉素(Ampicillin,Amp)抗性的液體LB培養基中,37℃培養過夜。然后以1.5%接種量接入到750mL含Amp抗性液體LB培養基中,振蕩培養至OD600nm達0.8左右加入異丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)至濃度0.05 mmol/L,繼續誘導培養5 h后,離心,收集細胞。用Rapid Affinity Purification Kit中的結合緩沖液懸浮細胞,經高壓破碎,13 000 r/min離心20 min,取上清液于70℃熱處理20 min,離心得粗酶液。粗酶液再經Ni2+親和層析純化,快速提取法按Novagen的產品說明進行,以每管1mL收集酶活的峰值部分,純化的酶液采用十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)檢測純度。
1.3.3重組酶活性測定
β-葡萄糖苷酶活性由底物pNPG釋放對硝基苯酚(pNP)的量確定,采用分光光度法[10]。一個酶活力單位(U)定義:在一定反應條件下,1 min內催化產生1 μmol pNP所需的酶量。
1.3.4重組酶的酶學性質[11]
最適反應溫度的測定:將重組酶液pH值調節為6.2[11],在30~95℃范圍內每隔5℃,反應10 min后測定β-葡萄糖苷酶A酶活,以最高酶活為100%,計算相對酶活。
溫度穩定性的測定:將重組酶置于最適pH條件下,在65~95℃范圍內每隔5℃的溫度條件下保溫1 h,然后加底物于最適溫度和最適pH條件下測定其活性。以保存于冰浴中(未保溫)的酶活性為100%,計算酶在不同溫度保溫1 h后的殘留活性,并制作重組酶溫度穩定性曲線。
最適pH的測定:將重組酶液置于不同pH條件下,于最適溫度條件下測定其活性,以最高酶活為100%,計算相對酶活性。
pH穩定性的測定:將重組酶置于20 μL的100 mmol/L不同pH的鄰苯二甲酸氫鉀-咪唑緩沖液中,于37℃保溫1 h,冷卻后補加相應的底物和緩沖液達到200 μL,再于最適條件測定其活性。以保存于冰浴中(未保溫)的酶活性為100%,計算酶在不同pH保溫1 h后的殘留活性,制作重組酶pH穩定性曲線。
1.3.5動力學參數的測定
用pH 7.0鄰苯-咪唑緩沖液配制濃度為1.0~10 mmol/L的水楊苷(salicin)作為底物,反應體系為100 μL,包括10 μL不同濃度的水楊苷,酶液10 μL,其余用緩沖液補足。80℃下反應10 min,取出,加75 μL 3,5-二硝基水楊酸(3,5-dinitrosalicylicacid,DNS),煮沸5min,冰水冷卻,加1075μL水,混勻,在波長520 nm處測定吸光度值以檢測葡萄糖的生成量。配制濃度為0.2~2.0 mmol/L的pNPG作為底物,反應體系為200μL,包括10μLpNPG,酶液10μL,其余用緩沖液補足,于80℃反應5min,冰水冷卻后加入600 μL 1 mol/L的Na2CO3溶液終止反應并顯色,在波長410 nm處測定吸光度值以檢測pNP的生成量。然后采用Lineweaver-Burk雙倒數作圖法,計算重組酶的米氏常數(Km)、最大反應速度(Vmax)、酶的轉換數(Kcat)(Kcat=最大反應速度/蛋白摩爾數)、和催化效率常數(Kcat/Km)等。其中,Km值越小表示酶的親和力越好;Kcat/Km值越大表示酶的催化效率越高。
1.3.6重組酶Te-BglA轉化大豆異黃酮糖苷大豆粉的酶解試驗
稱取0.1 g脫脂大豆粉,以料液比1∶10(g∶mL)溶于pH 7.0,250 mmol/L的磷酸緩沖液中,加酶量為50 U/g,然后于65℃分別酶解10 min和3 h,在冰浴條件下終止反應,離心,收集上清,冷凍干燥。經干燥后的上清干粉與沉淀分別用1mL80%甲醇重懸,30℃提取2 h,13 000 r/min離心20 min,取上清液,經微孔濾膜過濾后取20 μL進行HPLC分析。以不加酶的試驗組為對照組。
重組酶Te-BglA轉化大豆異黃酮糖苷大豆粉的活性是由底物Gin、M-Gin釋放出G的量,由底物Din、M-Din釋放出D的量來確定,采用高效液相色譜(high performance liquid chromatography,HPLC)法[12]分析。色譜條件:Agilent HC-C18色譜柱(250 mm×4.6 mm,5 μm);檢測波長260 nm;柱溫度30℃;流動相A:0.1%的磷酸水溶液,流動相B:乙腈,45 min內,流動相A由85%降至65%;流速:0.8 mL/min[13]。一個酶活單位(U)定義為:在該條件下,1 min內催化產生1 μmol的苷元類物質(G、D)所需要的酶量。以峰面積(A)與標準品(G、D)的量(B)作標準曲線,分別得線性回歸方程A1=11.44B1+317.94(R2=0.999 6)和A2=14.15B2+541.49(R2=0.999 3)。
以反應前后峰面積大小的相對比值表示大豆異黃酮糖苷的轉化率,異黃酮苷元產量用100 g脫脂大豆粉產生的異黃酮苷元的質量(mg)表示,以不加酶的試驗組為對照組。大豆異黃酮糖苷的轉化率計算公式如下所示:
轉化率=反應一定時間(10 min或3 h)的峰面積/反應0 min時的峰面積。
2 結果與分析
2.1重組質粒pET-20b-Te-BglA的構建
以嗜熱厭氧乙醇菌JW200基因組為模板,利用引物P1和P2擴增的Te-bglA基因片段為1.34 kbp,結果見圖1。
由圖1A可知,擴增的DNA片段的電泳圖中沒有明顯的非特異性條帶,說明所選PCR擴增條件能有效擴增Te-bglA基因片段。由圖1B可知,對于已構建的重組質粒pET-20b-Te-BglA采用XbaⅠ和XhoⅠ雙酶切,得到線性的pET-20b質粒載體和插入的Te-BglA基因片段,大小分別為3.7kbp和1.34 kbp,與預計結果相同。測序結果表明質粒pET-20b-Te-BglA構建成功。

圖1 Te-bglA基因(A)和酶切的重組質粒(B)PCR擴增電泳圖Fig.1 PCR amplification electrophoregram of Te-bglA gene(A)and restriction digestion of the recombinant plasmid(B)
2.2重組酶的表達和純化
將重組質粒pET-20b-Te-BglA電轉化于E.coliJM109(DE3)中,挑取E.coliJM109(DE3)單菌落接種于液體LB培養基中經IPTG誘導后,收集細菌經高壓破碎,上清液經熱處理和Ni2+親和層析兩步純化操作,所得重組酶經SDSPAGE檢測結果見圖2。

圖2 純化的重組酶Te-BglA的SDS-PAGE電泳圖Fig.2 SDS-PAGE electrophoretogram of purified recombinase Te-BglA
由圖2可知,所得重組酶Te-BglA蛋白條帶在泳道中單一均勻分布,與預期的蛋白分子質量一致,證明重組酶Te-BglA已成功被純化。
2.3重組酶的最適反應溫度和最適pH以及對溫度和pH穩定性
通過在不同溫度和pH值條件測定重組酶的相對酶活,確定重組酶的最適反應溫度和最適pH以及對溫度和pH的穩定性,結果見圖3。

圖3 重組酶Te-BglA的最適溫度(A)、最適pH(B)、熱穩定性(C)和pH穩定性(D)的檢測結果Fig.3 Detection results of the optimum temperature(A),pH(B),thermostability(C)and pH stability(D)of recombinase Te-BglA
用pNPG作為底物,測得溫度和pH值對重組酶β-葡萄糖苷酶相對酶活的影響,由圖3A可知,在溫度70~80℃之間,酶的相對活性都在80%;當反應溫度為80℃,重組酶的相對酶活達到最高,為100%;當溫度超過80℃,其相對活性急劇下降。由圖3B可知,重組酶的相對酶活隨著pH值的增加,先增加后降低;當反應處于pH 5.8~7.8時,重組酶的相對酶活均在70%以上;當pH值為pH 7.0時,重組酶的相對酶活達到最高,為100%。因此重組酶的最適溫度和pH值分別為80℃和7.0。
由圖3C可知,將重組酶Te-BglA于80℃保溫1 h后測得其活性,相對于保存于冰浴中(未保溫)的酶活性有70.1%的殘留活性,于85℃保溫1 h仍有51.7%的殘留活性。當把溫度提高到為95℃時,酶活性幾乎檢測不出。在已報道的水解大豆異黃酮糖苷的β-葡萄糖苷酶具有高穩定性的較少,只有來自嗜熱擬青霉(Paecilomyces thermophila)的重組β-葡萄糖苷酶在70℃保溫1 h,只能保持20%的殘存活性[14]。將重組酶Te-BglA置于100 mmol/L不同pH緩沖液中,37℃保溫1 h,再測酶的殘留活性,由圖3D可知,在pH 4.5~8.0范圍內重組酶都保持很高的pH穩定性。
2.4動力學參數
重組酶Te-BglA以天然底物水楊苷和人工底物pNPG作為底物,計算重組酶Te-BglA的動力學參數,結果見表1。由表1可知,以pNPG為底物時,Km值為(0.78±0.02)mmol/L,Kcat/Km值為(6.86±0.16)×104L/(mol·s);以水楊苷為底物時,Km值為(5.18±0.10)mmol/L,Kcat/Km值為(2.04±0.02)×104L/(mol·s),兩者相比,重組酶Te-BglA表現出對pNPG更好的親和力和催化效率。重組酶對天然底物水楊苷的Km值要高于來自另一種嗜熱菌海棲熱袍菌的β-葡萄糖苷酶[11],推測該酶可能也能降解纖維素寡糖和糖苷異黃酮等其它的天然底物。

表1 重組酶Te-BglA的動力學參數Table1 Kinetic parameters of recombinase Te-BglA
2.5重組酶Te-BglA酶解大豆粉試驗
重組酶Te-BglA酶解大豆粉試驗結果見圖4和表2。
由圖4的峰型圖可知,脫脂大豆粉中主要的四種大豆異黃酮糖苷經重組酶Te-BglA酶解作用后,其含量大幅度減少,而相應的苷元產量增加明顯。由表2可知,于65℃作用脫脂大豆粉10 min后,Din和Gin被重組酶Te-BglA完全降解。酶解3 h后,M-Din和M-Gin也被重組酶Te-BglA完全降解,產生相應的異黃酮苷元。重組酶Te-BglA與大豆粉反應10 min之后,Din和Gin的產率就分別達到20.4 mg/g和47.7 mg/g。在不加酶的對照組,反應10 min后,Din和Gin的產率只有0.6 mg/g和1.4 mg/g。可見在重組酶Te-BglA的作用后,苷元產量大幅度增加。
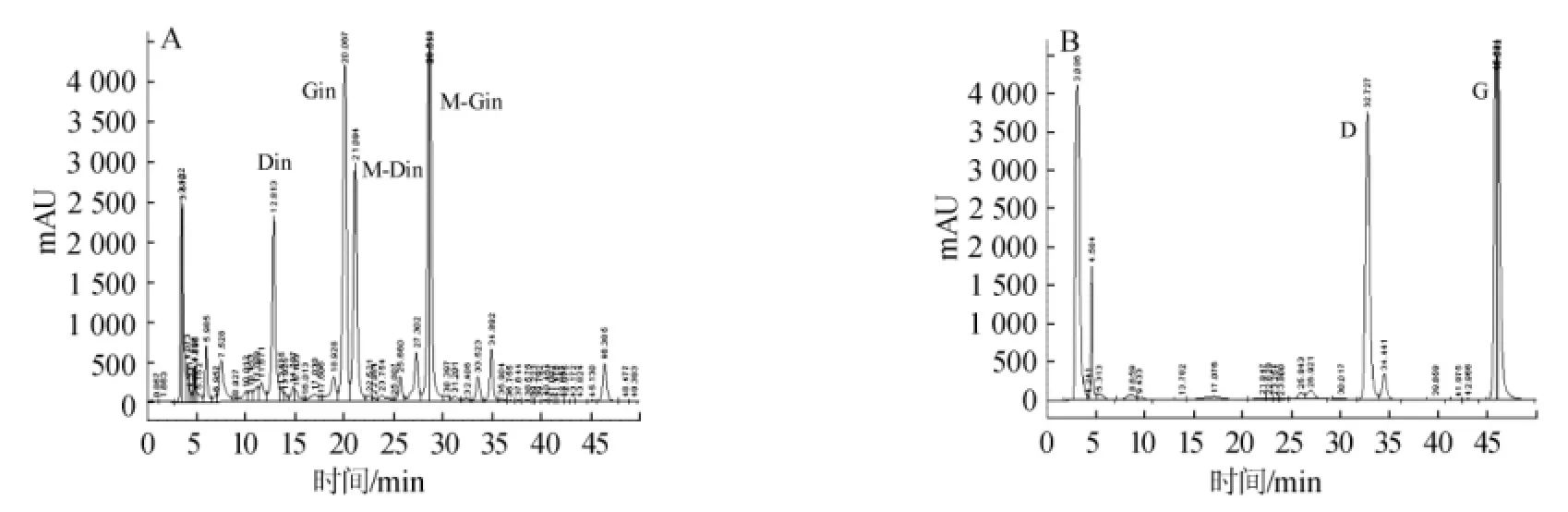
圖4 未加酶(A)和酶處理3 h后(B)的脫脂大豆粉中大豆異黃酮成分的HPLC色譜圖Fig.4 HPLC chromatogram of soy isoflavone component in soybean meal without enzyme processing(A)and with enzyme processing for 3 h(B)

表2 重組β-葡萄糖苷酶A水解脫脂大豆粉的結果Table 2 Results of defatted soybean meal hydrolysed by the recombinant β-glucosidase A
3 結論
糖苷形式的大豆異黃酮不具有最佳的生理活性狀態,須在大豆異黃酮糖苷酶的作用下轉化成苷元形式才能被吸收而發揮藥效[15-16]。因此,篩選出高效的轉化糖苷的β-葡萄糖苷酶成為項目的目標。為獲得具有高穩定性和高效轉化大豆異黃酮糖苷的β-葡萄糖苷酶A,本研究從T.ethanolicusJW200基因組DNA中PCR擴增β-葡萄糖苷酶A基因(Te-BglA),對其進行重組表達,獲得重組酶Te-BglA。該酶經熱處理和Ni2+親和層析純化,純化的酶液采用SDS-PAGE檢測其純度,并對純化的重組酶Te-BglA的酶學性質和動力學參數進行研究。結果表明,本研究成功實現Te-BglA在E.coliJM109(DE3)細胞中的表達,獲得重組酶Te-BglA。以pNPG作為底物,重組酶Te-BglA的最適溫度和最適pH值分別為80℃和7.0。從動力學參數方面可知,以pNPG為底物時,Km值為(0.78±0.02)mmol/L,Kcat/Km值為(6.86±0.16)×104L/(mol·s);以水楊苷為底物時,Km值為(5.18±0.10)mmol/L,Kcat/Km值為(2.04±0.02)×104L/(mol·s),兩者比較可知,重組酶Te-BglA表現出對pNPG更好的親和力和更高的催化效率常數。將酶在80℃保溫1 h后,相對于冰浴中(未保溫)的酶活仍有70.1%的殘留活性,在pH 4.5~8.0區間重組酶Te-BglA保持較高的pH穩定性。HPLC分析酶解大豆粉的結果表明,重組酶Te-BglA在80℃作用3 h后,大豆黃素和染料木素的產量分別達到35.9 mg/g和59.1 mg/g。
針對重組酶Te-BglA熱穩定性高的特點,如將該酶直接用于大豆異黃酮的熱提取過程中,使原料中的大豆異黃酮邊抽提邊轉化以制備大豆異黃酮苷元,改善原有的兩步法,從而縮短生產周期短和降低成本[17]。可見從T.ethanolicusJW200克隆的重組Te-BglA在開發富含大豆異黃酮苷元的保健食品上具有潛在的應用價值。
[1]WADA K,NAKAMURA K,TAMAI Y,et al.Soy isoflavone intake and breast cancer risk in Japan:From the Takayama study[J].Int J Cancer,2013,133(4):952-960.
[2]LIMA F S,IDA E I.Optimization of soybean hydrothermal treatment for theconversionofβ-glucoside isoflavonesto aglycones[J].Food Sci Tech,2014,56(2):232-239.
[3]翟清燕.高產游離型大豆異黃酮乳酸菌的篩選鑒定及其在發酵豆乳中的應用[D].泰安:山東農業大學碩士論文,2014.
[4]魯瑋,岳冬冬,劉新育,等.黑曲霉產β-葡萄糖苷酶的純化及對中藥糖苷類成分的轉化[J].中國醫藥工業雜志,2014,45(3):220-223.
[5]張琳,武勝奇,雄正英.白藜蘆醇的生物學作用及其在運動醫學中的應用研究[J].體育學刊,2005,12(3):57-60.
[6]YOO D,HARA T,FUJITA N,et al.Transcription analyses ofGmlCHG,a gene coding for a β-glucosidase that catalyzes the specific hydrolysis of isoflavone conjugates inGlycine max(L.)Merr[J].Plant Sci,2013(208):10-19.
[7]YEOM S J,KIM B N,KIM Y S,et al.Hydrolysis of isoflavone glycosides by a thermostable β-glucosidase fromPyrococcus furiosus[J].JAgr Food Chem,2012,60(6):1535-1541.
[8]孫正博,吳周和,董青,等.大豆異黃酮β-葡萄糖苷酶產生菌的選育及產酶條件研究[J].中國釀造,2006,25(5):7-11.
[9]KIM B N,YEOM S J,KIM Y S.Characterization of a β-glucosidase fromSulfolobus solfataricusfor isoflavone glycosides[J].Biotechnol Lett,2011,34(1):125-129.
[10]SUZUKI H,TAKAHASHI S,WATANABE R,et al.An isoflavone conjugate-hydrolyzing β-glucosidase from the roots of soybean(Glycine max)seedlings:Purification,gene cloning,phylogenetics,and cellular localization[J].J Biol Chem,2006,281(40):30251-30259.
[11]XUE Y M,YU J J,SONG X F.Hydrolysis of soy isoflavone glycosides by recombinant β-glucosidase from hyperthermophileThermotoga maritima[J].J Ind Microbiol Biotechnol,2009,36(11):1401-1408.
[12]XUE Y M,SONG X F,YU J J.Overexpression of β-glucosidase from Thermotoga maritimefor the production of highly purified aglycone isoflavones from soy flour[J].World J Microbiol Biotechnol,2009, 25(12):2165-2172.
[13]CHUANKHAYAN P,RIMLUMDUAN T,SVASTI J,et al.Hydrolysis ofsoybean isoflavonoid glycosides byDalbergiaβ-glucosidase[J].J Agr Food Chem,2007,55(6):2407-2412.
[14]YANG S Q,WANG L J,YAN Q J,et al.Hydrolysis of soybean isoflavone glycosides by a thermostable beta-glucosidase fromPaecilomyces thermophila[J].Food Chem,2009,115(4):1247-1252.
[15]ISMAIL B,HAYES K.β-glycosidase activity toward different glycosidic forms of isoflavones[J].J Agric Food Chem,2005,53(12):4918-4924.
[16]GABRIELA P M A,LORENA G D A L,MAIRA A,et al.Hydrolysis of soybean isoflavones byDebaryomyces hanseniiUFV-1 immobilised cells and free β-glucosidase[J].Food Chem,2014(146):429-436.
[17]張慧,邱日永,劉明杰,等.極耐熱性β-葡萄糖苷酶基因克隆、超量表達及其在天然藍色素工業化生產中的應用[J].江蘇農業科學,2013,41(7):19-22.
Cloning and expression β-glucosidase A gene fromThermoanaerobacter ethanolicusfor conversion of soybean isoflavone glycosides
WANG Ruili1,SUN Wei1,XUE Yemin2
(1.College of Biological and Pharmaceutical Engineering,Xinyang College of Agriculture and Forestry,Xinyang 464000,China;2.College of Ginling,Nanjing Normal University,Nanjing 210097,China)
In order to obtain a high stability and efficiency β-glucosidase A(BglA)in the biotransformation of isoflavone glycosides,β-glucosidase gene was amplified by PCR from the genomic DNA ofThermoanaerobacter ethanolicusJW200,and produced inEscherichia coliJM109(DE3)and purified by nickel affinity chromatography for characterization of their enzymatic and kinetic properties.p-nitrophenyl-β-D-glucoside(pNPG)as substrate,optimal temperature and pH of the BglA were 80℃and 7.0,KmandKcat/Kmof BglA were(0.78±0.02)mmol/L and(6.86±0.16)×104L/(mol·s),respectively.The salicin as substrate,KmandKcat/Kmwere(5.18±0.10)mmol/L and(2.04±0.02)×104L/(mol·s),which demonstrated that the recombinant Te-BglA showed better affinity for pNPG and higher catalytic efficiency constant.And BglA was found to be greater stability which kept 70.1% activity of 1 h at 80℃and pH 4.5-8.0.High performance liquid chromatography(HPLC)results demonstrated that the effect of enzyme hydrolysis soybean isofavone glycosides to isoflavone aglycones was evident at 80℃for 3 h,the yield of soybean daidzein and genistein reached 35.9 mg/g and 59.1 mg/g.
β-glucosidase;enzymology property;soybean isoflavone glycoside;aglycone
Q93
0254-5071(2016)03-0114-06
10.11882/j.issn.0254-5071.2016.03.026
2015-12-12
河南省科技攻關資助項目(132102110047)
王銳麗(1985-),女,講師,碩士,研究方向為微生物學及分子生物學。

