H9N2流感病毒誘導MDCK細胞自噬對病毒復制的影響
李春紅, 王 麗, 董玉龍, 李欣蕊, 楊 昊, 魏 鑫, 徐 彤
(1.河北北方學院預防獸醫學重點實驗室,河北張家口 075000;2.河北北方學院理學院,河北張家口 075000)
H9N2流感病毒屬于A型流感病毒,易使家禽和豬受到感染,同時也可感染人(殷斌等,2015;王斌和童光志,2012;Myers,2007)。1966年,從患有呼吸道疾病的火雞中分離出H9N2亞型禽流感病毒 (Homme和Easterday,1970)。H9N2亞型禽流感容易導致雞產蛋下降,與其他病原體混合感染而致雞的死亡率升高。流感病毒在豬體內出現了混合感染的情況。Xu等(2004)從山東發病率和致死率較高的豬群中分離到了H9N2病毒。Peiris等證實中國東南地區豬群中存在H9N2禽流感和H3N2豬流感病毒。此外,H9N2流感病毒在禽類和豬群中不斷感染和傳播為流感病毒進一步感染人 類 提 供 了 條 件 (Xu等 ,2018;Pan等 ,2018)。2016年四川省出現人感染H9N2流感病毒危重臨床病例的報道(Ninomiya等,2002)。可見,H9N2流感病毒引起的病毒性傳染病,嚴重威脅著公眾健康,給社會帶來了沉重的經濟負擔。對H9N2流感病毒的研究具有十分重要的公共衛生學意義。
細胞自噬是細胞內的一種“自食”的現象,是溶酶體對自身結構的降解,釋放出游離小分子供細胞回收利用的正常動態生命過程,是細胞內的再循環系統。機體應對外來病原微生物感染時啟動免疫應答,細胞自噬在此發揮重要的作用(Kundu和Thompson,2008)。通過抑制自噬,在發生自噬的后期病毒免于被降解(Levine等,2011),抑制自噬可以促進病毒粒子的生成和釋放。另有研究報道,自噬參與流感病毒的復制(Yeganeh等,2015;Zhou等,2009)。 在H9N2流感病毒感染的A549細胞中,抑制自噬后流感病毒的滴度和TCID50均顯著降低(Zhou等,2009)。細胞自噬到底是促進病毒的自身復制還是清除細胞內的病毒有待進一步研究。MDCK細胞因其病毒生產效率高、快速增殖和低突變率而被認為是生產流感病毒的有效宿主 (Merten等,1999;Taub等,1979)。因此本研究進行了H9N2流感病毒誘導MDCK細胞發生自噬及其對病毒復制影響的研究。
1 材料和方法
1.1 毒株與細胞H9N2流感病毒A/swine/Hebei/012/2008(H9N2)由河北北方學院預防獸醫學重點實驗室分離保存;犬腎上皮細胞(MDCK細胞)由河北北方學院預防獸醫學重點實驗室保存。
1.2 主要試劑DMEM培養基、胎牛血清等常用細胞培養相關試劑均購自浙江天杭生物科技有限公司;雷帕霉素(Rapamycin)、3-甲基腺嘌呤(3-MA) 購 自Sigma公 司 ;Polybrene和 嘌 呤 霉 素(Puromycin)均購自圣克魯斯生物公司;自噬標記慢病毒(GFP-LC3)購自漢恒生物公司;總RNA提取試劑盒和實時熒光定量PCR試劑盒購自北京賽恩諾爾公司。
1.3 細胞培養與傳代MDCK細胞放于DMEM完全培養基中,常規細胞培養條件培養。觀察細胞生長狀態,選取符合試驗要求的MDCK細胞,棄去培養基,加入PBS洗滌細胞。之后加入EDTA-胰酶約1 mL,置細胞培養箱消化0.5~1 min。待細胞瓶成霧狀時消化即可終止。收集處于分散均勻狀態的細胞,分裝至新的細胞瓶或者培養板備用。
1.4 MDCK細胞系的構建與結果觀察
1.4.1 慢病毒感染細胞最適MOI值的確定MDCK細胞鋪96孔板,培養過夜。吸去培養好細胞的培養基,加入新培養基,隨后GFP-LC3慢病毒按MOI為1、5、10、20、40、100加入MDCK細胞中使其混合均勻。慢病毒感染細胞需要Polybrene的參與,隨即加入預先準備好的Polybrene,終濃度為1.5 μg/mL。待感染MDCK細胞24 h后,需更換培養液。感染48 h后進行熒光觀察,72 h后感染率80%左右,確定為MOI值。
1.4.2 GFP-LC3慢病毒感染MDCK接種24孔板培養過夜。感染前吸棄培養好細胞的培養基,更換新培養基,按1.4.1確定的MOI將慢病毒加入細胞中使其混勻。加入Polybrene,使其終濃度為1.5 μg/mL。慢病毒感染24 h,吸棄培養液,加入新培養液。感染48 h,觀察GFP表達效率,更換含有終濃度為0.5 μg/mL Puromycin的新培養液。定時更換,使其Puromycin終濃度升至2.0 μg/mL。鎖定處于穩定表達GFP-LC3的MDCK細胞株,直至沒有受到慢病毒感染的細胞被全部處理掉。將獲得的MDCK細胞株命名為MDCK/GFP-LC3。
1.4.3 激光共聚焦觀察MDCK/GFP-LC3細胞鋪小皿,培養過夜后接種H9N2流感病毒,感染24 h后按常規洗滌方法處理,即可進行激光共聚焦拍照分析影像資料。
1.5 病毒感染與藥物處理MDCK細胞預先經H9N2流感病毒處理,MOI為2。置37℃、5% CO2培養箱中作用1 h后經PBS洗滌處理,繼續培養。待12、24 h和36 h時分別收集細胞進行檢測。H9N2流感病毒感染+藥物處理組:3-MA(終濃度為8 mM)作用MDCK細胞1 h后接種H9N2流感病毒,Rapamycin(終濃度為100 nM)作用MDCK細胞12 h接種H9N2流感病毒,使H9N2流感病毒在37℃、5% CO2培養箱中作用1 h后,用處理過的PBS洗滌,DMEM繼續培養,感染后12、24、36 h收集細胞進行檢測。
1.6 細胞活性和TCID50的測定 參照CCK8試劑盒說明書進行細胞活性檢測。96孔板中每孔緩慢加入10 μL CCK8溶液,細胞培養,二氧化碳培養箱中孵育2 h后,檢測細胞在450 nm處的吸光光度(OD)值。細胞存活率%=(給藥組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。選取3-MA和Rapamycin兩種自噬劑,各給藥組按照預定的濃度梯度加入相應的藥物。
按照常規方法檢測病毒的半數細胞培養物感染量 (TCID50),用Reed-Muench法計算病毒的TCID50。
1.7 實時熒光定量PCR測定 按照RNAeasyTM病毒RNA抽提試劑盒提取細胞總RNA,反轉錄后進行Real-time PCR測定。 測定在ABI 7300 system中進行,20 μL體系,用內參GAPDH處理,由2-△△Ct公式計算mRNA的相對表達量。
1.8 數據分析 利用Excel 2007對試驗數據進行初步處理;采用SPSS 20.0軟件進行單因子方差分析后進行Tukey’s多重比較,P<0.05為差異顯著,P<0.01為差異極顯著。
2 結果與分析
2.1 穩定表達GFP-LC3 MDCK細胞系的鑒定研究報道,細胞自噬使LC3-II的合成顯著增加,LC3蛋白可被募集到自噬體膜上發生點狀聚集(Martinet等,2006;Kirisako等,1999)。 本試驗激光共聚焦得出,MDCK/GFP-LC3細胞呈現均勻的綠色熒光,說明GFP-LC3在MDCK中穩定表達(圖1),此結果將用于H9N2流感病毒感染后自噬發生的判斷。

圖1 激光共聚焦觀察GFP-LC3在MDCK細胞中的表達
2.2 H9N2流感病毒感染MDCK/GFP-LC3后綠色熒光的點狀聚集 轉染細胞中出現綠色熒光的點狀聚集,可作為檢測細胞自噬發生的方法(Mizushima等,2010)。本試驗利用H9N2流感病毒感染MDCK/GFP-LC3細胞,激光共聚焦觀察MDCK/GFP-LC3綠色熒光的點狀聚集。試驗結果如圖2所示,對照組的綠色熒光呈現彌散的均勻分布 (圖2A),而H9N2流感病毒感染MDCK/GFP-LC3細胞24 h時棄去培養基,PBS洗滌3次,觀察到了綠色熒光的點狀聚集(圖2B)。由此得出,H9N2流感病毒感染MDCK/GFP-LC3細胞發生細胞自噬。

圖2 H9N2流感病毒感染MDCK/GFP-LC3綠色熒光的點狀聚集
2.3 自噬抑制劑與自噬誘導劑對MDCK細胞生長活性的影響 利用自噬抑制劑3-MA和自噬誘導劑Rapamycin對細胞自噬進行調控,檢測H9N2流感病毒感染MDCK細胞后自噬的發生對病毒復制的影響。以CCK8試劑盒檢測3-MA和Rapamycin對細胞活性的影響。
分 別 用20、40、100、160 nΜ 和220 nΜ 的Rapamycin處理MDCK細胞,結果如圖3A顯示,與空白對照組相比較,無論是低劑量Rapamycin處理組,還是高劑量Rapamycin處理組,細胞的活性均沒有顯著差異(P>0.05)。分別用2、4、8、16 mM和24 mM 3-MA處理MDCK細胞,結果如圖3B顯示,與空白對照組相比較,無論是低劑量3-MA處理組,還是高劑量3-MA處理組,細胞的活性均沒有明顯變化(P>0.05)。因此,給定濃度的自噬誘導劑Rapamycin和自噬抑制劑3-MA處理MDCK細胞,結果顯示細胞的活性均沒有呈現明顯的變化。
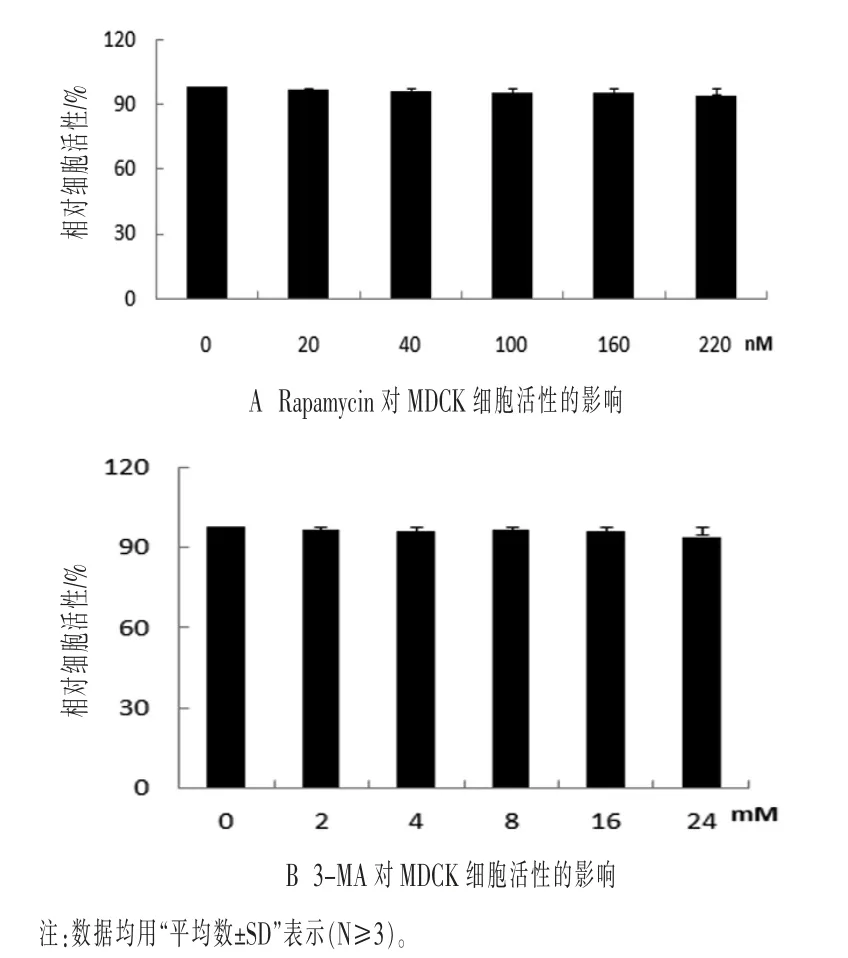
圖3 CCK8檢測Rapamycin和3-MA對MDCK細胞活性的影響
2.4 自噬促進劑對H9N2流感病毒增殖的影響為進一步探討細胞自噬對于H9N2流感病毒復制的影響,利用Rapamycin誘導細胞自噬,檢測NP的mRNA水平以及病毒的滴度。結果如圖4所示,Rapamycin處理MDCK細胞后,接種H9N2流感病毒,可以顯著增加NP的mRNA水平和病毒滴度(P<0.01)。因此,Rapamycin在調節細胞自噬方面發揮了重要的作用,誘導細胞自噬可以促進H9N2流感病毒的增殖,細胞自噬參與H9N2流感病毒復制的過程。

圖4 Rapamycin對于NP mRNA水平和病毒滴度的影響
2.5 自噬抑制劑對H9N2流感病毒增殖的影響為探討細胞自噬是否參與H9N2流感病毒復制的過程,利用3-MA處理MDCK細胞,接種H9N2流感病毒,分析NP的mRNA水平,結果如圖5所示,與H9N2流感病毒感染組相比,3-MA處理MDCK細胞后,接種H9N2流感病毒后的12、24 h和36 h均能顯著降低NP的mRNA水平和病毒滴度(P<0.01)。可見,3-MA在調節細胞自噬方面發揮了重要的作用,抑制細胞自噬阻礙H9N2流感病毒復制,細胞自噬參與H9N2流感病毒復制的過程。

圖5 3-MA對于NP mRNA水平和病毒滴度的影響
3 討論
病毒誘導的細胞自噬是一種常見的自噬形式。自噬可以清除細胞內沒有用處的物質,也可以清除細胞內受感染的細菌和病毒。然而有研究認為在流感病毒感染細胞后,流感病毒能夠通過誘導細胞自噬,抑制自噬體與溶酶體融合,自噬體在細胞內積累,阻止了病毒抗原呈遞,促使病毒復制,因此對細胞有害對病毒有利。然而有研究證實在流感病毒感染的細胞中,抑制自噬導致在細胞培養上清液中流感病毒的滴度顯著降低。
基于上述前人研究結果,本研究利用自噬抑制劑3-MA抑制細胞自噬,實時定量PCR結果顯示NP的mRNA的水平顯著降低,TCID50結果顯示病毒的滴度顯著降低,說明抑制細胞自噬可以降低H9N2流感病毒的復制。進而本研究利用自噬誘導劑Rapamycin誘導細胞自噬,實時定量PCR顯示NP的mRNA的水平顯著升高,TCID50結果顯示病毒的滴度也顯著上升,說明誘導細胞自噬可以促進流感病毒的復制。
在生物進化過程中,自噬已經發展成為生物體內一種必不可少的細胞機制。在MDCK細胞中,細胞自噬可以促進流感病毒的復制,提示細胞自噬參與H9N2流感病毒的致病機理。
4 結論
在MDCK細胞中,自噬抑制劑可以降低NP的mRNA水平以及病毒的滴度,抑制自噬可降低H9N2流感病毒的復制。自噬促進劑誘導細胞自噬,NP mRNA的表達水平增加以及病毒的滴度也上升,可以促進H9N2流感病毒的復制。

