microRNA-140通過下調HDAC4抑制胃癌細胞遷移和侵襲能力△
王顯艷 高峰 趙春明 孫玉榮 溫秋婷 于秀文 張曉杰
1齊齊哈爾醫學院病理學院,黑龍江 齊齊哈爾 161006
2齊齊哈爾醫學院第三附屬醫院麻醉科,黑龍江 齊齊哈爾 161006
microRNA-140通過下調HDAC4抑制胃癌細胞遷移和侵襲能力△
王顯艷1#高峰2趙春明1孫玉榮1溫秋婷1于秀文1張曉杰1
1齊齊哈爾醫學院病理學院,黑龍江齊齊哈爾161006
2齊齊哈爾醫學院第三附屬醫院麻醉科,黑龍江齊齊哈爾161006
目的探討microRNA-140(miR-140)對胃癌細胞SGC-7901遷移及侵襲能力的影響及其調控機制。方法將miR-140 mimics(miR-140)、miR-140特異性抑制劑(Anti-miR-140)和針對HDAC4的siRNA(HDAC4 siRNA)分別通過脂質體轉染至細胞,應用實時熒光定量(qRT-PCR)檢測細胞中miR-140和HDAC4 mRNA表達情況,并采用蛋白質印跡法(WB)分析HDAC4蛋白水平。采用Transwell小室模型分析miR-140上調和下調以及HDAC4調低對SGC-7901細胞遷移和侵襲能力的影響。結果miR-140轉染可使HDAC4蛋白表達降低,HDAC4 mRNA水平則無明顯變化。miR-140上調與HDAC4調低均可顯著抑制SGC-7901細胞的遷移和侵襲能力,而在轉染了Anti-miR-140的SGC-7901細胞中HDAC4蛋白表達增高,細胞遷移和侵襲能力增強。結論miR-140在轉錄后水平調控HDAC4表達。miR-140抑制胃癌細胞遷移和侵襲能力,部分是通過下調HDAC4而實現。miR-140可能作為腫瘤轉移診斷及治療的新靶點。
胃癌;microRNA-140;HDAC4;腫瘤遷移;腫瘤侵襲
Oncol Prog,2016,14(3)
胃癌是常見惡性腫瘤,在所有癌癥死亡率中排名第二,嚴重危害人民的健康。抑制胃癌細胞發生侵襲轉移是胃癌治療整體水平提高的瓶頸。經過數十年不懈努力,眾多學者從不同角度、不同方面對胃癌侵襲轉移機制進行了大量的研究,取得了許多重大進展,但胃癌侵襲轉移的具體作用機制到目前為止仍不清楚。因此徹底改善胃癌患者預后要從預防和治療胃癌轉移入手[1-2]。
微小RNA(microRNA,miRNA)是一類長度約為22個核苷酸的內源性、單鏈非編碼的RNA分子[3]。通過與靶基因mRNA堿基的3′端非編碼區(3′-UTR)通過不完全或完全配對相結合,在轉錄后水平沉默靶基因從而參與細胞增殖、分化、代謝和凋亡等多種生物學過程。近年來越來越多的研究表明miRNA還可作為腫瘤癌基因或抑癌基因參與腫瘤的侵襲和轉移過程[4]。
miR-140是一種在軟骨增生和發育及骨關節炎發生過程中起重要作用的微小RNA[5-7]。但關于miR-140與腫瘤發生發展過程的關系研究很少。Iorio等[8]應用芯片技術篩選上皮源性卵巢癌與正常卵巢組織之間的miRNA表達差異,發現miR-140在卵巢癌中的表達水平顯著降低。另有研究應用實時熒光定量(qRT-PCR)發現miR-140在神經膠質瘤由Ⅱ級到Ⅳ級的進展過程中表達增高[9]。但這兩項研究均缺乏對miR-140在腫瘤發生發展中的作用機制研究。有研究形式miR-140在結腸癌中表達顯著降低:miR-140可通過下調TGF-B信號通路中Smad3抑制結腸癌細胞增殖和轉移能力[10]。Tuddenham等[11]在小鼠細胞中,應用熒光素報告系統得出的結果提示蛋白乙酰化酶4(histone deacetylase 4,HDAC4)可能是miR-140的靶基因,miR-140通過抑制HDAC4表達來促進軟骨細胞的發育。本研究以胃癌細胞SGC-7901為實驗對象,通過體外實驗,從上調和下調兩個角度探討miR-140對其遷移和侵襲能力的影響,并闡明可能的作用機制。
1 材料與方法
1.1材料
人胃癌細胞SGC-7901細胞系購自上海生命科學研究院細胞資源中心,于含10%小牛血清(FBS)的DMEM培養基(購自美國Gibco公司)中,在37℃、5%CO2培養箱中常規培養。轉染試劑脂質體Oligofectamine和Lipofectamine 2000、TRIzol試劑、miR-140 mimics及其無關序列和miR-140 inhibitor及其無關序列均購自美國Invitrogen公司。HDAC4 siRNA購自上海吉凱基因化學有限公司。基質膠(Matrigel)為美國BD Bioscience公司產品。Transwell小室購自美國Corning公司。
1.2實驗方法
1.2.1miR-140上調實驗分組①空白對照組(control):僅加入Oligofectamine;②陰性對照組(negative control,NC):加入miRNA mimics無關序列和Oligofectamine;③miR-140上調轉染組(miR-140):加入miR-140 mimics和Oligofectamine;④HDAC4 siRNA轉染組(HDAC4 siRNA):加入HDAC4 siRNA和Oligofectamine。轉染前36 h,將2×105細胞/孔接種在6孔板中,待細胞長至30%~50%匯合時,參照Oligofectamine的說明書,將終濃度為100 nM的miR-140 mimics及其無關序列和HDAC4 siRNA分別轉入細胞,轉染后4 h加入20%FBS。
1.2.2miR-140下調實驗分組①空白對照(control):僅加入Lipofectamine 2000;②陰性對照(Anti-NC):加入miRNA inhibitor無關序列和Lipofectamine 2000;③miR-140下調轉染組(Anti-miR-140):加入miR-140 inhibitor和Lipofectamine 2000。細胞接種方法同miR-140上調轉染實驗,參照Lipofectamine 2000的說明書,將終濃度為100 nM的miR-140 inhibitor及其無關序列分別轉入細胞,轉染后6 h加入20%FBS。
1.2.3qRT-PCR檢測轉染細胞內miR-140水平轉染后24 h收集細胞,TRIzol試劑提取總RNA。以10 ng總RNA為模板,應用High Capacity cDNA synthesis kit反轉錄生成cDNA,以U6作為內參。qRT-PCR分析在美國Agilent公司ABl7000上進行。反應條件:95℃變性10 min;95℃15 s、60℃60 s,共40個循環;循環結束后72℃延伸10 min,每個樣本均做3個復管。qRT-PCR所用試劑盒和引物均購自美國Applied Biosystems公司。miR-140表達水平與其內參U6相比較后得到ΔCT,再與NC組相比,所得結果按2-ΔΔCT法計算,以相對表達量(relative quantity,RQ)表示。
考慮到不同國家(地區)的節假日以及各股票市場的停牌日期等不同而帶來交易日上的差異,我們參考Hamao等(1990)的做法,剔除不完整數據及非同步交易數據,這也是學者們常用的一種處理方法,我們最終得到3341組觀測值的收益率序列。
1.2.4qRT-PCR檢測轉染細胞內HDAC4 mRNA水平轉染后24 h收集細胞并提取總RNA。以1 μg總RNA為模板按一步法RT-PCR試劑盒說明(日本TaKaRa公司)進行逆轉錄,采用帶有ROX的Platinum SYBR Green PCR試劑盒(美國Invitrogen公司)檢測HDAC4 mRNA的表達水平,以GAPDH作為內參。HDAC4和GAPDH的特異性引物均購自美國Invitrogen公司,HDAC4序列:上游5′-CCACAGUCUCUGUGUAAACCAC-3′,下游5′-GAUGGUAUCCAUUUUGGUGA-3′。qRT-PCR分析在美國Agilent公司ABl7000上進行。反應條件:50℃持續2 min,95℃變性2 min;95℃15 s、60℃30 s,共50個循環。每個樣本均做3個復管。計算方式同上。
1.2.5蛋白質印跡法(western blot,WB)檢測HDAC4蛋白表達細胞轉染后48 h應用RIPA buffe(r購自北京碧云天生物技術研究所)提取總蛋白。將50 mg總蛋白經SDS-PAGE電泳后,轉至聚偏二氟乙烯膜(PVDF)。膜經封閉液作用后,與鼠抗HDAC4(1∶1000稀釋,美國Santa Cruz公司)4℃孵育過夜。膜漂洗后加入羊抗鼠紅外熒光二抗(1∶8000稀釋,美國LI-COR公司)孵育40 min,利用紅外熒光二抗成像系統(美國LI-COR公司產品)成像,采用Gel-Pro Analyzer軟件分析目的蛋白表達水平。內參鼠抗GAPDH(1∶1000稀釋),購自北京碧云天生物技術研究所。
1.2.6Transwell小室檢測細胞遷移和侵襲能力轉染后72 h提取總蛋白,應用WB檢測HDAC4蛋白表達,驗證轉染成功后,通過Transwell小室檢測細胞遷移和侵襲能力的變化。將60μl Matrigel(用無血清的DMEM培養液按1∶4稀釋)鋪于小室濾膜(孔徑8μm)上,并輕輕晃動小室使膠均勻充分地分布在小室上室面,置37℃培養箱1 h凝膠。細胞饑餓24 h后重懸,調整濃度至1.5×106/ml,向上室內加入200μl的細胞懸液(細胞數3×105個),下室加入含10%FBS的DMEM完全培養液600μl,置于細胞培養箱中培養。24 h后取出小室,用棉簽輕輕擦去位于上室的細胞,甲醇固定30 min,1%結晶紫染色15 min后,用PBS洗膜數次,直至將小室上多余的結晶紫染色洗去。置于倒置光學顯微鏡下觀察,隨機選取5個視野計數并拍照,陽性細胞被染成紫色。細胞遷移實驗與侵襲實驗相比,前者無需預先進行Matrigel包被,其余步驟同侵襲實驗。
1.3統計學方法
采用SPSS 19.0統計軟件進行統計學分析,計量資料以均數±標準差(±s)表示,采用兩單獨樣本t檢驗,組間比較采用t檢驗及方差分析,P<0.05為差異有統計學意義。
2 結果
2.1miR-140上調組miR-140的表達水平
胃癌細胞SGC-7901轉染miR-140后24 h提取RNA,采用qRT-PCR方法檢測miR-140表達水平。結果發現轉染后的SGC-7901細胞中miR-140表達水平是NC組的1.89倍,差異有統計學意義(P<0.05,圖1)。

圖1 NC組和miR-140組的miR-140表達水平
胃癌SGC-7901細胞轉染miR-140后48 h提取蛋白質,以control組和NC組作為陰性對照,HDAC4 siRNA作為陽性對照,通過WB檢測HDAC4蛋白水平。結果顯示,與兩個陰性對照相比,miR-140表達上調可顯著抑制HDAC4蛋白表達[control組(0.51±0.02),NC組(0.59±0.06),miR-140上調轉染組(0.05±0.01),P<0.05],而與HDAC4 siRNA組(0.05±0.03)水平相當,見圖2A。同時利用qRT-PCR方法檢測了miR-140組中HDAC4 mRNA表達水平為(1.18±0.11),與NC組的(1.00±0.07)相比,差異無統計學意義(P>0.05,圖2B)。

圖2 上調miR-140對HDAC4表達的影響
2.3miR-140下調對HDAC4蛋白表達的影響
miR-140 inhibitor轉染后72 h提取蛋白質,采用WB檢測miR-140下調對HDAC4蛋白表達的影響。結果顯示,與control組(0.19±0.02)和Anti-NC組(0.24±0.04)相比,Anti-miR-140組(0.45±0.08)的HDAC4蛋白表達顯著增高,差異有統計學意義(P<0.05,圖3)。

圖3 miR-140下調對HDAC4蛋白表達的影響
2.4miR-140上調對胃癌細胞遷移及侵襲能力的影響(圖4)
采用Transwell小室模型檢測miR-140對SGC-7901細胞遷移能力的影響。結果顯示,48 h后miR-140組、HDAC4 siRNA組穿膜細胞數分別為(68.2± 2.4)和(73.5±5.3),低于control組的(297.1±4.9)及NC組的(266.1±5.7),差異有統計學意義(P<0.05,圖4A)。采用Transwell小室侵襲實驗檢測miR-140上調對SGC-7901細胞侵襲能力的影響。結果顯示,miR-140組、HDAC4 siRNA組穿膜細胞數分別為(109.5±7.4)和(108.8±3.6),低于control組的(303.1±5.1)及NC組的(482.6±8.4),差異有統計學意義(P<0.05,圖4B)。
2.5miR-140下調對SGC-7901細胞遷移和侵襲能力的影響(圖5)
Transwell小室模型法顯示,24 h后Anti-miR-140組穿膜細胞數為(339.2±7.7),高于control組(127.2±3.1)及Anti-NC組(103.1±2.9),差異有統計學意義(P<0.05,圖5A)。Transwell小室侵襲實驗結果顯示,Anti-miR-140組穿膜細胞數為(291.2± 6.4),高于control組(102.7±4.4)及Anti-NC組(109.4±3.1),差異有統計學意義(P<0.05,圖5B)。
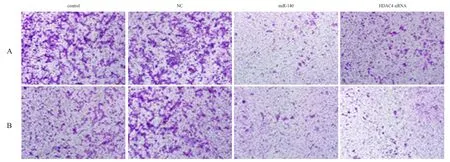
圖4 miR-140上調對SGC-7901細胞遷移及侵襲能力的影響(結晶紫染色,×100)

圖5 miR-140下調對SGC-7901細胞遷移及侵襲能力的影響(結晶紫染色,×100)
3 討論
轉移是惡性腫瘤患者死亡的主要原因,近年來的研究表明miRNA可作為腫瘤抑制基因或癌基因而參與腫瘤的發生及轉移過程。有報道miR-15a、miR-16-1、miR-34a和miR-145等的缺失與慢性淋巴細胞性白血病、大腸癌、胃癌和乳腺癌等腫瘤的發生有關[12],包括本研究在內的幾個不同研究小組發現受抑癌基因p53調控的miR-192和miR-215的過表達,可導致腫瘤細胞的細胞周期阻滯,從而抑制腫瘤細胞增殖[9],miR-192和miR-215下調與大腸癌和多發性骨髓瘤等的發生有關[10-15]。miR-21、miR-17-92 cluster和miR-221、miR-222等的過表達可促進大腸癌、胃癌、肝癌和胰腺癌等腫瘤的發生,miR-10b、miR-335、miR-373和miR-520c、miR-9及miR-21等的異常則與腫瘤轉移密切相關[12-16]。這些研究結果表明miRNA的異常表達與腫瘤侵襲轉移行為密切相關,miRNA可作為腫瘤轉移的標志物,并可為腫瘤轉移治療提供候選靶點。
Song等[17]研究證實在結腸癌細胞HCT116和骨肉瘤細胞U-2 OS中miR-140在蛋白水平負調控HDAC4,并發現瞬時轉染miR-140可導致HCT116 和U-2 OS細胞中細胞周期調控蛋白p53和p21過表達,從而引起細胞周期G1和G2期阻滯,結果顯著抑制HCT116和U-2 OS細胞的增殖。
本研究將miR-140瞬時轉染至人胃癌細胞SGC-7901中,通過Transwell小室實驗發現轉染后的SGC-7901細胞其遷移和侵襲能力顯著下降,而轉染了miR-140特異性抑制劑的SGC-7901細胞則表現出較強的遷移和侵襲能力,表明miR-140具有抑制胃癌細胞遷移和侵襲的作用。這與最近報道的miR-140可抑制肝癌細胞和非小細胞肺癌細胞增殖和轉移能力的結果相一致[18-19]。
HDAC作為一種位于真核細胞中的蛋白酶,其主要功能就是修飾染色體的結構和調節其他功能蛋白,對腫瘤細胞生長、分化和凋亡過程均有調節作用,也可對基因表達起到指導作用。因此,HDAC是一個很有前景的癌癥治療方法,HDAC抑制劑已經成為當前研究人員熱門研究對象。較為常用的HDAC抑制劑也用于臨床腫瘤治療,如果能對腫瘤中各種HDAC家族蛋白的表達情況做以研究,可以加強其抑制劑的研發和應用[20]。
本研究發現miR-140轉染可下調SGC-7901細胞中HDAC4蛋白的表達,但其mRNA水平則無顯著變化,表明miR-140是在轉錄后水平調控了HDAC4的表達,這與Tuddenham等[11]的報道相一致。本研究進一步地應用siRNA敲低HDAC4在SGC-7901細胞中的表達,與轉染了miR-140的 SGC-7901細胞相比,兩組細胞的遷移和侵襲能力都明顯下降;當應用miR-140特異性抑制劑敲低miR-140后,則HDAC4表達增高,細胞的遷移和侵襲能力也顯著增強。以上結果表明HDAC4確是miR-140的靶點,并且miR-140是在翻譯水平下調HDAC4。同時表明miR-140抑制腫瘤細胞的遷移和侵襲能力部分是通過下調HDAC4實現的。綜上所述,本研究結果可為miR-140作為腫瘤轉移診斷及治療的靶點提供理論依據。
[1]Wu CW,Hsieh MC,Lo SS,et al.Relation of number of postive lymph nodes to theprognosis of patients with primary gastric adenocarcinoma[J].Gut,1996,38(4):525-527.
[2]Li C,Kim S,Lai JF,et al.Solitary lymph nodemetastasis in gastric cancer[J].J Gastrointest Surg,2008,12(3):550-554.
[3]Calin GA,Croce CM.MicroRNA signatures in human cancers[J].Nat Rev Cancer,2006,6(11):857-866.
[4]Iorio MV,Croce CM.MicroRNAs in cancer:small molecules with a huge impact[J].J Clin Oncol,2009,27(34):5848-5856.
[5]Tuddenham L,Wheeler G,Ntounia-Fousara S,et al.The cartilage specific microRNA-140targets histone deacetylase 4 in mouse cells[J].FEBS Lett,2006,580(17):4214-4217.
[6]Tardif G,Hum D,Pelletier JP,et al.Regulation of the IGFBP-5 and MMP-13 genes by the microRNAs miR-140 and miR-27a in human osteoarthritic chondrocytes[J].BMC Musculoskelet Disord,2009,10:148.
[7]Miyaki S,Sato T,Inoue A,et al.MicroRNA-140 plays dual roles in both cartilage development and homeostasis[J].Genes Dev,2010,24(11):1173-1185.
[8]Iorio MV,Visone R,Di Leva G,et al.MicroRNA signatures in human ovarian cancer[J].Cancer Res,2007,67(18):8699-8707.
[9]Malzkorn B,Wolter M,Liesenberg F,et al.Identification and functional characterization of microRNAs involved in the malignant progression of gliomas[J].Brain Pathol,2010,20(3):539-550.
[10]Zhao W,Zou J,Wang B,et al.microRNA-140 suppresses the migration and invasion of colorectal cancer cells through targeting Smad3[J].Zhonghua Zhong Liu Za Zhi,2014,36(10):739-745.
[11]Tuddenham L,Wheeler G,Ntounia-Fousara S,et al.The cartilage specific microRNA-140 targets histone deacetylase 4in mouse cells[J].FEBS Lett,2006,580(17):4214-4217.
[12]Ma L,Teruya-Feldstein J,Weinberg RA.Tumour invasion and metastasis initiated by microRNA-10b in breast cancer [J].Nature,2007,449(7163):682-688.
[13]Ma L,Reinhardt F,Pan E,et al.Therapeutic silencing of miR-10b inhibits metastasis in a mouse mammary tumor model[J].Nat Biotechnol,2010,28(4):341-347.
[14]Tavazoie SF,Alarcón C,Oskarsson T,et al.Endogenous human microRNAs that suppress breast cancer metastasis [J].Nature,2008,451(7175):147-152.
[15]Huang Q,Gumireddy K,Schrier M,et al.The microRNAs miR-373 and miR-520c promote tumour invasion and metastasis[J].Nat Cell Biol,2008,10(2):202-210.
[16]Ma L,Young J,Prabhala H,et al.miR-9,a MYC/MYCN-activated microRNA,regulates E-cadherin and cancer metastasis[J].Nat Cell Biol,2010,12(3):247-256.
[17]Song B,Wang Y,Xi Y,et al.Mechanism of chemoresistance mediated by miR-140 in human osteosarcoma and colon cancer cells[J].Oncogene,2009,28(46):4065-4074.
[18]Yang H,Fang F,Chang R,et al.MicroRNA-140-5p suppresses tumor growth and metastasis by targeting transforming growth factor β receptor 1 and fibroblast growth factor 9 in hepatocellular carcinoma[J].Hepatology,2013,58(1):205-217.
[19]Yuan Y,Shen Y,Xue L,et al.miR-140 suppresses tumor growth and metastasis of non-small cell lung cancer by targeting insulin-like growth factor 1 receptor[J].PLoS One,2013,8(9):e73604.
[20]楊東,崔雪蓮,劉雙萍,等.HDAC4在乳腺癌中的表達及臨床病理學意義[J].科教文匯,2014,11:103-104.
MicroRNA-140 suppresses the migration and invasion potential of gastric cancer cell through downregulating HDAC4△
WANG Xian-yan1#GAO Feng2ZHAO Chun-ming1SUN Yu-rong1WEN Qiu-ting1YU Xiu-wen1ZHANG Xiao-jie1
1Department of Pathology,Qiqihar Medical University,Qiqihar 161006,Heilongjiang,China
2Department of Anesthesia,the Third Affiliated Hospital of Qiqihar Medical University,Qiqihar 161006,Heilongjiang,China
ObjectiveTo investigate the role of microRNA-140(miR-140)in the migration and invasion potential of gastric cancer(GC)cell and the underlying mechanism.MethodmiR-140 mimics(miR-140),miR-140 specific inhibitor (anti-miR-140)or siRNA against HDAC4(HDAC4 siRNA)were transfected into human GC cell line SGC-7901 respectively using liposome.qRT-PCR was used to measure the expression levels of miR-140 and HDAC4 mRNA.HDAC4 protein was analyzed by Western blot.The in-vitro cell migration and invasion potential was determined by Transwell chamber assays after up-regulating or down-regulating miR-140 or knocking down HDAC4.ResultThe protein expression of HDAC4 was suppressed by miR-140 transfection without altering the target mRNA transcription level.The up-regulation of miR-140,andknock-down of HDAC4 by siRNA both inhibited the migration and invasion potential of SGC-7901 cells,down-regulation of miR-140 by the transfection of anti-miR-140 decreased the expression of HDAC4 protein,and enhanced the migration and invasion potential of SGC-7901 cells.ConclusionmiR-140 directly targets HDAC4 in the transcriptional level.miR-140 suppresses the migration and invasion potential of GC cell,at least partly through the downregulation of HDAC4.The findings of this study suggest that miR-140 may have a unique potential as a novel biomarker candidate for diagnosis and treatmentin tumor metastasis.
gastric cancer;microRNA-140;HDAC4;tumor migration;tumor invasion
R735.2
A
10.11877/j.issn.1672-1535.2016.14.03.09
2015-12-10)
黑龍江省教育廳科學技術研究面上項目(12531804)
(corresponding author),郵箱:wangxianyan1974@163.com

