腦出血大鼠血腫周圍腦組織PN-1、thrombin、PAR-1的表達變化及其相關性
賈文志
(石家莊市第三醫院,石家莊050011)
?
腦出血大鼠血腫周圍腦組織PN-1、thrombin、PAR-1的表達變化及其相關性
賈文志
(石家莊市第三醫院,石家莊050011)
目的觀察腦出血大鼠血腫周圍腦組織中凝血酶(thrombin)抑制劑(PN-1)、thrombin、thrombin受體(PAR-1)的表達變化,并探討PN-1與thrombin、PAR-1的相關性。方法 選取成年健康雄性SD大鼠80只,編號后隨機分為假手術組、腦出血組各40只,腦出血組于右側尾狀核部注射自體動脈血方法制作腦出血實驗大鼠模型,采用神經功能障礙評分評價神經功能障礙程度,采用Western blotting法于造模后3、6、10、12、24、48、120 h檢測兩組腦組織中PN-1、thrombin、PAR-1,并分析其相關性。結果 腦出血組神經功能障礙評分在造模后12、48、120 h均低于假手術組(P均<0.05);腦出血組造模后不同時間腦組織中PN-1、thrombin、PAR-1較假手術組均增高(P均<0.05),腦出血組腦組織中PN-1、thrombin、PAR-1在造模后12 h或24 h出現逐漸下降的趨勢(P均<0.05);腦出血組血腫周圍腦組織PN-1與thrombin、PAR-1均呈負相關關系(r分別為-0.872、-0.698,P均<0.05)。結論 腦出血大鼠血腫周圍腦組織中PN-1、thrombin及PAR-1均升高,PN-1與thrombin及PAR-1呈負相關關系。
腦出血;凝血酶抑制劑;凝血酶;凝血酶受體;大鼠
動脈粥樣硬化、糖尿病以及高血壓等基礎疾病增加了腦出血的發生風險,近五年來相關臨床統計分析結果顯示腦出血導致的病死率明顯增高。顱內出血同時可引起患者出現認知功能、語言功能以及中樞神經系統功能障礙,嚴重降低了腦出血患者的生存質量。目前臨床上對于腦出血的內科治療尚無特效療法,主要通過脫水等對癥處理,但外科治療的整體臨床獲益情況仍存在爭議[1, 2]。腦出血患者急性期主要表現為腦組織水腫,而出血部分腦組織的水腫程度對于內、外科治療效果有重要的意義。部分研究發現在腦水腫組織周邊存在凝血酶(thrombin)的異常表達[3]。本研究重在探討thrombin抑制劑(PN-1)、thrombin、thrombin受體(PAR-1)在腦出血周邊水腫組織內的表達情況,進而揭示thrombin對于腦出血的診治意義。
1 材料與方法
1.1材料實驗動物:選取成年健康雄性SD大鼠80只,體質量250~300 (272.4±13.9)g,購自河北醫科大學動物實驗研究中心(SCXK(冀)2014-00002),喂養于23~25 ℃、濕度40%~60%、光照12 h、自由進食進水的環境中。實驗試劑:羊抗thrombin抗體、羊抗PN-1抗體、鼠抗PAR-1抗體、HRP標記的羊和鼠的二抗均購于武漢博士德生物技術有限公司,Hybond-C硝酸纖維素膜購于Amersham公司。實驗儀器:立體定向儀(MA-1型,日木NARISHIGE公司),微量注射泵(Miero4型,World Preeision Instruments),電泳儀(Bio-Rad公司),光學顯微鏡(DP700型,Olympos公司),低溫離心機(LXJ-H型,上海醫用分析儀器廠)。
1.2分組及建模80只大鼠編號后隨機分為假手術組、腦出血組各40只。腦出血組大鼠以10%水合氯醛(330 mg/kg)腹腔麻醉后,剪尾取50 μL自體新鮮不凝血,于前囟前0.22 mm、中線向左旁開3 mm處鉆孔,在立體定向儀引導下緩慢進針注血。進針深約5 mm(此為左側尾狀核位置),進針時間3~5 min,留針時間10 min,之后緩慢退針。實驗前后各組大鼠均可自由進食水。假手術組除腦內不注入血液外.其余操作同腦出血組。模型成功的判定標準為術后見明顯肢體癱瘓,沿針道冠狀面切開腦組織可見血腫形成。
1.3神經功能障礙程度的評價分別于術后第12、24、120小時采用Garica等[4]制定的大鼠神經功能障礙評分標準對兩組神經功能障礙程度進行評價。最高18分、最低3分,分數越低表示神經功能障礙越嚴重。
1.4腦組織病理學特征的觀察采用石蠟脫水,微波修復,枸櫞酸緩沖液98 ℃、5 min,之后采用3%的過氧化氫抑制10 min,在50%的石蠟二甲苯液中浸蠟10 min,100%的石蠟液中浸蠟10 min,DAB顯色,蘇木素復染、脫水(85%1次、95%2次、無水乙醇2次、無水乙醇和二甲苯各半1次、純二甲苯2次),封片、40倍物鏡下鏡檢。
1.5大鼠腦組織中PN-1、thrombin、PAR-1的檢測分別于造模后第3、6、10、12、24、48、120小時采用Western blotting法檢測。冰上分離出血腫周邊腦組織(假手術組為左側尾狀核),置于預冷的研缽中液氮研磨至粉末狀。冰上靜置l h,4 ℃、14 000 r/min離心30 min,去沉淀組織留上清,考馬斯亮藍顯色法測定蛋白濃度,分裝。-70 ℃凍存。按總蛋白80 μg計算上樣體積,4∶1的比例加上樣緩沖液,每條泳道加20 μL樣品緩沖液,于60 V電壓下電泳,脫脂蛋白封閉2 h后加入羊抗PN-1抗體(1∶200)、羊抗thrombin抗體(1∶500)、鼠抗PAR-1抗體(1∶150),2 h后加入二抗。Image proplus 4.01版本的專業圖像分析軟件對蛋白條帶進行灰度掃描,測定其灰度值。
2 結果
2.1兩組病理學特征比較在400倍的光鏡下觀察腦出血組、假手術組大鼠腦出血周圍腦組織,可見假手術組大鼠腦組織結構清晰完整,神經細胞排列整齊,未發現明顯的細胞腫脹、細胞核固縮及溶解。腦出血組在造模第12、48、120小時可見明顯的細胞排列紊亂、核溶解、固縮,炎癥細胞浸潤,可見部分腦組織出現液化壞死、呈空腔隙狀。
2.2各組不同時間點神經功能障礙評分比較 見表1。
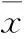
表1 各組不同時間點的神經功能障礙評分比較(分,±s)
注:與假手術組比較,*P<0.01。
2.3各組不同時間點腦組織PN-1、thrombin、PAR-1水平比較見表2。
2.4腦出血組血腫周圍腦組織PN-1、thrombin、PAR-1的相關分析腦出血組血腫周圍腦組織中PN-1與thrombin、PAR-1均呈負相關關系(r分別為-0.872、-0.698,P均<0.05)。
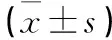
表2 各組PN-1、thrombin、PAR-1水平比較
注:與假手術組比較,△P<0.05;與造模后10 h或12 h比較,▲P<0.05。
3 討論
腦出血患者經內科治療或者外科清除血腫后,部分會合并神經系統功能損傷,言語、聽寫以及運動功能損傷較為突出[5]。除了顱內血管出血部位及出血程度的影響,對于腦出血患者腦組織周邊水腫程度的分析也有利于揭示患者術后出現不同并發癥的原因,并有利于預后判斷。thrombin為內源性以及外源性凝血途徑的共同作用通路,thrombin活性或者量的異常對于維持血管內凝血機制具有重要意義。thrombin的異常表達可能預示彌漫性血管內凝血的凝血狀態、疾病轉歸以及病情程度,而其在腦出血中的研究較少。近年部分學者發現,在基底節腦出血周邊組織中存在thrombin的異常激活和上調,其受體PAR-1表達也異常增高[6]。正常腦組織中,中樞神經系統的神經元包括大腦皮層扣帶回、皮質、下丘腦核團、丘腦腹側、中腦、海馬和小腦的神經元,均存在一定程度的PAR-1表達,但HE染色多數較弱,蛋白水平表達程度較低,而血管內皮細胞中PAR-1的表達情況不明[7,8]。PN-1通過阻斷thrombin與細胞膜表面PAR-1的結合,進而降低細胞內三磷酸尿苷以及酪氨酸激酶的活性,下調在Xa因子的作用下通過蛋白裂解方式產生的凝血活酶,抑制thrombin對于腦水腫組織的損傷作用[9]。本次研究重在探討thrombin、PN-1以及PAR-1在大鼠腦出血模型中的表達情況。
本研究結果顯示,兩組造模后,腦出血組神經功能障礙評分明顯降低,HE染色可以發現假手術組腦組織結構清晰完整,神經細胞排列整齊,而腦出血組腦細胞水腫以及壞死較為嚴重,細胞核崩解、碎裂,周邊神經膠質細胞可見部分腔隙樣以及液化性壞死,提示本次造模成功。本研究發現,PN-1、thrombin、PAR-1在腦出血大鼠腦組織中異常表達,其表達水平明顯高于假手術組,考慮腦出血對于腦組織的損傷不僅通過局部壓迫、血液凝固機化的損傷以及牽拉等作用,還有thrombin以及PAR-1的表達異常上升,促進神經纖維的細胞毒性損傷作用。時間特異度分析可見,在腦出血大鼠水腫吸收恢復期,thrombin以及PAR-1、PN-1等呈現了下降趨勢。腦出血后12 h內,thrombin促進腦血管通透性改變,引起PAR-1對于水腫部位腦組織的損傷;而造模后12 h,由于腦水腫部位部分水通道的關閉,thrombin以及PAR-1對于受損部位神經纖維的水通道開放作用減弱,表達水平降低。PN-1通過特異性抑制thrombin對于炎癥因子以及小膠質細胞的富集作用,進而降低腦水腫程度[10,11]。本研究結果顯示,腦出血組血腫周圍腦組織中PN-1與thrombin、PAR-1均呈負相關關系。考慮PN-1作為神經系統內存在的特異性較高的thrombin抑制劑,可以與thrombin的非催化中心位點結合,形成十二烷基磺酸鹽復合物,與損傷的神經纖維表面糖蛋白結合,通過脂蛋白受體相關蛋白或者細胞膜的胞飲作用進入細胞內被降解或清除,減輕了thrombin以及PAR-1對于腦水腫細胞的損傷。
綜上所述,腦出血大鼠血腫周圍腦組織中PN-1與thrombin、PAR-1異常表達,PN-1與thrombin、PAR-1表達呈負相關關系。其中thrombin、PAR-1與腦水腫損傷有關,而PN-1可減輕thrombin對于腦出血周邊神經細胞的損傷作用,提示其可以作為腦出血患者內科治療的新途徑,通過在腦出血急性期外源性注射PN-1細胞因子,進而減輕腦出血水腫細胞損傷,改善臨床預后。
[1] 楊啟勝,張入川.小骨窗開顱皮層小切口手術治療高血壓腦出血療效[J].現代儀器與醫療,2014,22(4):87-88.
[2] 楊瑞玲,吳成翰,王開宇.腦出血中風閉、脫證患者血漿及血腫引流液凝血酶-抗凝血酶復合物表達臨床觀察[J].中國中西醫結合雜志,2012,25(3):338-342.
[3] 王亮,張建富,劉海珠.凝血酶在腦出血中的作用研究現狀[J].山東醫藥,2014,54(15):95-97.
[4] Garcia JH, Liu KF, Yoshida Y, et al. Influx of leukocytes and platelets in an evolving brain infarct (Wistar rat)[J]. Am J Pathol, 1994,144(1):188-199.
[5] 李萍,趙樹明,胡亞男,等.腦出血發病機制研究進展[J].中華老年心腦血管病雜志,2015,26(2):214-215.
[6] 劉寶華,白光輝,鄔偉,等.大鼠腦出血后IL-1β和CD163/HO-1信號通路表達及其與腦水腫的相關性[J].浙江創傷外科,2014,32(3):348-350.
[7] 何志義.microRNA與腦出血后腦水腫機制研究進展[J].中國醫科大學學報,2014,43(11):961-964.
[8] 尹澤黎,劉育進,許宏偉.高血壓腦出血凝血酶與腦水腫的臨床研究[J].中風與神經疾病雜志,2010,27(3):244-247.
[9] 于垚,吳俊,趙偉,等.自動校正凝血酶曲線法監測腦出血患者凝血功能的初步研究[J].中華老年心腦血管病雜志,2015,27(1):70-72.
[10] 周慶博,賈青,張媛,等.黃芩苷對腦出血大鼠腦組織凝血酶受體-1表達及細胞凋亡的影響[J].中國中西醫結合雜志,2010,33(12):1302-1305.
[11] D′Audigier C, Delassasseigne C, Robert A, et al. Underestimation of plasma level of factor V coagulant activity and fibrinogen concentration together with prolonged prothrombin time, activated partial thromboplastin time and thrombin time can result from pre-analytical very low calcium level in citrated sample tube[J]. Int J Lab Hematol, 2015,27(3):237-246.
10.3969/j.issn.1002-266X.2016.29.012
R722.15
A
1002-266X(2016)29-0036-03
2015-10-09)

