非酒精性脂肪肝患者血清鐵蛋白水平變化及意義
馬會民,白萍萍,張連仲,曹興國,李進營
(河南省人民醫院,鄭州450003)
?
·臨床研究·
非酒精性脂肪肝患者血清鐵蛋白水平變化及意義
馬會民,白萍萍,張連仲,曹興國,李進營
(河南省人民醫院,鄭州450003)
目的探討非酒精性脂肪肝(NAFLD)患者血清鐵蛋白水平變化及意義。方法 選取NAFLD患者243例為NAFLD組,體檢健康者486例為對照組,檢測血脂、體質量指數(BMI)、血壓、肝功能、空腹血糖(FPG)、糖化血紅蛋白(HbA1c)、血尿酸以及血清鐵蛋白等生化指標,并利用FibroScan測量肝臟受控衰減參數(CAP),分析血清鐵蛋白與NAFLD發病及其與上述指標的相關性。結果 NAFLD組靜坐時間、FPG、BMI、ALT、γ-GT、尿酸、TC、血清鐵蛋白水平和CAP高于對照組(P均<0.05),HDL-C水平低于對照組(P<0.05)。兩組HbA1c、收縮壓、舒張壓和LDL-C比較差異無統計學意義(P均>0.05)。血清鐵蛋白水平與BMI、γ-GT、TC、CAP呈正相關(P均<0.05)。結論 NAFLD患者血清鐵蛋白水平升高,其可能通過影響肝臟脂質代謝參與NAFLD進展。
非酒精性脂肪肝;血清鐵蛋白;肝功能;受控衰減參數
非酒精性脂肪肝(NAFLD)不僅影響患者的肝臟系統,還與高血壓、冠心病、糖尿病、病態肥胖、高脂血癥、胰島素抵抗等有密切聯系[1,2]。血清鐵蛋白(SF)在許多惡性腫瘤、肝臟疾病、血液系統疾病中均可增高。本研究探討了NAFLD患者SF水平的變化及其意義。現報告如下
1 資料與方法
1.1臨床資料選擇2014年8月~2015年1月在本院行體檢且相關臨床資料完整的NAFLD患者243例,均符合2012年美國肝臟病學會公布的診斷標準[3],并排除具有血液系統、惡性腫瘤及其他肝臟疾病的患者,其中男148例、女95例,年齡(35.04±11.79)歲;本科及以上學歷183例,本科以下學歷60例;有吸煙史77例,無吸煙史166例。同時選取486例健康人群作為對照組,其中男275例、女211例,年齡(38.68±13.80)歲;本科及以上學歷389例,本科以下學歷97例;有吸煙史170例,無吸煙史316例。兩組性別、年齡、學歷及吸煙史基線資料中有可比性。
1.2體質量指數(BMI)及血壓的測算采用血壓計測量血壓。測量身高、體質量,計算BMI。
1.3血清學指標的檢測抽取空腹靜脈血,采用OLYMPUSAU2700檢測儀檢測空腹血糖(FPG)、糖化血紅蛋白(HbA1c)、丙氨酸氨基轉移酶(ALT)、γ氨基丁酸(γ-GT)、總膽固醇(TC)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)。采用美國貝克曼DXC-800全自動生化分析儀電化學方法檢測血尿酸(SUA),采用西門子 Centaur 全自動免疫分析儀放射免疫法檢測血清鐵蛋白(SF)等。
1.4NAFLD受控衰減參數(CAP)的檢測采用FibroScan(法國Echosens公司)瞬時彈性成像診斷儀(FibroScan-502型-M探頭)檢測。所有檢測由同一個取得FibroScan操作證書的醫師完成,并嚴格按照使用手冊進行檢測。確定合適的檢測部位進行測量,測量深度為2.5~6.5 cm,對同一測量點進行10次有效測量,取其中位數作為最終測得結果。
2 結果
2.1兩組靜坐時間、BMI、血糖、血壓比較 NAFL組的靜坐時間<4 h/d為137例,≥4 h/d者為106例;對照組的靜坐時間<4 h/d者為317例,≥4 h/d者為169例;兩組比較差異有統計學意義(P=0.020)。兩組BMI、FPG、HbA1c、血壓比較見表1。
2.2兩組肝功、SUA、血脂、CAP、SF比較見表2。
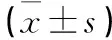
表1 兩組BMI、FPG、HbA1c、血壓比較
注:與對照組比較,*P<0.01。
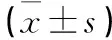
表2 兩組肝功、SUA、血脂、CAP、SF比較
注:與對照組比較,*P<0.05,**P<0.01。
2.3NAFLD危險因素的多因素分析應用二分類變量Logistic回歸模型對靜坐時間、FPG、BMI、ALT、γ-GT、SUA、TC、HDL-C以及SF等指標進行逐步回歸分析。結果表明,靜坐時間、FPG、BMI、ALT、γ-GT、SUA、TC、HDL-C以及SF水平與NAFLD獨立相關。但是考慮到NAFLD患者ALT水平的變化可能是由于NAFLD所引起,所以最后認定靜坐時間(OR=1.228, 95%CI1.186~1.346)、BMI(OR=1.156, 95%CI1.006~1.279)、TC(OR=1.008, 95%CI1.005~1.009)、HDL-C(OR=0.757, 95%CI0.672~0.854)和SF(OR=1.156, 95%CI1.432~1.501)水平是NAFLD的獨立危險因素。
2.4SF與其他危險因素的關聯分析以SF為因變量,其他危險因素為自變量進行多元逐步回歸分析見表3。對于進入回歸方程的變量進行Pearson偏相關分析,結果顯示:BMI、γ-GT、TC、CAP與SF呈正相關(r分別為0.245、0.367、0.367、0.009,P分別為0.028、0.019、0.019、0.214)。

表3 血清SF與其他危險因素間逐步回歸分析結果
3 討論
SF是人體內鐵的主要貯存形式,是除血紅蛋白以外含鐵最豐富的蛋白質,SF是體內最重要的鐵源。當人體攝入鐵量增加,SF亦增加,當機體中鐵蛋白貯量過多時,一部分可轉變為含鐵血黃素,所以SF是反映體內鐵負荷過多的有效指標[4]。鐵元素是人體代謝所必需的微量元素,但是體內過多的鐵能夠通過調節自由基的釋放從而對人體組織和器官造成損傷,繼而導致多種臟器病變。一般認為鐵蛋白>300 μg/L且轉鐵蛋白飽和度>45%即可診斷為鐵過量。
NAFLD是一類由遺傳、環境、代謝、應激相關因素所致的以肝細胞脂肪變性為主的臨床病理綜合征,可導致肝硬化、肝癌等一系列并發癥,并且在我國發病率呈上升趨勢[5,6]。肝臟是人體脂肪代謝的主要器官,生理狀態下肝臟對脂肪的代謝維持動態平衡,而一旦體內脂肪的生成超過了肝臟代謝的能力,則會形成脂肪肝。近年有研究證實,大多數NAFLD患者的肝臟組織存在鐵過載,并且鐵在肝臟的沉積與臨床癥狀惡化以及肝相關疾病病死率密切相關[7,8]。本研究表明,NAFLD患者中SF水平較健康人群顯著升高,同時經過單因素和多因素Logistic回歸分析提示SF是NAFLD獨立危險因素,與文獻[8,9]報道一致。提示NAFLD患者血清鐵過載。鐵是人類機體最為重要的脂質過氧化反應促進劑,它可以促進機體產生過量的自由基,破壞肝細胞的細胞器,其中以對溶酶體膜的破壞最為顯著,最終造成肝細胞死亡;并且可通過增強脂質過氧化促進脂肪性肝炎和肝纖維化的發生;同時肝細胞的死亡能夠使肝細胞內貯存的鐵釋放,鐵進入血中,又進一步加重血清鐵過載,形成惡性循環。
國內外研究已證實,BMI、TC是代謝綜合征發生的獨立危險因素。本研究中,與對照組相比,NAFLD患者的BMI和TC顯著升高;我們通過分析SF水平與其他NAFLD發生的危險因素之間的關系發現,SF水平與BMI和TC相關。提示SF在代謝綜合征發生過程中起到了促進作用,繼而間接影響到NAFLD的發生。CAP是利用超聲衰減原理來檢測人體肝臟脂肪變程度的新型無創檢測指標,同時CAP可測量的肝臟體積是肝活檢組織條的100倍。國內外臨床試驗初步認為,CAP可以無創、準確、定量地評價肝脂肪變,并且不同程度脂肪變的CAP值有差異,CAP值與肝脂肪變程度顯著相關[10~12]。本研究結果顯示,NAFLD組CAP明顯高于正常健康人群,進一步相關性分析結果顯示SF和CAP值呈正相關,提示SF可能通過肝臟脂質代謝而影響NAFLD的疾病進程。
[1] Lonardo A, Carani C, Carulli N, et al. Endocrine NAFLD′ a hormonocentric perspective of nonalcoholic fatty liver disease pathogenesis[J] . J Hepatol, 2006,44(6):1196-1207.
[2] 茅益民,曾民德.加強非酒精性脂肪性肝病的臨床和轉化醫學研究[J].實用肝臟病雜志,2012,15(4):273-275.
[3] Walters G, Miller F, Worwood M. Serum ferritin concentration and iron stores in normal subjects[J]. J Clin Pathol, 1973,26(10):770-772.
[4] Wong VW, Chu WC, Wong GL, et al. Prevalence of non-alcoholic fatty liver disease and advanced fibrosis in Hong Kong Chinese: a population study using proton-magnetic resonance spectroscopy and transient elastography[J]. Gut, 2012,61(3):409-415.
[5] Iser D, Ryan M.Fatty liver disease—a practical guide for GPs[J].Aust Fam Physician, 2013,42(7):444-447.
[6] Kowdley KV, Belt P, Wilson LA, et al. Serum ferritin is an independent predictor of histologic severity and advanced fibrosis in patients with nonalcoholic fatty liver disease[J]. Hepatology, 2012,55(1):77-85.
[7] Utzschneider KM, Largajolli A, Bertoldo A, et al. Serum ferritin is associated with non-alcoholic fatty liver disease and decreased Β-cell function in non-diabetic men and women[J]. J Diabetes Complications, 2014,28(2):177-184.
[8] 黃聰武,白嵐,崔生達,等.血清鐵,鐵蛋白和脂肪肝關系的研究[J].中華消化雜志, 2003,23(4):211-212.
[9] Lédinghen V, Vergniol J, Foucher J, et al. Non-invasive diagnosis of liver steatosis using controlled attenuation parameter (CAP) and transient elastography[J]. Liver Int, 2012,32(6):911-918.
[10] Friedrich-Rust M, Romen D, Vermehren J, et al. Acoustic radiation force impulse-imaging and transient elastography for non-invasive assessment of liver fibrosis and steatosis in NAFLD[J]. Eur J Radiol, 2012,81(3):e325-e331.
[11] de Lédinghen V, Vergniol J, Capdepont M, et al. Controlled attenuation parameter (CAP) for the diagnosis of steatosis: a prospective study of 5323 examinations[J]. J Hepatol, 2014,60(5):1026-1031.
[12] Chitturi S, Weltman M, Farrell GC, et al. HFE mutations, hepatic iron, and fibrosis: ethnic-specific association of NASH with C282Y but not with fibrotic severity[J]. Hepatology, 2002,36(1):142-149.
河南省基礎研究計劃項目(132300410408)。
10.3969/j.issn.1002-266X.2016.29.014
R575
B
1002-266X(2016)29-0042-03
2016-04-08)

