2型糖尿病腎病患者血清及尿液血管生成素樣蛋白4的表達變化及意義
李文娜,崔靜,于曉,邱世磊,張燕
(青島大學醫學院附屬煙臺毓璜頂醫院,山東煙臺264000)
?
2型糖尿病腎病患者血清及尿液血管生成素樣蛋白4的表達變化及意義
李文娜,崔靜,于曉,邱世磊,張燕
(青島大學醫學院附屬煙臺毓璜頂醫院,山東煙臺264000)
目的觀察2型糖尿病腎病(T2DN)患者血清及尿液血管生成素樣蛋白4(Angptl4)的表達變化,并探討其臨床意義。方法 選取2型糖尿病患者80例,根據病情將其分為單純糖尿病(NON)組、T2DN微量蛋白尿(MIC)組、T2DN臨床蛋白尿(MAC)組、晚期T2DN(CKD)組,各20例;選取體檢健康者20例為作為正常對照(CON)組,采用ELISA法檢測血清及尿液Angptl4表達量,并與血脂、尿白蛋白/肌酐(UAlb/Cr)進行相關分析。結果 CON、NON、MIC、MAC、CKD組血清Angptl4水平分別為 (34.88±6.19)、(30.15±3.67)、(29.87±6.70)、(23.55±4.13)、(21.06±2.79)ng/mL,依次逐漸降低(P﹤0.05或﹤0.01);尿液中Angptl4水平分別為(1.57±0.39)、(1.85±0.19)、(2.55±0.37)、(3.56±0.64)、(5.24±1.52)ng/mL,逐漸增加(P﹤0.05或﹤0.01)。MIC、MAC、CKD組血清及尿液Angptl4水平呈負相關(r=-0.466,P<0.05)。MIC、MAC、CKD組血清Angptl4水平與TG、TC、LPa呈正相關(r分別為0.539、0.620、0.673,P均<0.05;r分別為0.262、0.354 、0.471,P均<0.05;r分別為0.512 、0.438 、0.518,P均<0.05),與BMI、HbA1c、UAlb/Cr呈負相關(r分別為-0.605、-0.591、-0.685,P均<0.05;r分別為-0.641、-0.639、-0.644,P均<0.05;r分別為-0.545、-0.611 、-0.632,P均<0.05)。MIC、MAC、CKD組尿液Angptl4水平與BMI、HbA1c、UAlb/Cr呈正相關(r分別為0.613、0.603、0.670,P均<0.05;r分別為0.588、0.612、0.611,P均<0.05;r分別為0.561、0.416、0.318,P均<0.05),與HDL-C呈負相關(r分別為-0.599、-0.510、-0.618,P均<0.05),與TG、TC、LPa無明顯相關。結論 T2DN患者血清Angptl4水平降低,尿液Angptl4水平升高,且隨病情加重這種改變更顯著;尿液Angptl4水平的變化與蛋白尿密切相關,可能會成為T2DN早期診斷及病程進展的標志物。
2型糖尿病腎病;血管生成素樣蛋白4;蛋白尿
血管生成素樣蛋白4(Angptl4)又被稱為過氧化物酶體增殖物激活型受體(PPAR),是血管生成素樣蛋白家族的重要成員,主要分布在肝臟、脂肪組織、心肌、骨骼肌、腎臟[1]。大多數嚙齒動物外周血循環中的Angptl4是由肝臟分泌的Angptl4裂解片段,且可與血液循環中的高密度脂蛋白微粒結合[2]。最近研究發現,微小病變性腎病(MCD)患者足細胞、外周血清及尿液中Angptl4水平均升高,進一步研究發現腎小球組織過度分泌的Angptl4與足細胞損傷、蛋白尿密切相關。目前研究已證實,足細胞結構和功能改變在2型糖尿病腎病(T2DN)發生發展過程中起著關鍵作用[3]。但關于Angptl4在T2DN中的研究較少,本研究觀察了T2DN患者不同病程分期血清及尿液Angptl4的表達量變化,并探討血清及尿液Angptl4水平與蛋白尿、血脂等關系,從而為T2DN蛋白尿的治療提供新思路。
1 資料與方法
1.1臨床資料 選取2014年10月~2015年8月本院腎內科及內分泌科住院的2型糖尿病患者80例,均符合美國糖尿病學會2007年版糖尿病診斷標準。男51例、女49例,平均年齡59歲。按照MogensenT2DN的分期標準,將其分為單純糖尿病(NON)組、T2DN微量蛋白尿(MIC)組、T2DN臨床蛋白尿(MAC)組、晚期T2DN(CKD)組,各20例。另外選取我院體檢中心體檢健康者20例作為正常對照(CON)組。5組年齡、性別、BMI、血壓均有可比性。排除1型糖尿病及其他特殊類型糖尿病患者;腫瘤、感染者;近3個月內曾發生糖尿病酮癥酸中毒(DKA)及其他急性并發癥者;其他急慢性腎臟病患者;肝功異常、原發性高尿酸血癥、甲狀腺功能紊亂、心力衰竭、發熱、尿路感染者;近期使用過影響腎功能的藥物;依從性差、血糖難以控制者。研究對象均同意,并簽署知情同意書。
1.2生化指標檢測采用全自動生化儀檢測甘油三酯(TG)、總膽固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、脂蛋白a(Lpa)等生化指標。采用高壓液相法測定糖化血紅蛋白(HbA1c)。采用日立7170A型生化分析儀、比濁法檢測尿白蛋白(UAlb),速率法檢測尿肌酐(Cr),再計算UAlb/Cr。
1.3血清及尿液Angptl4水平的測定留取各組清晨空腹靜脈血3 mL及尿液5 mL,離心后采用ELISA法分別檢測Angptl4的水平,試劑盒由Abnova公司提供。
2 結果
2.1各組HbA1c、血脂及UAlb/Cr比較見表1。
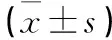
表1 各組HbA1c、血脂及UAlb/Cr比較
注:與CON組比較,aP<0.05;與NON組比較,bP<0.05;與MIC組比較,cP<0.05;與CKD組比較,eP<0.05。
2.2兩組血清、尿液Angptl4水平比較見表2。CON、NON、MIC、MAC、CKD組尿Angptl4水平逐漸升高,血清Angptl4水平逐漸降低(P<0.05或<0.01)。

表2 兩組血清、尿液Angptl4水平比較
注:與CON組比較,aP<0.05;與NON組比較,bP<0.05;與MIC組比較,cP<0.05;與MAC組比較,dP<0.05。
2.3血清及尿液Angptl4水平相關分析CON、NON、MIC、MAC、CKD組血清Angptl4水平是逐漸降低的(P均<0.05),而尿液Angptl4水平則是逐漸升高的(P均<0.05),且兩者間呈負相關(r=-0.466,P<0.05)。
2.4MIC、MAC、CKD組血清及尿液Angptl4水平與其他指標相關分析MIC、MAC、CKD組中血清Angptl4水平與TG、TC、LPa均呈正相關(r分別為0.023、0.027、0.031,0.038、0.021、0.022,0.040、0.026、0.016;P均<0.05),與BMI、HbA1c、UAlb/Cr呈負相關(r分別為-0.605、-0.591、-0.685,-0.641、-0.639、-0.644,-0.545、-0.611、-0.632;P均<0.05);而尿液Angptl4水平則與BMI、HbA1c、UAlb/Cr呈正相關(r分別為0.613、0.603、0.670,0.588、0.612、0.611,0.561、0.416、0.318;P均<0.05),與HDL-C呈負相關(r分別為-0.599、-0.510、-0.618,P均<0.05),與TG、TC、LPa沒有明顯相關性。
3 討論
本研究發現,NON組血清Angptl4水平較CON組明顯降低,這與既往相關研究[4]結果是一致的,可能與糖尿病患者的糖代謝紊亂及胰島素抵抗有關。有研究發現,血清胰島素的分泌增加可抑制Angptl4的分泌和表達[5]。本研究還發現T2DN患者血清Angptl4水平隨著病情的進展逐漸降低,提示低水平的血Angptl4參與T2DN病情的進展,與疾病進展的嚴重程度密切相關。Clement等[6]研究發現,微小病變性腎病(MCD)、膜性腎病、局灶節段增生性腎病患者血循環中Angptl4水平是升高的,且升高的Angptl4有減少蛋白尿導致高甘油三酯血癥的作用。本研究卻發現T2DN患者血清Angptl4水平是降低的,且其與TG、TC、Lpa呈正相關,與UAlb/Cr呈負相關,這可能與Angptl4抑制脂蛋白脂肪酶活性,使TG的清除減少有關。Georgiadi等[7]研究亦表明,在Angptl4敲除的小鼠中其血液循環中TG水平是降低的,故推測血Angptl4與糖尿病脂質代謝密切相關。T2DN患者血清Angptl4水平與 UAlb/Cr呈負相關,即血清Angptl4水平越高,尿白蛋白排泄率則越低,這提示血清中升高的Angptl4對腎臟有一定的保護作用,可以減少蛋白尿。其機制可能是Angptl4與腎小球內皮細胞上的αvβ5整合素結合有關[8]。
Chugh等[9]動物實驗研究發現,MCD的發生與腎小球內Angptl4表達及結構變化而非血液循環中Angptl4的水平有關,進一步研究發現腎小球的足細胞可過度分泌兩種形式的Angptl4即中性形式等電點(PI)≤7和帶正電荷形式high-PI(8~8.5,其Angptl4唾液酸化不足),且high-PI Angptl4可與帶負電荷的硫酸類肝素蛋白多糖相互作用引起腎小球基底膜電荷屏障改變。故認為足細胞分泌的唾液酸化不足的Angptl4導致腎小球基底膜電荷屏障受損,可能是MCD蛋白尿形成的重要機制。目前的研究證實,足細胞損傷在T2DN的發生發展過程中起著關鍵作用,且與蛋白尿密切相關。最近Ma等[10]研究也首次證實了腎小球組織高表達Angptl4,并且發現腎組織Angptl4是由足細胞分泌的與血循環中Angptl4水平無關,而且腎組織高表達的Angptl4可在尿液中檢測到。本研究通過檢測T2DN患者不同分期尿液中Angptl4水平,發現T2DN組尿液Angptl4的水平較CON組和NON組明顯升高,且比尿白蛋白出現的早,根據既往研究認為血清與尿液Angptl4的形式不同,即血清Angptl4是高階寡聚合物,不能通過腎小球的濾過膜,而尿液Angptl4則是低階寡聚合物,能通過濾過膜[10]。提示尿液Angptl4是由T2DN早期受損的腎小球足細胞所分泌的,因此,尿液Angptl4可作為T2DN診斷的標志物。此外,T2DN患者尿液Angptl4與UAlb/Cr呈正相關,隨著蛋白尿的增加而升高,這可能與腎小球足細胞過度分泌的Angptl4導致基底膜電荷屏障受損的程度有關,提示尿液Angptl4水平的變化可作為反映T2DN病情進展的指標。
本研究還發現,血清與尿液Angptl4的水平呈負相關,這可能與兩者來源不同有關。血清Angptl4主要是由外周骨骼肌、脂肪組織等分泌,而尿液Angptl4則由腎小球足細胞所分泌。另外,Angptl4的表達受PPAR的調節,其有3種亞型分別是PPARα、γ、δ/β。研究表明,Angptl4分泌蛋白可能是PPAR-γ分泌蛋白的下游靶基因,PPAR-γ可調控Angptl4的表達,給予NPHS2-Angptl4鼠口服ManNAC前體后,其蛋白尿可明顯降低,而給糖尿病大鼠靜脈注射重組人Angptl4也可減少其蛋白尿[11,12]。這提示補充唾液酸前體或注射重組人Angptl4可能會成為治療腎臟病蛋白尿的一種新方法。
綜上所述,T2DN患者血清Angptl4水平隨著病情的進展逐漸降低,而尿液Agptl4水平則逐漸升高,且兩者呈負相關。尿液Angptl4與T2DN患者血脂代謝、蛋白尿密切相關,在T2DN病程進展中起重要作用,可能會成為T2DN診斷及提示病程進展的新標志物,并為T2DN蛋白尿的治療提供新思路。
[1] Yoon JC, Chickering TW, Rosen ED, et al. Peroxisome proliferator-activated receptor gamma target gene encoding a nove angiopoietinrelated protein associated with adipose differentiation[J]. Mol cell Biol, 2000,20(14):5343-5349.
[2] Kersten S, Mandard S, Tan NS, et al. Characterization of the fasting-induced adipose factor FIAF, a nove peroxisome proliferator-activated recptor target gene[J]. Boil Chem, 2000,275(37):28488-28493.
[3] Ziyadeh FN, Wolf G. Pathogenesis of the podocytopathy and proteinuria indiabetic glomerulopathy[J]. Curr Diabetes Rev, 2008,4(1):39-45.
[4] 王弈,周勇,肖元元,等.血清脂肪因子4與肥胖及2型糖尿病的相關性[J].中華內分泌代謝雜志,2014,30(2):106-109.
[5] van Raalte DH, Brands M, Serlie MJ, et al. Angiopoietin-like protein 4 is differentially regulated by glucocorticoids and insulin in vivo and in vitro in healthy humans[J]. Exp Clin Endocrinol Diabetes, 2012,120(10):598-603.
[6] Clement LC, Macé C, Avila-Casado C, et al. Circulating angipoietin-like 4 linke proteinuria with hypertriglyceridemia in nephropic syndrome[J]. Nat med, 2014,20(1):37-46.
[7] Georgiadi A, Wang Y, Stienstra R, et al. Overexpression of angiopoietin-like protein 4 protects against atherosclerosis development[J]. Arterioscler Thromb Vasc Biol, 2013,33(7):1529-1537.
[8] Vaziri ND, Moradi H. Dual role of circulating angiopoietin-like 4(ANGPTL4) in promoting hypertriglyceridemia and lowering proteinuria in naphrotic syndrome[J]. Am J Kindey Dis, 2014,64(4):495-498.
[9] Chugh SS, Clement LC, Macé C, et al. New insights into human minimal change disease: lessons from animal models[J]. Am J Kindey Dis, 2012,59(2):284-292.
[10] Ma J, Chen X, Li JS, et al. Upregulation of podocyte-secreted angiopoietin-like 4 in diabetic nephropathy[J]. Endocrine, 2015,49(2):373-384.
[11] Korecka A, de Wouters T, Cultrone A, et al. ANGPTL4 expression induced by butyrate and rosigliazone in human intestinal epithelial cells utilizes independent pathways[J]. Am J Physiol Gastrointest Liver Physiol, 2013,304(11):1025-1037.
[12] Clement LC, Avila-Casado C, Macé C, et al. Podocyte-secreted angiopoietin-like 4 mediates proteinuria in glucocorticoid-sensitive nephritic syndrome[J]. Nat Med, 2011,17(1):117-122.
10.3969/j.issn.1002-266X.2016.29.016
R587.2
B
1002-266X(2016)29-0047-03
2016-03-14)

