糖代謝異常患者頸動脈斑塊形成的危險因素分析
周歡歡,孔維敏,楊婷婷,郝書婕,樓青青
(1南京中醫藥大學護理學院,南京210000;2南京中醫藥大學附屬江蘇省中西醫結合醫院;3鹽城市第一人民醫院)
?
糖代謝異常患者頸動脈斑塊形成的危險因素分析
周歡歡1,孔維敏3,楊婷婷1,郝書婕1,樓青青2
(1南京中醫藥大學護理學院,南京210000;2南京中醫藥大學附屬江蘇省中西醫結合醫院;3鹽城市第一人民醫院)
目的探討糖代謝異常人群頸動脈斑塊的相關危險因素。方法 選取行頸動脈超聲的住院患者 240例,按糖代謝是否正常分為糖代謝正常組和糖代謝異常組,按頸動脈是否有斑塊分為有斑塊組與無斑塊組,分析頸動脈斑塊形成的影響因素尤其是糖代謝異常人群頸動脈斑塊形成的相關危險因素。結果 240例患者中有頸動脈斑塊142例(59.17%),糖代謝異常160例 (66.67%),糖尿病89例。糖代謝異常組發生頸動脈斑塊是糖代謝正常組的1.979倍 (95%CI1.069~3.663,P<0.05),糖尿病人群則高達3.103倍 (95%CI1.577~6.106,P<0.01),而糖調節受損人群OR值是1.453 (95%CI1.014~2.082,P<0.05)。年齡 (OR=1.060, 95%CI1.012~1.110,P<0.05)是糖代謝正常人群頸動脈斑塊形成的獨立危險因素,而糖代謝異常人群頸動脈斑塊形成的獨立危險因素除了年齡(OR=1.063, 95%CI1.028~1.099,P<0.01)之外,還包括HOMA-IR (OR=1.511, 95%CI1.159~1.971,P<0.01)。結論 糖代謝異常住院患者頸動脈斑塊發生率高。糖代謝異常是頸動脈斑塊形成的獨立危險因素。年齡、HOMA-IR是糖代謝異常人群頸動脈斑塊形成的危險因素。糖代謝水平的篩查可作為預防頸動脈斑塊形成的重要方法。
糖代謝異常;頸動脈斑塊;危險因素
由于生活方式的改變和人口老齡化,我國糖代謝異常和動脈粥樣硬化性心血管疾病(ASCVD)患者明顯增加[1]。糖尿病是心血管疾病主要的獨立危險因素之一,早在發展成糖尿病前ASCVD風險已增加[2]。因此,糖代謝異常是心血管疾病的危險因素[3]。由于二者處于高血糖狀態使血管組織在分子水平發生了大量轉變,通過糖基化終末產物產生增多,氧化應激增強和蛋白激酶 C 激活的相互作用,共同促進了動脈粥樣硬化的發展[4,5]。頸動脈斑塊形成則是動脈硬化的典型標志,可反映動脈粥樣硬化的程度。糖代謝異常合并頸動脈斑塊的ASCVD風險極高,因此早期發現糖代謝異常十分重要。本研究按照糖代謝水平予以分組,旨在探討糖代謝異常患者頸動脈斑塊形成的相關危險因素, 為臨床防治頸動脈斑塊、預防大血管并發癥的發生、發展提供參考意見。
1 資料與方法
1.1臨床資料選擇2014年9月~2015年7月在南京中醫藥大學附屬江蘇省中西醫結合醫院心血管內科和神經內科行動脈超聲的住院患者240例,其中男117例、女123例,年齡24~93 (61.0±12.1)歲,體質量指數(25.3±4.2)kg/m2。高血壓、冠心病、腦梗死、糖尿病、脂肪肝、吸煙、飲酒、斑塊分別為158、75、43、89、63、23、19、142例。依據1999年WHO的糖尿病診斷標準、糖代謝狀態分類標準,以口服葡萄糖耐量試驗結合病史和正在接受的治療將受檢者分為糖代謝正常組80例、糖代謝異常組160例,其中糖尿病89例;糖代謝正常組男32例、女48例,年齡(60.9±11.5)歲;糖代謝異常組男85例、女75例,年齡(61.0±12.4)歲。監測血糖3 d,以排除應激性高血糖。排除心力衰竭急性加重期急性心肌梗死、嚴重肝腎功能不全及感染性疾病、惡性腫瘤、血液病、慢性結締組織病及免疫性疾病。兩組年齡、性別有可比性。
1.2一般資料的收集及血糖、血脂的檢測測定所有患者的身高、體質量、血壓,計算體質量指數(BMI),BMI=體質量(kg)/身高2(m2)。患者空腹8~10 h,于晨起行口服糖耐量試驗。檢測前避免攝入大量高脂、高熱量食物及飲酒,于早晨抽取靜脈血測定空腹血糖(FPG)、空腹胰島素(FINS)、甘油三酯(TG)、總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)。2 h后測定餐后2 h血糖(2 h PG)。計算胰島素抵抗指數(HOMA-IR):HOMA-IR=FPG×FINS/22.5,HOMA-β=20×FINS/(FPG-3.5)。
1.3頸動脈斑塊檢查采用 PhiliPs iE-33 彩色超聲診斷儀, 探頭頻率 3~11 MHz。研究對象于上午空腹進行頸動脈超聲檢查,取仰臥位,右側自無名動脈分叉處、 左側從主動脈弓起始處開始, 連續觀察頸總動脈、頸內外動脈分叉處、頸內動脈、頸外動脈主干及分支。頸動脈內中膜厚度(IMT)定義為腔內膜交界面至外膜上層之間的距離,以后壁值為標準,取六點平均值為IMT[6]。 觀察血管走行,管壁光滑程度,測量IMT,觀察有無斑塊。動脈粥樣硬化所致血管壁結構的病理改變在二維超聲顯像下主要表現為血管壁增厚及斑塊形成。IMT≥1.2 mm且局部向腔內突出者定義為斑塊[7]。
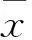
2 結果
2.1 兩組身高、體質量、BMI、血壓、血糖、血脂及HOMA-IR、HOMA-β比較糖代謝正常組高血壓、冠心病、腦梗死、糖尿病、脂肪肝、吸煙、飲酒、斑塊分別為56(70.0%)、26(32.5%)、15(18.8%)、0、17(21.3%)、4(5.2%)、1(1.3%)、37例(46.3%),糖代謝異常組分別為102(63.8%)、49(30.6%)、28(17.5%)、89(55.6%)、46(28.8%)、19(11.9%)、18(11.3%)、105例(65.6%),兩組糖尿病發生率、飲酒率、斑塊檢出率比較,P均<0.01;其他發生率比較,P均>0.05。兩組身高、體質量、BMI、收縮壓、舒張壓、FINS、TC、HDL-C、LDL-C差異均無統計學意義(P均>0.05 );糖代謝異常組的2 h PG、FPG、HOMA-IR、TG均高于糖代謝正常組(P均<0.05);糖代謝異常組的HOMA-β則低于糖代謝正常組 (P<0.05) (見表1)。
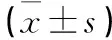
表1 兩組身高、體質量、BMI、血壓、血糖、血脂及HOMA-IR、HOMA-β比較
注:與糖代謝正常組比較,*P<0.01。
2.2各組頸動脈斑塊與危險因素的相關分析Spearman相關分析表明,在糖代謝正常組,頸動脈斑塊形成與年齡、高血壓和中風呈正相關(r分別為0.291、0.224、0.325,P<0.05或<0.01)。在糖代謝異常組,頸動脈斑塊與年齡、冠心病、中風、FINS和HOMA-IR呈正相關(r分別為0.324、0.224、0.160、0.222、0.213,P<0.05或<0.01),與HDL-C呈負相關(r=-0.163,P<0.05) 。
2.3 240例住院患者頸動脈斑塊形成與相關危險因素的關系 以有無動脈斑塊為因變量,年齡、高血壓、FPG、FINS、HOMA-IR、LDL-C以及糖代謝是否異常作為自變量進行Logistic回歸分析,結果顯示與糖代謝正常人群相比,糖代謝異常人群發生頸動脈斑塊OR值是1.979 (95%CI1.069~3.663,P<0.05) (見表2)。其中,糖尿病人群和糖調節受損(IGR)人群OR值分別是3.103 (95%CI1.577~6.106,P<0.01)和1.453 (95%CI1.014~2.082,P<0.05)。
2.4糖代謝正常與異常人群頸動脈斑塊的危險因素在糖代謝正常組(n=80),以有無頸動脈斑塊為因變量,以Spearman相關性分析有統計學意義的年齡、高血壓以及既往文獻有意義的FINS、HOMA-IR[9]等為自變量進行回歸分析,結果顯示年齡是糖代謝正常人群頸動脈斑塊形成的獨立危險因素(見表3);在糖代謝異常組(n=160),以有無頸動脈斑塊為因變量,以年齡、FINS、HOMA-IR、HDL-C以及既往文獻有意義的高血壓為自變量,結果顯示年齡和HOMA-IR是糖代謝異常人群頸動脈斑塊形成的獨立危險因素(見表4)。

表2 240例住院患者頸動脈斑塊與相關危險因素Logistic回歸分析(n=240)

表3 糖代謝正常人群頸動脈斑塊與相關危險因素Logistic回歸分析(n=80)
3 討論
2 型糖尿病已經被公認是ASVCD的危險因素。

表4 糖代謝異常人群頸動脈斑塊與相關危險因素Logistic回歸分析(n=160)
近來已有證據表明,在發展成為糖尿病之前的糖尿病前期(空腹血糖受損和糖耐量減低),已經將患者提前暴露到ASVCD發生的風險中。病理學中,動脈粥樣硬化病理變化順序是脂紋→纖維斑塊→粥樣斑塊。在這病理過程中,異常的糖代謝參與其中[8]。
本研究表明240例受檢者頸動脈斑塊檢出率為59.2%,男性61.5%、女性56.9%,與Kronborg等對1 859例男性和1 998例女性跟蹤隨訪7年后的研究結果相近(男女頸動脈斑塊檢出率分別為68.2%、56.6%);但高于廣州社區人群的斑塊檢出率51.3%,也高于臺灣糖尿病和代謝綜合征住院者的檢出率52.1%[9]。這可能與研究對象的年齡、所選人群不同有關,本研究人群選自神經內科和心內科的住院患者多合并多種心血管疾病,病情較重,頸動脈硬化程度相對較高。
進一步的Logistic回歸分析表明,與糖代謝正常人群相比,糖尿病人群發生頸動脈斑塊OR值是3.103,高于Lin等[9]住院糖尿病人群發生頸動脈斑塊OR值2.893(95%CI1.391~6.018,P<0.001)。這可能與所選人群的年齡有關,本研究患者平均年齡(61.0±12.1)歲,明顯高于Lin等研究的(53.0±9.7)歲。本研究的IGR人群發生頸動脈斑塊OR值是1.453,高于Mostaza等[10]研究結果,其發現在調整年齡、性別和心血管風險因素后,與糖代謝正常人群相比,糖尿病前期人群發生頸動脈斑塊OR值1.31 (95%CI1.01~1.69,P<0.05)。這可能與所選人群不同有關,本研究所選人群來自住院患者,其頸動脈斑塊發生率高,西班牙的這項研究所選人群是從45~74歲的城市人口中隨機抽取的。本研究在此基礎上將糖尿病和IGR兩個人群進一步合并為糖代謝異常人群,分析發現糖代謝異常人群發生頸動脈斑塊的風險是糖代謝正常人群的1.979倍,低于單獨糖尿病人群的OR值3.103,又高于IGR人群的OR值1.453。具體原因可解釋為在發展成糖尿病前的高血糖狀態已經參與氧化應激,并通過細胞內的氧自由基產生、單糖和蛋白結合物的自我氧化以及破壞天然的抗氧化屏障途徑使氧化壓力增加[11]。氧化應激是體內活性氧的產生和清除失去平衡的結果,活性氧增加引起LDL的氧化修飾,形成氧化LDL (OX-LDL),OX-LDL可被巨噬細胞吞噬形成泡沫細胞, 這是動脈粥樣斑塊形成的重要病理生理環節[12]。
本研究發現,年齡不僅是糖代謝正常人群頸動脈斑塊形成的獨立危險因素,同樣也是糖代謝異常人群的獨立危險因素,這與Xu等[13]的研究結果一致。年齡和高血壓、糖尿病、高血脂一樣是心血管疾病傳統的獨立危險因素[14]。提示不管糖代謝是否正常,體檢時均應行頸動脈超聲檢查,及早發現 IMT增厚及頸動脈斑塊,及早干預,降低ASCVD的發生風險。本研究未發現HOMA-IR是糖代謝正常人群頸動脈斑塊形成的危險因素,這與日本的一項針對正常糖代謝人群研究的結果相反,該研究發現HOMA-IR可預測健康人群的頸動脈斑塊風險,OR值是1.19 (95%CI1.00~1.41,P<0.05)[15]。出現這種結果可能與研究人群樣本量大小以及選擇的人群有關,日本研究選擇人群是糖代謝正常伴有胰島素抵抗者。除此之外,本研究還發現,HOMA-IR是糖代謝異常人群頸動脈斑塊形成的獨立危險因素。有研究表明,糖尿病前期動脈粥樣硬化的程度主要取決于胰島素抵抗水平。Xu等[13]的一項針對中國糖尿病前期人群的研究發現,糖耐量異常患者動脈硬化程度較空腹血糖調節受損患者嚴重,這可能與IGT組患者胰島素抵抗水平更高有關。以上試驗均是單獨研究糖尿病人群或糖尿病前期人群,目前國內缺乏關于異常糖代謝人群HOMA-IR與頸動脈斑塊形成的研究,而本研究的研究人群主體是糖代謝異常包括糖尿病前期和糖尿病,同時也發現HOMA-IR與年齡一樣是糖代謝異常頸動脈斑塊形成的重要獨立危險因素。提示及早改善胰島素抵抗不僅有益于糖代謝異常患者血糖控制,還有益于減少頸動脈斑塊的形成,從而減少心血管事件。
綜上,本研究表明糖代謝異常住院患者頸動脈斑塊發生率高,糖代謝異常人群頸動脈斑塊發生風險是糖代謝正常人群的1.979倍,糖尿病人群相對較高是糖代謝正常人群的3.103倍,而IGR人群相對較低是糖代謝正常人群的1.453倍。無論糖代謝是否正常,年齡是頸動脈斑塊形成的重要獨立危險因素。同時HOMA-IR參與了糖代謝異常人群頸動脈斑塊的形成。因此糖代謝可作為預防頸動脈斑塊形成的指標。本研究是一項橫斷面調查,樣本量偏少。今后仍需較大樣本量證實研究結果。但本文為深入探討糖代謝異常與頸動脈斑塊的關系提供了新的參考。
[1] 中華醫學會心血管病學分會流行病學組.糖代謝異常與動脈粥樣硬化性心血管疾病臨床診斷和治療指南 [J].中華心血管病雜志,2015,43(6):488-505.
[2] Kurihara O, Takano M, Yamamoto M, et al. Impact of prediabetic status on coronary atherosclerosis: a multivessel angioscopic study [J]. Diabetes Care, 2013,36(3):729-733.
[3] Shah AD, Vittinghoff E, Kandula NR, et al. Correlates of prediabetes and type Ⅱ diabetes in US South Asians: findings from the Mediators of Atherosclerosis in South Asians Living in America (MASALA) study[J] . Ann Epidemiol, 2015,25(2):77-83.
[4] Sonta T, Inoguchi T, Tsubouchi H, et al. Evalution of oxidative stress in diabetic animals by in vivo electron spin resonance measurement--role of protein kinase C[J] . Diab Res Clin Prac, 2004,66(11):109-113.
[5] Takenaka K, Yamagishi S, Matsui T, et al. Role of advanced glycation end products (AGE) in thrombogenic abnormalities in diabetes[J]. Curr Neurovasc Res, 2006,3(1):73-77.
[6] 呂亞亞,師維雅,左玉瓊,等.2型糖病Toll樣受體4與頸動脈內膜中層厚度的相關性研究[J].中華內分泌代謝雜志,2015,31(12):1017-1021.
[7] Mancia G, De Backer G, Dominiczak A, et al. 2007 guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the european society of hypertension (esh) and of the european society of cardiology (esc) [J]. J Hypertens, 2007,25(6):1105-1187.
[8] King RJ, Grant PJ. Diabetes and cardiovascular disease: pathophysiology of a life-threatening epidemic[J]. Herz, 2016,41(3):184-192.
[9] Lin T, Liu JC, Chang LY, et al. Association of metabolic syndrome and diabetes with subclinical coronary stenosis and plaque subtypes in middle-aged individuals[J]. Diabet Med, 2011,28(4):493-499.
[10] Mostaza JM, Lahoz C, Salinero-Fort MA, et al. Carotid atherosclerosis severity in relation to glycemic status: a cross-sectional population study[J]. Atherosclerosis, 2015,242(2):377-382.
[11] Fiorentino TV, Prioletta A, Zuo P, et al. Hyperglycemia-induced oxidative stress and its role in diabetes mellitus related cardiovascular diseases [J] . Curr Pharm Des, 2013,19(32):5695-5703.
[12] Lankin VZ, Lisina MO, Arzamastseva NE, et al. Oxidative stress in atherosclerosis and diabetes[J]. Bull Exp Biol Med, 2005,140(1):41-43.
[13] Xu L, Jiang CQ, Lam TH, et al. Impact of impaired fasting glucose and impaired glucose tolerance on arterial stiffness in an older Chinese population: the Guangzhou Biobank Cohort Study-CVD[J]. Metabolism, 2010,59(3):367-372.
[14] Negi SI, Nambi V. The role of carotid intimal thickness and plaque imaging in risk stratification for coronary heart disease[J] . Curr Atheroscler Rep, 2012,14(2):115-123.
[15] Ishizaka N, Ishizaka Y, Takahashi E, et al. Association between insulin resistance and carotid arteriosclerosis in subjects with normal fasting glucose and normal glucose tolerance[J]. Arterioscler Thromb Vasc Biol, 2003,23(2):295-301.
樓青青(E-mail:lqq188@yahoo.com)
10.3969/j.issn.1002-266X.2016.29.017
R587;R543.4
B
1002-266X(2016)29-0050-04
2016-03-02)

