溪黃草不同基原植物的抗菌和抗真菌活性研究△
莫小路,邱蔚芬,黃珊珊,曾慶錢,陳瑜珍
(廣東省中藥研究所,廣東 廣州 510520)
溪黃草不同基原植物的抗菌和抗真菌活性研究△
莫小路*,邱蔚芬,黃珊珊,曾慶錢,陳瑜珍
(廣東省中藥研究所,廣東 廣州 510520)
目的探究溪黃草不同基原植物的抗菌和抗真菌活性,為建立中藥溪黃草的質量標準提供參考。方法分別以80%的乙醇水溶液和水為溶劑對6種溪黃草基原植物進行超聲波提取,以金黃葡萄球菌、表皮葡萄球菌、枯草芽孢桿菌、大腸桿菌、變形桿菌和綠膿桿菌為供試細菌,以白色念珠菌、釀酒酵母和產黃青霉為供試真菌,采用瓊脂平板擴散法測定各溪黃草基原植物醇提物和水提物的抗菌和抗真菌活性,用液體二倍稀釋法測定其最小抑制濃度(MIC)。結果6種基原植物的醇提物對供試的革蘭陽性菌均有較強的抑菌活性,而對陰性菌抑制較弱或無抑制;其中,溪黃草和顯脈香茶菜對金黃色葡萄球菌的抑菌活性最強,MIC分別為0.063、0.125 g·mL-1。6種基原植物的醇提物中,溪黃草的抗真菌活性最強,其對白色念珠菌和釀酒酵母的MIC均為0.125 g·mL-1。6種基原植物的水提物對供試細菌和真菌幾乎沒有抑制活性。結論6種溪黃草基原植物中,溪黃草醇提物的抗菌和抗真菌活性最強。
溪黃草;抗菌活性;抗真菌活性;基原;線紋香茶菜
溪黃草為廣東及周邊地區民間習用草藥,有清熱利濕、退黃、涼血散瘀的功效,常用于治療急性黃疸型肝炎、急性膽囊炎、痢疾和腸炎等病癥[1],是“消炎利膽片”、“膽石通膠囊”等中成藥以及“溪黃草茶”等保健品的重要原料,具有廣泛的市場,但各地溪黃草藥材的植物來源各不相同,其基原植物有數種。據《中藥大辭典》和《全國中草藥匯編》等文獻記載[2-3],溪黃草基原為唇形科香茶菜屬(Rabdosia)植物線紋香茶菜Rabdosialophanthoides(Buch.-Ham.ex D.Don) Hara以及溪黃草R.serra(Maxim)Hara的全草;而《廣東省中藥材標準》[4]中,溪黃草的來源主要有4種,除了線紋香茶菜外,還有其兩個變種:纖花線紋香茶菜R.lophanthoidesvar.graciliflora(Benth.) Hara和狹基線紋香茶菜R.lophanthoidesvar.gerardiana(Benth.) Hara,以及同屬的溪黃草Rabdosiaserra(Maxim.) Hara。陳建南等[5]對廣東溪黃草資源調查的顯示:市售溪黃草商品藥材品種主要為狹基線紋香茶菜和溪黃草。近年來,溪黃草的開發應用日益廣泛,各地使用不同溪黃草基原勢必帶來溪黃草產品的質量控制問題,而目前關于溪黃草不同基原的活性成分及藥理藥效學方面的比較研究少有報道,因此,本文對香茶菜屬的幾個常用作溪黃草的藥用植物進行體外抑菌作用的研究,為溪黃草資源評價和相關產品質量控制提供實驗依據。
1 儀器與材料
1.1 植物材料
供試植物經廣東省中藥研究所蔡岳文教授鑒定,分別為唇形科香茶菜屬的溪黃草Rabdosiaserra(Maxim.) Hara、線紋香茶菜R.lophanthoides(Buch-Ham.ex.D.Don)Hara、纖花線紋香茶菜R.lophanthoidesvar.graciliflora(Benth.) Hara、狹基線紋香茶菜R.lophanthoidesvar.gerardiana(Benth.) Hara、長葉香茶菜R.stracheyi(Benth.ex Hook.f.) Hara、顯脈香茶菜R.nervosa(Hemsl.) C.Y.Wu et H.W.Li。
1.2 供試菌種
供試細菌金黃色葡萄球菌(Staphylococcusaureus)、表皮葡萄球菌(Staphylococcusepidermidi)、枯草芽孢桿菌(Bacillussubtilis)、普通變形桿菌(Proteusvulgaris)、大腸桿菌(Escherichiacoli)、綠膿桿菌(Pseudomonasaeruginosa)和真菌白色念珠菌 (Candidaalbicans)購自廣東省微生物菌種保藏中心。供試真菌釀酒酵母(Saccharomycescerevisiae)和產黃青霉(Pencicilliumchrysogenum)為本實驗室保藏菌種。各菌種以試管斜面保存于5 ℃備用。
1.3 主要儀器
KH-5200DB型臺式數控超聲波清洗儀(昆山禾創超聲儀器有限公司),超凈工作臺(美國Thermo公司)、MJP-250型霉菌培養箱(廣東環凱微生物科技有限公司)、MLS-3750型高壓滅菌器(SANYO公司)、微量移液器(Finnpipette)及XW-80A型漩渦混合器(上海琪特分析儀器公司)等。
1.4 主要試劑
甲醇、95%乙醇均為國產分析純,卡那霉素(進口試劑分裝),均購自廣州威佳生物技術有限公司;營養肉湯、營養瓊脂、沙保氏培養基(廣東環凱微生物科技有限公司)。
2 方法
2.1 抑菌活性物質的提取制備
2.1.1 乙醇提取物的制備 分別取溪黃草6種基原植物的地上部分約1 kg,剪切成1 cm長的碎片,60 ℃烘干,分別稱取烘干的藥材碎片50 g,按1∶10的比例加入80%乙醇水溶液,室溫浸泡40 min后,參照文獻方法[6],于35 ℃、頻率40 kHz超聲波提取55 min,趁熱抽濾,濾液用旋轉蒸發儀濃縮得到乙醇提取物(浸膏),用50 mL甲醇將提取物溶解后過濾,濾液中生藥的質量濃度為1 g·mL-1,作為醇提物供試藥液,即供試藥液每1 mL含生藥1 g,本文中所涉及的供試藥液濃度均按此定義。
2.1.2 水提物的制備 同2.1.1方法,取烘干藥材碎片按1∶10的比例加入蒸餾水浸泡40 min,于35 ℃、頻率40 kHz超聲波提取55 min,趁熱抽濾,濾液用旋轉蒸發儀濃縮得到水提物(浸膏),用50 mL蒸餾水將提取物溶解后過濾,濾液中生藥的質量濃度為1 g·mL-1,作為水提物供試藥液。
2.2 供試菌液的制備
供試細菌菌液:挑取在新鮮斜面培養基上培養24 h的供試菌種,接種至營養肉湯培養基中,搖勻后于37 ℃培養20~24 h,菌液濃度約為108cfu·mL-1(用平板稀釋菌落計數法測定),將此菌液用無菌0.9%氯化鈉溶液稀釋到1.5×105cfu·mL-1,備用。
供試真菌菌液:取在新鮮斜面培養基上培養5~7 d的供試菌種,加入無菌0.9%氯化鈉溶液2 mL,輕輕搖晃試管,使孢子或酵母細胞充分進入0.9%氯化鈉溶液中,將菌液倒入無菌小燒杯內,用0.9%氯化鈉溶液調整至濃度為1×106~6×106cfu·mL-1(血球計數板測定),備用。
2.3 體外抑菌活性測定
參照中國生物藥品檢驗法操作[7],采用瓊脂平板擴散法中的菌基平板打孔法進行體外抑菌活性測定。將100 μL稀釋菌液與冷卻至40 ℃的營養瓊脂培養基15 mL混合后,倒入直徑為9 cm的平皿中靜置冷凝。用無菌打孔器在瓊脂平板上均勻打上3個直徑為6 mm的孔,相鄰兩孔之間距離30 mm以上,挑出孔內瓊脂培養基,將不同濃度的供試藥液滴入孔內(每孔30 μL),醇提物的陰性對照滴加甲醇溶液,水提物的陰性對照滴加無菌水,陽性對照滴加卡那霉素0.9%氯化鈉溶液(100 mg·mL-1)。所有平板置37 ℃培養箱內培養24 h后,觀察、測定抑菌圈大小。每個處理6個重復,測定結果采用統計軟件SPSS17.0進行數據分析。
2.4 最小抑菌濃度(Minimal Inhibition Concentration,MIC)的測定
取含生藥1 g·mL-1的供試藥液,采用二倍稀釋法[7]對供試藥液進行梯度稀釋,在各稀釋管中加入100 μL濃度為104~105cfu·mL-1的菌懸液,混勻,置培養箱內37 ℃培養24 h后,每管吸取100 μL涂布于營養瓊脂培養基上,置培養箱內37 ℃培養20~24 h,以平板中無供試菌落生成的最低藥液濃度為供試藥液對該菌的最小抑菌濃度(MIC)。
2.5 體外抗真菌活性測定
采用瓊脂平板擴散法中的菌基平板濾紙片法[8]進行體外抗真菌活性測定。將滅菌后的沙保氏培養基制成平板,待充分凝固后,在培養基上滴加100 μL稀釋的供試真菌菌液并均勻涂布。滅菌濾紙片(直徑為6 mm)在供試藥液中浸泡30 min,將含有飽和供試藥液的濾紙片取出,貼在培養基表面并輕壓使其接觸良好。分別用浸漬甲醇溶液和無菌水的濾紙片作為醇提物和水提物的陰性對照,同法貼于培養基表面。將所有平板置培養箱內30 ℃培養3~5 d。觀察、測定抑菌圈大小。每個處理3個重復,測定結果采用統計軟件SPSS 17.0進行數據分析。
2.6 真菌最小抑菌濃度(MIC)的測定
采用倍比稀釋法[7],將供試藥液稀釋成相應濃度后,與沙保氏培養基以1∶1的比例混合,對照組為無菌0.9%氯化鈉溶液與沙保氏培養基以1∶1混合。待培養基冷凝后,在培養基中央滴入濃度為103~104cfu·mL-1的供試真菌菌液20 μL,置培養箱內30 ℃培養20~24 h,觀察培養基中的菌落生長情況,以培養基中無供試菌落生成的最低藥液濃度為供試藥液對該菌的最小抑菌濃度(MIC)。
3 結果
3.1 不同基原溪黃草乙醇提取物的抑菌活性
供試的6種溪黃草基原植物醇提物對金黃色葡萄球菌、表皮葡萄球菌、枯草芽孢桿菌、普通變形桿菌生長都有一定程度的抑制作用,其中,溪黃草和顯脈香茶菜的醇提物對金黃色葡萄球菌、表皮葡萄球菌和枯草芽孢桿菌的抑菌圈直徑都超過了25 mm,與陰性對照相比差異具有統計學意義(P<0.01),顯示高度的抑制活性。而對于供試的3個革蘭氏陰性菌,6種溪黃草基原植物的乙醇提取物中,僅有溪黃草、纖花線紋香茶菜和顯脈香茶菜的醇提物對普通變形桿菌有中度抑制,差異具有統計學意義(P<0.05);而大腸桿菌和綠膿桿菌對所有基原植物的醇提物均不敏感(見表1)。

表1 不同基原溪黃草乙醇提取物的抑菌活性
注:與陰性對照相比,*P<0.05,**P<0.01。
3.2 不同基原溪黃草水提取物的抑菌活性
供試的6種溪黃草基原植物的水提物的抑菌結果顯示:在生藥的質量濃度為1 g·mL-1時,僅有溪黃草、纖花線紋香茶菜和顯脈香茶菜對金黃色葡萄球菌和表皮葡萄球菌有低度抑制活性,抑菌圈直徑均低于13.0 mm,但對其他供試菌均沒有抑制作用;而線紋香茶菜、狹基線紋香茶菜和長葉香茶菜對所有供試菌均無抑制作用,抑菌圈直徑小于6 mm。即6種溪黃草基原植物的水提物均無明顯抑菌作用。
3.3 不同基原溪黃草乙醇提取物的最小抑菌濃度(MIC)及抑菌效果
根據抑菌活性試驗結果,對有抑制作用的溪黃草基原植物醇提物進行最小抑菌濃度(MIC)的測定。結果顯示,溪黃草和顯脈香茶菜的抑菌效果最好,其中溪黃草對金黃色葡萄球菌、表皮葡萄球菌和枯草芽孢桿菌的最小抑制濃度分別為0.063、0.125、0.125 g·mL-1,而長葉香茶菜的抑菌效果最差(見表2)。
由于添加醇提物之后,試管內的溶液有渾濁,不易觀察到是否有菌生長,本研究采用平板涂布培養的結果來判斷菌的生長,所測的最小抑菌濃度(MIC)也是供試藥液的最小殺菌濃度(MBC)。
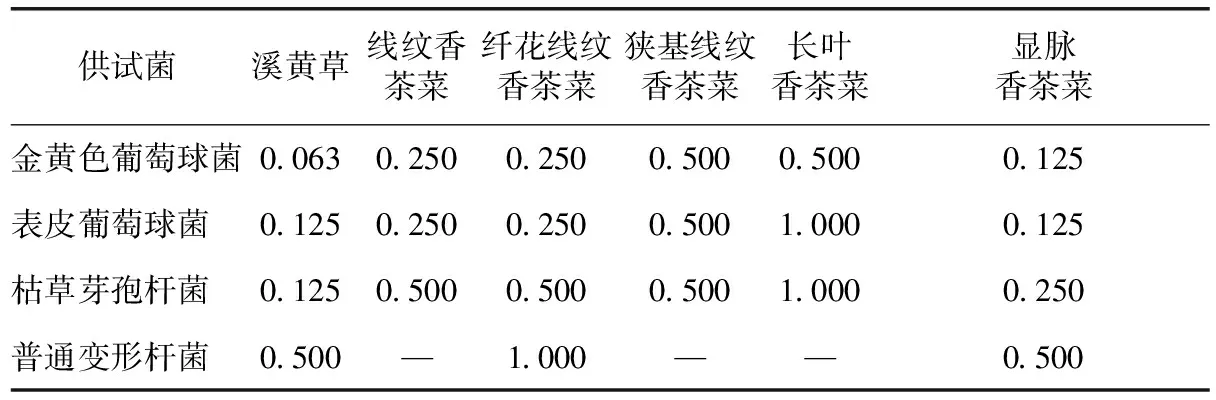
表2 溪黃草基原植物醇提物的最小抑菌濃度測定 /g·mL-1
3.4 不同基原溪黃草的抗真菌活性
采用平板菌基濾紙片法對不同基原溪黃草的醇提物和水提物進行體外抗真菌活性測定的結果顯示,不同基原的醇提物對供試真菌均有一定程度的抑制作用,其中,溪黃草、線紋香茶菜和顯脈香茶菜的抑菌效果顯著(P<0.05);而長葉香茶菜的抑菌效果最弱(見表3)。而不同基原溪黃草的水提物對供試真菌的抑菌圈直徑均小于6 mm,沒有抑菌作用。

表3 溪黃草基原植物醇提物對供試真菌的抑制作用
注:與陰性對照相比,*P<0.05;—表示無抑菌作用。
3.5 不同基原溪黃草醇提物的最小抑真菌濃度(MIC)
采用藥液倍比稀釋法對3種供試真菌的最小抑菌濃度(MIC)進行測定,結果見表4。結果顯示,不同基原溪黃草中,溪黃草的真菌抑制作用最強,其中對白色念珠菌和釀酒酵母的MIC值均為0.125 g·mL-1,線紋香茶菜和顯脈香茶菜次之,最弱為長葉香茶菜。

表4 溪黃草基原植物醇提物對供試真菌的最小抑菌濃度(MIC) /g·mL-1
4 討論
溪黃草在臨床上主要用于治療各種肝炎、膽囊炎等病,但也有研究表明溪黃草具有抑菌活性[9],而各地作為溪黃草入藥的植物有近10種,這些植物的化學成分可能各不相同,其藥理活性可能也有差異。溪黃草的幾個基原植物都是香茶菜屬植物,而孫漢董等[10-11]對香茶菜屬的研究顯示,該屬植物大多含有豐富的二萜類成分,如特征性的貝殼杉烷型二萜,具有較強的抗菌作用和細胞毒活性。從本研究進行的體外抑菌試驗看,各不同基原的溪黃草其抑菌作用有相似之處:其抑菌活性物質主要存在乙醇提取部位,水提物均未表現出抑菌作用,且醇提物對供試的革蘭陽性菌都有較強的抑制作用,而對革蘭陰性菌則沒有抑制。但各基原植物間的抑菌活性仍有差別,其中,抑菌作用最強的是溪黃草和顯脈香茶菜,長葉香茶菜最弱。6種溪黃草基原植物中,僅溪黃草乙醇提取物顯示較好的抗真菌作用,其對白色念珠菌和釀酒酵母的最低抑菌濃度(MIC)均為0.125 g·mL-1,其他基原植物醇提物的抗真菌作用都很弱,并且所有基原植物的水提物均未顯示出抗真菌作用。
顯脈香茶菜也叫藍花柴胡,其形態與溪黃草非常相似,其抑菌活性也與溪黃草相近。而在《中藥大辭典》中作為溪黃草正品的基原植物——線紋香茶菜,在本研究中顯示抑菌活性很低,原因可能與其提取物的成分有關。近年來報道的有關溪黃草化學成分分析研究的結果顯示,溪黃草的不同基原植物都有酯類、黃酮類等共有成分,但各主體成分的含量差別很大,其中,纖花線紋香茶菜和溪黃草富含酯類和羧酸類等物質,而線紋香茶菜和狹基線紋香茶菜中富含黃酮類物質[12]。此外,對不同基原溪黃草中咖啡酸與迷迭香酸的含量測定[13]及水溶性成分分析結果[14]顯示:溪黃草中這些成分的含量均低于其他基原植物,然而在本研究中,溪黃草在6種基原植物中顯示了最好的抗菌和抗真菌活性,因此,其活性成分可能不是上述幾類,具體成分還需做進一步分析研究。
溪黃草是多種中成藥和保健品的主要原料,并且是廣東民間廣泛使用的特色中藥,其市場需求量極大,但由于其基原植物多樣,沒有統一的質量控制標準,其藥材生產上存在質量不穩定、產品開發利用率較低等問題。本研究對溪黃草的不同基原植物進行體外抗菌活性的測定,對于溪黃草的藥材質量評價和質量控制均具有重要意義,但提取物的成分復雜,具體的抗菌活性成分還有待于進一步深入研究。
[1] 肖樹雄,楊啟存,呂紅.溪黃草的來源及混淆品的鑒別[J].中藥材,1993,16(9):24-26.
[2] 南京中醫藥大學.中藥大辭典:下冊[M].2版.上海:上海科學技術出版社,2006:3541-3542.
[3] 全國中草藥匯編編寫組.全國中草藥匯編:上冊[M].北京:人民衛生出版社,1978:860.
[4] 廣東省中藥材標準編委會.廣東省中藥材標準:第二冊[M].廣州:廣東科技出版社,2004:204-205.
[5] 陳建南,賴小平,劉念.廣東溪黃草藥材的原植物調查及商品鑒定[J].中藥材,1996,19 (2):73-74.
[6] 段志芳,梁盛年,譚細雪.溪黃草黃酮的超聲波法提取與活性研究[J].應用化工,2007,36(3):232-235.
[7] 馬緒榮,蘇德模.藥品微生物學檢驗手冊[M].北京:科學出版社,2001:211-216.
[8] 王潔,唐春萍,江濤,等.香鱗毛蕨有效部位對糠秕馬拉色菌的體外抗真菌作用研究[J].中成藥,2015,37(3):642-645.
[9] 梁盛年,段志芳,付莉.溪黃草乙醇提取物的體外抗菌活性測定[J].食品科技,2003,21(12):58-60.
[10] SUN H D,HUANG S X,HAN Q B.Diterpenoids from Isodon species and their biological activities[J].Natural Product reports,2006,23:673-698.
[11] LIU X,XUE Y B,DONG K,et al.Three newent-kaurane diterpenoids fromIsodonrubescensand their cytotoxicities [J].Chinese Journal of Natural Medicines,2012,10(6):464-470.
[12] 黃冬蘭,陳小康,徐永群.溪黃草四種基源植物的二維相關紅外光譜鑒別研究[J].光散射學報,2015,27(1):64-68.
[13] 朱德全,黃松,陳建南,等.不同品種、不同產地溪黃草咖啡酸與迷迭香酸的含量測定[J].中國實驗方劑學雜志,2013,19(2):114-117.
[14] 唐海明,陳建南,張揚,等.HPLC法同時測定不同來源溪黃草藥材中8 個水溶性成分的含量[J].藥物分析雜志,2015,35(2):228-234.
AntibacterialandAntifungalActivitiesofDifferentPlantResourcesofHerbaIsodonSerra
MOXiaolu*,QIUWeifen,HUANGShanshan,ZENGQingqian,CHENYuzhen
(GuangdongInstituteofTraditionalChineseMedicine,Guangzhou510520,China)
Objective:To investigate the antibacterial and antifungal activities of different plant resources of HerbaIsodonSerra,and provide research evidence for the herbs’ quality control.MethodsThe tested plants were extracted with 80% ethanol and distilled water,respectively,and under ultrasonic wave of 40 KHZ for 55 min.The ethanol and water extracts were both tested their antibacterial and antifungal activities with disk diffusion method,the tested bacteria wereStaphylococcusaureus,Staphylococcusepidermidi,Bacillussubtilis,Proteusvulgaris,Escherichiacoliandseudomonasaeruginosa,whileCandidaalbicans,SaccharomycescerevisiaeandPencicilliumchrysogenumwere the tested fungi.The Minimal Inhibition Concentration (MIC) of the extracts were tested by doubling dilution method.ResultsThe ethanol extract of 6 plants showed middle to high antibacterial activities to tested Gram-positive bacteria while little antibacterial activities to Gram-negative bacteria,and among them,the extract fromIsodonserrashowed the highest antifungal activity.All water extract from 6 plants showed scarce antibacterial nor antifungal activities to all tested microbes.ConclusionIsodonserrahas the highest antibacterial and antifungal activity among 6 tested plant resources of herbaIsodonSerra.
Isodonserra;antibacterial activities,antifungal activities;plant resources;Isodonlophanthoides
2015-10-16)
廣東省中醫藥管理局項目(20131275)
*
莫小路,教授,研究方向:藥用植物組織培養與資源開發;Tel:(020) 28854883,E-mail:moxl@gdyzy.edu.cn
10.13313/j.issn.1673-4890.2016.8.008

