結核菌和乙型肝炎病毒合并感染帶來的四個臨床矛盾
申恩瑞 張慧 馬世武
?
結核菌和乙型肝炎病毒合并感染帶來的四個臨床矛盾
申恩瑞 張慧 馬世武
2006年,我國一般人群乙型肝炎病毒(HBV)表面抗原(HBsAg)攜帶率已經從1992年的9.75%下降到7.18%,推測我國仍有9 300萬左右的慢性HBV感染者[1]。同時作為全球三大重要傳染病之一的結核菌(TB)感染,在我國也有廣泛的流行。根據WHO結核病年度報告顯示2014年全球新發結核病患者960萬例,而我國2014年新發肺結核人數達93萬[2]。雖然,目前沒有大樣本的數據統計,但仍可推測在我國應該存在相當多的患者同時發生TB和HBV合并感染(TB-HBV)。有關人類免疫缺陷病毒(HIV)-TB合并感染[3-6]和HIV -HBV合并感染[7-10]診治對策已有較多的報道,但關于TB-HBV合并感染相關的研究還較少。本文將圍繞TB-HBV合并感染給臨床帶來的矛盾問題進行闡述,其中包括倍受關注的TB-HBV合并感染時抗TB藥物誘發藥物性肝損傷(DILI)的問題,TB-HBV感染者需要使用糖皮質激素時乙型肝炎再活動(HBVr)和使用干擾素可能出現結核再活動(TBr)的問題,以及TB-HBV感染者發生變態反應時的鑒別問題。
一、TB-HBV合并感染的定義
目前,對于TB感染者合并HBV感染尚無統一的定義,國內外臨床研究通常將TB感染者檢測出HBV DNA或HBV血清標記物(主要指HBsAg或HBeAg),即提示TB-HBV合并感染[11,12]。值得注意的是TB合并隱匿性慢性HBV感染(OBI),其HBsAg陰性、HBV DNA水平低,而乙肝核心抗體(抗HBc)可呈陰性或陽性,如果這部分患者在制定抗結核治療過程中需要聯合應用糖皮質激素,特別需要考慮HBVr的問題[1],所以定義它們為TB-HBV合并感染也會有重要的臨床意義。
二、TB-HBV合并感染的流行率
不同國家TB-HBV合并感染的流行率數據有較大的差別,其中來自巴西、格魯吉亞和英國的數據顯示:肺結核患者中HBsAg流行率在2.6%~4.3%,而加上抗HBc陽性患者的比例則會達到9.0%~25.6%[13-15]。而Sirinak等[16]研究發現,泰國HIV-TB合并感染患者HBsAg陽性率為9%,明顯高于當地單純活動性肺結核中HBsAg的陽性率。來自我國不同地區肺結核感染者中的調查顯示HBsAg流行率在7.30%~13.70%之間(表1),其中也有論文展示了結核患者中其它乙肝血清標記物的陽性率[17-24],這些均提示了我國TB-HBV合并感染有很高的流行背景。
三、TB-HBV合并感染時帶來的臨床矛盾
(一)矛盾1:抗TB藥物容易誘發DILI,而TB-HBV合并感染可能增加抗TB藥誘發DILI的風險
抗TB藥物是誘發DILI的重要原因之一,特別是聯合使用多種潛在致DILI的藥物,如異煙肼、利福平、吡嗪酰胺等,發生DILI的風險會顯著增加[25,26]。標準化抗TB治療過程中,DILI的發生率為2%~8%[27]。因為多數抗TB藥物經過肝臟代謝,如果肝臟存在HBV引起的炎癥,可能增加DILI發生的風險,所以多個指南和專家建議將存在基礎肝病作為抗TB藥物誘發DILI的易感因素[25,26]。國內研究發現TB-HBV合并感染者發生DILI的風險達33%~55%[22,28]。近來,國外的一項研究顯示TB-HBV合并感染者抗結核治療過程中發生短暫肝功能損害的比例達21.7%(18/83)顯著高于對照組單純TB感染者,而發生DILI的比例是13.3%(11/83)與對照組10.0%無統計學差異;如果TB-HBV合并感染者再同時合并丙型肝炎病毒(HCV)感染,那么發生DILI的風險會顯著增加[27]。國內外TB-HBV合并感染者DILI發生率的差異可能與診斷標準差異有關,但TB-HBV合并感染者進行抗結核治療容易導致肝功能異常應該是非常明確的。值得注意的是,目前針對肝功能異常的TB感染者,尚無參考標準來說明該如何依據肝功能調整抗TB藥物劑量。所以,在TB-HBV合并感染者進行抗TB治療過程中,無論患者是活動性HBV感染,還是HBV攜帶者,都需要密切監測肝功能的變化,適時進行治療方案調整。
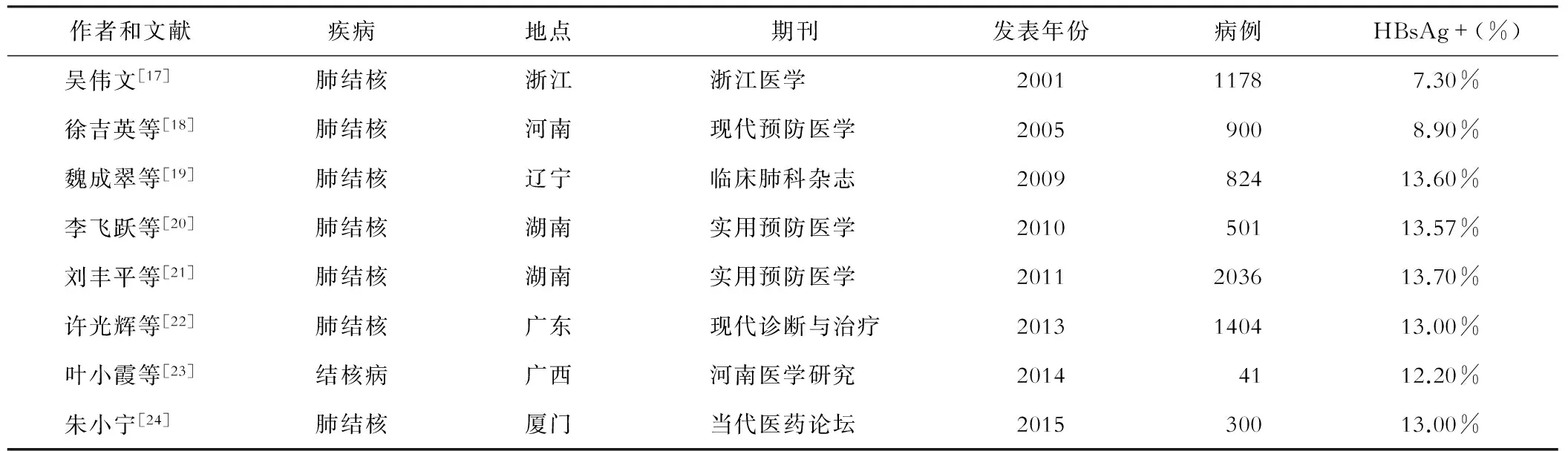
表1 我國結核病患者中HBsAg流行率情況
(二)矛盾2:TB-HBV患者結核風濕癥與HBV肝外感染的鑒別
TB感染是多器官嗜性的,可導致全身多器官感染;而一般認為HBV感染主要是肝嗜性。而隨著分子生物學的發展,在肝外器官可以檢測出HBV DNA,以及HBV病毒顆粒和HBV相關抗原,并且還逐漸證明其與肝外器官損害有相關性,如關節炎、腎炎、結節性紅斑等(表2),這就是所謂的HBV肝外感染。特別在急性HBV感染前期,血清病樣綜合征的發生率在10%~20%之間,乙肝相關性腎炎發病率在0.1%~25%之間,結節性多動脈炎的發病率在30%~70%[29]。
TB感染和HBV感染的控制都是依賴于宿主對病原微生物的免疫反應,而由病原微生物誘發的機體免疫反應常伴發一些對宿主組織或器官的免疫損害,稱之為變態反應。如TB感染者的結核風濕癥(Poncet病,Poncet’s disease)是十五種結核變態反應性疾病之一,其臨床表現類似風濕熱,可出現多發性關節痛或關節炎,以四肢大關節較常受累;也常合并皮膚損害,表現為結節性紅斑及環形紅斑,好發于四肢伸側面及踝關節附近,間歇性地出現[30],這些與HBV肝外感染存在較多的相似性。當遇到TB-HBV合并感染者時,如果出現關節炎、皮膚結節、血管炎等,既要考慮TB感染引起的原發損害,又需要考慮由TB和HBV誘發的免疫變態反應。因此,我們歸納了結核風濕癥與HBV感染的肝外表現的鑒別點[29-35](表2)。
(三)矛盾3:TB-HBV合并感染者應用糖皮質激素的矛盾
嚴重TB感染除了需要及時、標準地應用抗TB治療藥物,通常還會聯合使用糖皮質激素,以減輕炎癥滲出、粘連和中毒癥狀,其療程和劑量有時可以達到強免疫制劑的應用強度[36,37](表3)。在一些特殊情況下,結核感染者考慮使用糖皮質激素是針對應用抗TB藥物所誘發的類赫氏反應,或抗TB藥物誘發的DILI。前者是指在肺結核患者在抗TB治療4~8周時出現肺部原病灶擴展或新增病灶(以滲出性改變為主),伴胸水量多以及全身中毒癥狀重的情況,這時可以通過短期使用糖皮質激素進行治療[38,39]。對于后者抗TB藥物誘發的DILI,糖皮質激素主要用于超敏或自身免疫征象明顯而且是停用誘發肝損傷藥物之后生化指標改善不明顯或者繼續惡化的患者,在充分權衡治療收益和可能的不良反應后,可考慮使用糖皮質激素[25]。矛盾的是,當使用大劑量糖皮質激素時有時還會誘發靜止期結核出現TBr,也稱之為類固醇性結核病。因此,糖皮質激素的使用對于結核病有兩面性,可使結核病灶擴散和加重病情,而合理應用可降低結核病患者的死亡率[40]。
而當TB-HBV合并感染時,糖皮質激素還能引發HBVr,通常癥狀較TBr的表現更加劇烈。1975年,Wands等首次報道了骨髓增生和淋巴結增殖性疾病患者化療后發生HBsAg增加,并伴有轉氨酶升高,這是最早關于HBVr的報道。之后,HBVr在許多處于免疫抑制環境下被廣泛的認識,令人擔憂的是HBVr相關性重癥肝炎、肝衰竭的發生率已呈現全球性的增加[41]。2015年中國《慢性乙型肝炎防治指南》指出[1]:在HBV DNA持續穩定的患者,HBV DNA升高≥2 log10IU/mL;或基線 HBV DNA 陰性者由陰性轉為陽性,且≥100 IU/mL;及缺乏基線HBV DNA者HBV DNA≥20 000 IU/mL,都定義為HBVr;通常會導致ALT升高和肝臟炎癥壞死。特別指出HBVr常發生于非活動性HBsAg攜帶者或乙型肝炎康復者在接受免疫抑制治療或化療時。因此,TB-HBV合并感染時,使用糖皮質激素時要相當慎重,要做好治療前的評估和治療中的監測(圖1)。
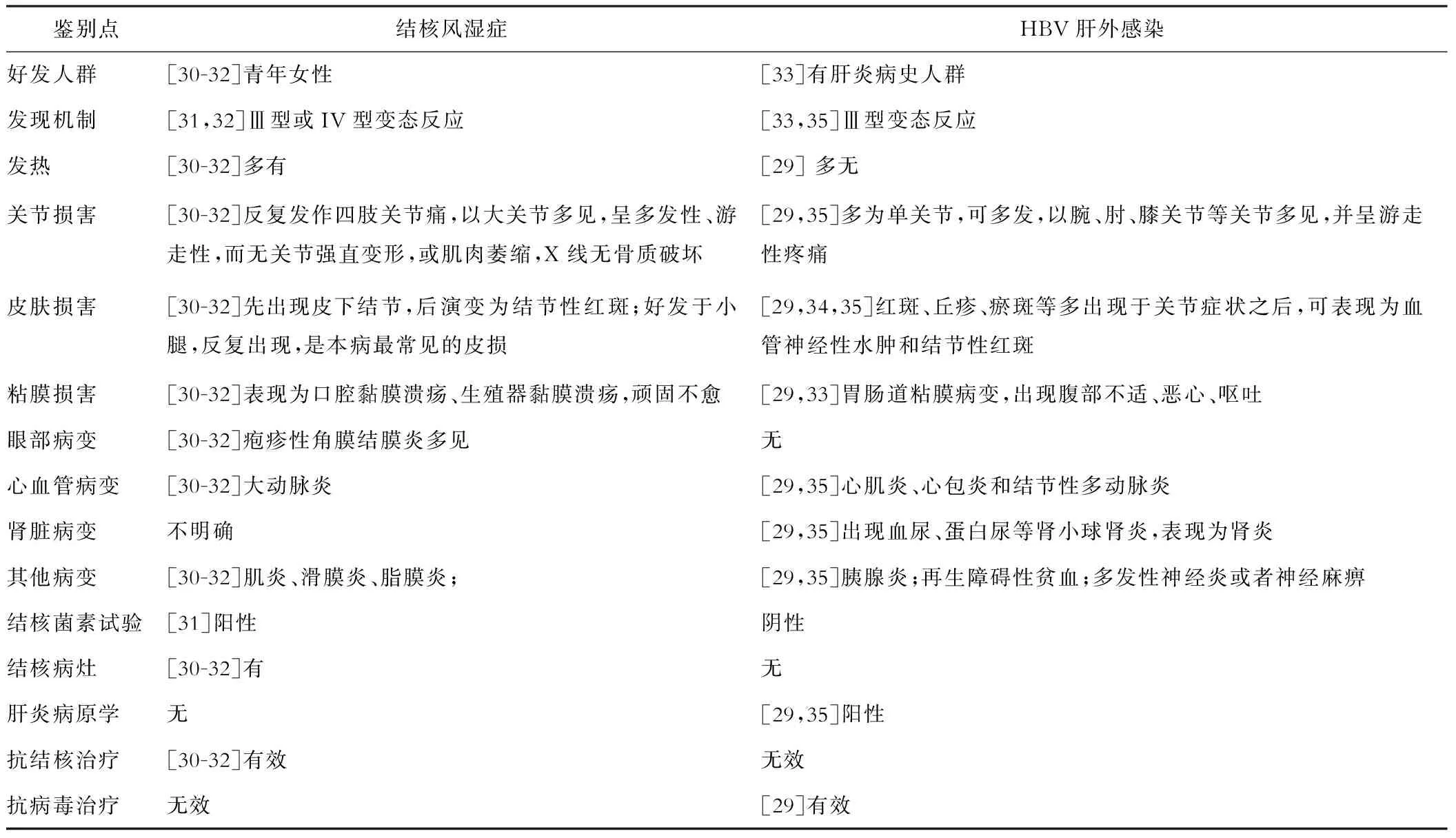
表2 結核風濕癥與HBV肝外感染的鑒別

表3 糖皮質激素在結核治療中的應用
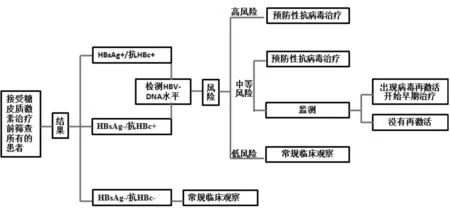
注:預防性抗病毒治療:是指抗病毒治療在免疫抑制治療之前和同時開始,和在丙氨酸谷丙轉氨酶或HBV DNA水平開始升高前;早期治療法:檢測發現血清HBV DNA和丙氨酸谷丙轉氨酶升高時開始抗病毒治療
圖1 TB-HBV合并感染者使用糖皮質激素時的評估與管理
(四) 矛盾4:TB-HBV合并感染者抗HBV時使用干擾素治療的矛盾
活動性的慢性HBV感染通常需要使用抗HBV藥物,以最大限度地長期抑制 HBV 復制,減輕肝細胞炎性壞死及肝纖維化,延緩和減少肝功能衰竭、肝硬化失代償、肝細胞癌及其他并發癥的發生,從而改善生活質量和延長生存期[1]。目前,臨床常用的抗HBV藥物主要有兩大類,即核苷(酸)類似物和干擾素。核苷(酸)類似物的副作用相對少,適用范圍較廣;而干擾素在所有應用指南中都特別指出了絕對禁忌證和相對禁忌證加以警示。
對于TB-HBV合并感染者,如果選擇核苷(酸)類似物抗病毒治療,則依據每一種藥物常見的副作用可以重點監測腎功能、血磷、肌酸肌酶等[1];而如果選擇干擾素治療,則還存在一些爭論,因為“嚴重感染”被認為是干擾素使用的忌禁證[1],而結核感染是否屬于這一情況,或者哪一種結核屬于嚴重感染,還沒有明確界定。雖然,有關TB-HBV合并感染者使用干擾素治療還缺少經驗報道,但其它一些慢性病毒性肝炎患者在使用干擾素為基礎的抗病毒治療時發生了TBr,這可能對TB-HBV合并感染者使用干擾素治療提出重要警示。如Sabbatani S[42]和Farah R[43]等分別報道使用聚乙二醇化干擾素聯合利巴韋林治療慢性丙型肝炎后出現TBr的個案;而Rodríguez-Medina B等個案報道了在肝移植術后使用聚乙二醇干擾素、利巴韋林和特拉匹韋抗HCV治療的患者,發生了播散型結核感染相關的噬血細胞綜合征[44]。Babudieri S等[45]分析在抗HCV治療過程中發生TBr的原因可能與應用聚乙二醇干擾素聯合利巴韋林時會導致血白細胞和淋巴細胞降低和細胞因子網絡的改變,從而產生了繼發細胞免疫缺陷;而Telesca C等在分析一位慢性丁型肝炎患者在接受干擾素治療過程中發生了嚴重的肺結核,認為發生TBr的原因可能與患者體重減輕和厭食癥有關[46]。然而,近來在臺灣的一項大型回顧性研究中,Lin SY等[47]也發現慢性HCV感染者在使用干擾素治療的一年內了發生TBr的風險提升,但這一趨勢無明顯統計學意義。所以,從慢性丙型和丁型肝炎患者使用干擾素治療的經驗可以看出干擾素誘發TBr的風險是存在的,這提示TB-HBV合并感染者在選擇干擾素為基礎的治療時要慎重評估和密切監測。
綜上所述,TB-HBV合并感染者是一組特殊的患者群,在臨床上有一定的流行率;TB-HBV合并感染會產生一系列臨床矛盾問題,如DILI風險、TBr風險、HBVr風險和有關免疫變態反應的鑒別診斷等,需要引起臨床醫生的特別關注。
[ 1 ] 中華醫學會肝病學分會,中華醫學會感染病學分會.慢性乙型肝炎防治指南(2015年更新版).肝臟, 2015,20: 915-932.
[ 2 ] World Health Organization. Global tuberculosis report 2015. http: //www.who.int/tb/publications/global_report/en/
[ 3 ] Wasserman S,Meintjes G.The diagnosis, management and prevention of HIV-associated tuberculosis. S Afr Med J,2014,104: 886-893.
[ 4 ] Sumantri S, Djoerban Z. Clinical Manifestations and Antiretroviral Management of HIV/AIDS Patients with Tuberculosis Co-infection in Kramat 128 Hospital. Acta Med Indones-Indones J Intern Med,2008,40: 117-123.
[ 5 ] Onyebujoh PC,Ribeiro I,Whalen CC. Treatment Options for HIV-Associated Tuberculosis. J Infect Dis, 2007, 196(Suppl 1): S35-45.
[ 6 ] Cohen K,Meintjes G. Management of individuals requiring ART and TB treatment. Curr Opin HIV AIDS, 2010,5: 61-69.
[ 7 ] See comment in PubMed Commons beloMatthews PC,Geretti AM,Goulder PJ,et al. Epidemiology and impact of HIV coinfection with hepatitis B and hepatitis C viruses in Sub-Saharan Africa. J Clin Virol, 2014, 61: 20-33.
[ 8 ] Huang SM, Cai WP, Hu FY, et al. Epidemiological and clinical characteristics of hepatitis B virus in HIV-infected patients in Guangdong, China. Int J STD AIDS, 2015,18. pii: 0956462415600570.
[ 9 ] Soriano V1, Labarga P, de Mendoza C, et al. Emerging challenges in managing hepatitis B in HIV patients. Curr HIV/AIDS Rep, 2015,12: 344-352.
[10] Xie J, Han Y, Qiu ZF,et al. Prevalence of hepatitis B and C viruses in HIV-positive patients in China: a cross-sectional study. J International AIDS Society, 2016,19: 20659.
[11] 李慕才,胡偉朋,鳥耶春平.肺結核合并乙型肝炎患者肝損害的合理治療探討.中國醫藥指南, 2012,10: 66-67.
[12] Bushnell G, Stennis NL, Drobnik AM,et al. Characteristics and TB treatment outcomes in TB patients with viral hepatitis, New York City, 2000-2010. Epidemiol Infect, 2015,143: 1972-1981.
[13] Blal CA, Passos SR, Horn C,et al. High prevalence of hepatitis B virus infection among tuberculosis patients with and without HIV in Rio de Janeiro, Brazil. Eur J Clin Microbiol Infect Dis,2005,24: 41-43.
[14] Kuniholm MH, Mark J, Aladashvili M, et al. Risk factors and algorithms to identify hepatitis C, hepatitis B, and HIV among Georgian tuberculosis patients. Int J Infect Dis, 2008,12: 51-56.
[15] Nooredinvand HA,Connell DW,Asgheddi M, et al. Viral hepatitis prevalence in patients with active and latent tuberculosis. World J Gastroenterol, 2015,21: 8920-8926.
[16] Sirinak C, Kittikraisak W, Pinjeesekikul D, et al. Viral hepatitis and HIV-associated tuberculosis: risk factors and TB treatment outcomes in Thailand. BMC Public Health, 2008,8: 245.
[17] 吳偉文.肺結核合并乙肝病毒感染的治療. 浙江醫學,2001,23: 429-430.
[18] 徐吉英, 王國斌, 王國杰,等. 涂陽肺結核病人乙型肝炎病毒感染流行病學研究. 現代預防醫學,2005,32: 918-919.
[19] 魏成翠,劉阿玲,賈琳,等.沈陽地區肺結核病患者乙肝病毒感染情況調查.臨床肺科雜志, 2009,14: 691-692.
[20] 李飛躍,申輝,楊華林,等.涂陽肺結核合并乙型肝炎流行病學分析.實用預防醫學,2010,17: 280-281.
[21] 劉豐平.結核患者乙肝病毒感染分析. 實用預防醫學, 2011, 18: 1663-1664.
[22] 許光輝, 蒙是升, 陳華,等.合并乙肝病毒感染的肺結核患者發生藥物性肝炎的臨床分析. 現代診斷與治療,2013,24: 2888-2890.
[23] 葉小霞. 82例初治與復治肺結核患者HBsAg攜帶率調查. 河南醫學研究,2014,23: 147-149.
[24] 朱小寧.淺析合并乙肝病毒感染的肺結核患者的流行病學特征. 當代醫學論叢,2015,13: 259-260.
[25] 中華醫學會肝病學分會藥物性肝病學組.藥物性肝損傷診治指南. 肝臟,2015,20: 750-762
[26] 中華醫學會結核病學分會.抗結核藥物所致藥物性肝損傷診斷與處理專家建議.中華結核與呼吸雜志,2013,36: 732-736.
[27] Kin WS, Lee SS, Lee CM,et al. Hepatitis C and not Hepatitis B virus is a risk factor for anti-tuberculosis drug induced liver injury. BMC Infect Dis, 2016,16: 50.
[28] 郭虹,李環,李淑芬,等.抗結核藥物所致肝損害的發生機制及影響因素. 北京大學學報:自然科學版,2006,7: 159-161.
[29] Kappus MR,Sterling RK. Extrahepatic manifestations of acute hepatitis B virus infection. Gastroenterol Hepatol (NY), 2013,9: 123-126.
[30] Arora S1, Prakash TV2, Carey RA2, Hansdak SG2. Poncet's disease: unusual presentation of a common disease. Lancet, 2016,387(10018): 617-618.
[31] 鄭積才. 16例結核風濕癥臨床分析. 臨床肺科雜志,2006, 12: 337.
[32] 宗成光. 結核風濕癥25例臨床分析. 中國實用醫藥,2013,8: 52-53.
[33] 于淑霞,高合斌. 慢性乙型病毒性肝炎的肝外表現.臨床消化病雜志,1998,10: 125-126.
[34] Rostey RR,Souto FJ.Observational descriptive study of cutaneous manifestations in patients from Mato Grosso with viral chronic hepatitis. An Bras Dermatol, 2015,90: 828-835.
[35] Ba kova TA, Lopatkina TN.A variety of extrahepatic manifestations of chronic viral hepatitis B and C: basic treatment principles. Ter Arkh, 2013,85: 106-110.
[36] Hwang JP,Lok AS. Management of patients with hepatitis B who require immunosuppressive therapy. Nat Rev Gastroenterol Hepatol, 2014,11: 209-19.
[37] 中華醫學會結核病學分會. 臨床診療指南:結核病學分冊. 2015修訂電子版. 北京:人民衛生出版社,2016.
[38] 胡良安, 傅玉, 羅永艾,等. 結核性胸膜炎抗結核中發生類赫氏反應的危險因素. 第三軍醫大學學報, 2013, 35: 57-60.
[39] 張琳,任俊杰,黃戈,等. 免疫抑制劑相關肺結核的臨床特點及X線表現. 臨床放射學雜志, 2007,26: 679-682.
[40] Critchley JA,young F,OrtonL,et al. Corticosteroids for prevention of mortality in people with tuberculosis :a systematic review and meta-analysis. lancet Infect Dis, 2013, 13: 223-237.
[41] Perrillo RP. Hepatitis B reactivation from immunosuppressive drug therapy: A global menace: Editor’s comment for February issue of clinical liver disease. Clinical Liver Disease,2015, 5: 39-42.
[42] Sabbatani S, Manfredi R, Marinacci G, et al. Reactivation of severe, acute pulmonary tuberculosis during treatment with pegylated interferon-alpha and ribavirin for chronic HCV hepatitis. Scand J Infect Dis,2006, 38: 205-208.
[43] Farah R, Awad J. The association of interferon with the development of pulmonary tuberculosis. Int J Clin Pharmacol Ther,2007,45: 598-600.
[44] Rodríguez-Medina B, Blanes M, Vinaixa C, et al. Haemophagocytic syndrome in a liver transplant patient during treatment with Telaprevir. Ann Hepatol,2013,12: 974-978.
[45] Babudieri S, Soddu A, Murino M,et al. Tuberculosis screening before anti-hepatitis C virus therapy in prisons. Emerg Infect Dis,2012,18: 689-691.
[46] Telesca C, Angelico M, Piccolo P, et al. Interferon-alpha treatment of hepatitis D induces tuberculosis exacerbation in an immigrant. J Infect,2007,54: 223-226.
[47] Lin SY, Chen TC, Lu PL,et al. Incidence rates of tuberculosis in chronic hepatitis C infected patients with or without interferon based therapy: a population-based cohort study in Taiwan. BMC Infectious Diseases, 2014, 14: 1-8.
(本文編輯:張苗)
國家自然科學基金資助項目(81270025);云南省應用基礎研究項目(2013FB099)
510515 廣東廣州 南方醫科大學研究生學院(申恩瑞,張慧,馬世武);昆明總醫院感染科(馬世武)
馬世武,Email:mashiwu@hotmail.com
2016-08-29)

