丹龍醒腦方對腦缺血再灌注大鼠側腦室室管膜下區神經干細胞增殖與c-myc、c-jun表達的影響
周小青,曹澤標,劉旺華,陳娉婷,李花,陳昱文
1.湖南中醫藥大學中醫診斷研究所,中醫診斷學湖南省重點實驗室,湖南 長沙 410208;2.湖南中醫藥大學數字中醫藥協同創新中心,湖南 長沙 410208;3.湖南中醫藥大學第一附屬醫院,湖南 長沙 410007
丹龍醒腦方對腦缺血再灌注大鼠側腦室室管膜下區神經干細胞增殖與c-myc、c-jun表達的影響
周小青1,2,曹澤標1,3,劉旺華1,2,陳娉婷1,3,李花1,2,陳昱文1
1.湖南中醫藥大學中醫診斷研究所,中醫診斷學湖南省重點實驗室,湖南 長沙 410208;2.湖南中醫藥大學數字中醫藥協同創新中心,湖南 長沙 410208;3.湖南中醫藥大學第一附屬醫院,湖南 長沙 410007
目的 探討丹龍醒腦方對局灶性腦缺血再灌注大鼠側腦室室管膜下區(SVZ)神經干細胞(NSCs)增殖與c-myc、c-jun表達的關系。方法 采用線栓法制備大腦中動脈栓塞局灶性腦缺血再灌注模型。150只雄性SD大鼠隨機分為假手術組、模型組和丹龍醒腦方小、中、大劑量組。于再灌注24 h后,丹龍醒腦方各劑量組予相應劑量藥液灌胃,模型組和假手術組予等體積蒸餾水灌胃。1次/d,連續7 d。再灌注1、3、7 d采用m-NSS法進行神經功能缺損評分,再灌注7 d取缺血側SVZ腦組織,采用Brdu免疫組化檢測NSCs增殖,RT-qPCR、Western blot分別檢測c-jun、c-myc mRNA和蛋白的表達。結果 與假手術組比較,其余各組神經功能缺損評分明顯升高(P<0.01);再灌注3、7 d,與模型組比較,丹龍醒腦方各劑量組神經功能缺損評分明顯降低(P<0.01)。與假手術組比較,其余各組Brdu陽性細胞率明顯升高;與模型組比較,丹龍醒腦方各劑量組Brdu陽性細胞率亦明顯升高(P<0.01)。丹龍醒腦方各劑量組較假手術組、模型組c-jun、c-myc蛋白及mRNA表達均明顯增強(P<0.05,P<0.01)。結論 丹龍醒腦方能改善腦缺血后神經功能,促進SVZ NSCs增殖,其機制可能與增強c-jun和c-myc表達及延長表達持續時間有關。
丹龍醒腦方;腦缺血再灌注;側腦室室管膜下區;神經干細胞增殖;c-jun表達;c-myc表達;大鼠
腦血管疾病發生后的主要病理變化為神經元大量丟失導致腦功能缺失。神經干細胞(NSCs)以其自我更新和多向分化潛能為腦血管病的治療開辟了新的方向。丹龍醒腦方由丹參、三七、地龍、淫羊藿、菟絲子等組成,具有活血通絡、補腎生髓之功,臨床治療缺血性腦血管病療效較好。前期研究表明,丹龍醒腦方能促進NSCs增殖[1],其機制可能與增強Wnt/β-catenin信號通路上游因子Wnt-3α、β連環蛋白(β-catenin)的表達有關[2],但對通路下游因子尚未探討。本實驗采用線栓法制備大腦中動脈栓塞局灶性腦缺血再灌注(MCAO/R)大鼠模型,觀察側腦室室管膜下區(SVZ)5-溴脫氧尿嘧啶核苷(Brdu)陽性細胞和通路下游因子c-jun、c-myc的表達,進一步探討丹龍醒腦方促進NSCs增殖的機制。
1 材料與方法
1.1 動物
SPF級健康雄性SD大鼠150只,體質量250~300 g,12周齡,湖南斯萊克景達動物實驗公司,許可證號SCXK(湘)2013-0005。飼養于湖南中醫藥大學SPF級實驗動物中心,飼養環境為多層層流架,恒溫20~26 ℃,濕度40%~70%,12 h光照/12 h黑暗,以標準飼料喂養并自由飲用三級過濾純凈水。
1.2 藥物
丹龍醒腦方由丹參15 g、三七12 g、地龍6 g、遠志15 g、石菖蒲12 g、淫羊藿10 g、菟絲子12 g等組成,飲片購自湖南中醫藥大學第一附屬醫院。飲片浸泡30 min,首煎加6倍水,水沸后文火煎60 min,第2煎加3倍水,水沸后文火煎30 min,2次藥汁混合,過濾,水浴蒸發濃縮為含原藥材1.6 g/mL,滅菌分裝,4 ℃冰箱冷藏備用。1.3 主要試劑與儀器
Brdu粉末(批號E2213), Sigma公司;Brdu抗體、c-myc兔源性多克隆抗體、c-jun兔源性多克隆抗體,abcam公司;HRP標記的山羊抗小鼠抗體、HRP標記的山羊抗兔抗體、β-actin兔源性多克隆抗體,武漢谷歌生物科技公司;RevertAid First Strand cDNA Synthesis Kit,Thermo;Trizol試劑盒,Invitrogen Life Technologies;引物,Invitrogen Biotechnology Co,LTD。熒光定量PCR儀(型號7300,ABI),光學顯微鏡及彩色圖像分析系統(Optimas,美國),AlphaEase FC專業灰度分析軟件(Alpha Innotech),馬頭牌GPS型雙極電凝器(上海醫用激光儀器廠)。
1.4 分組
實驗大鼠適應性喂養7 d后開始造模。被毛染色法編號,按隨機數字表法隨機分為假手術組18只和造模組132只,造模組于成模后根據神經功能評分等級采用分層抽樣形式分為模型組和丹龍醒腦方小、中、大劑量組(以下簡稱丹小組、丹中組、丹大組),盡量保證各組平均得分和各等級數目齊同可比。
1.5 造模
[3]制備MCAO/R大鼠模型。10%水合氯醛3.5 mL/kg腹腔注射麻醉,仰臥位固定。頸正中切口,分離暴露左側頸總動脈、頸外動脈、頸內動脈和翼顎動脈。結扎翼顎動脈,在距頸動脈叉1 cm處結扎頸外動脈,并于結扎處遠心端用電凝器灼斷,游離頸外動脈。動脈夾夾閉頸總動脈,提起頸外動脈游離端使其與頸內動脈成一直線,于頸外動脈結扎處近心端約0.5 cm處剪一切口,將線栓蘸取肝素后,由切口向頸內動脈插入至有輕微阻力感停止,固定線栓,扎緊動脈殘端,縫合皮下組織和皮膚。術中用烤燈維持肛溫36.5~37 ℃。手術完畢后將大鼠放入籠中,注意蓋上墊料、調高室溫以保溫,讓其自然清醒。造模過程中注意記錄插線時間,插線2 h后再將大鼠麻醉,用直頭鑷夾住露出皮膚的栓線尾部柔和緩慢地抽出,當栓線球前端遇到頸內動脈結扎線時會有阻力,即停止拔線,剪除栓線的殘余末端。大鼠清醒后自由進食、進水。假手術組除不插線外,全過程同造模組。待再灌注24 h大鼠完全清醒后,采用盲法對其神經功能缺損程度進行評分并記錄。參照文獻[3]5分制法進行評分,分值越高,說明動物行為障礙越嚴重,評分為1~3分者為成功模型,余剔除,剔除后致大鼠數目不能滿足實驗要求則及時補充。評分后按前述方法進行分組。
1.6 給藥及取材
均于再灌注24 h后開始給藥或蒸餾水,每日1次,連續7 d。丹龍醒腦方各劑量組每日給藥劑量根據70 kg成人每日服用82 g原藥材量進行換算,得出大鼠每日原藥材量約為7.4 g/kg,作為丹中組,則丹小組為3.7 g/ kg,丹大組為14.8 g/ kg;假手術組和模型組予等體積蒸餾水灌胃。喂養過程中出現大鼠死亡致數目不夠時,隨時補充,保證各組不少于18只。每組其中12只于第7日給藥2 h后,深度麻醉,頸動脈處死放干血液后迅速斷頭取腦,冰上快速分離缺血側SVZ腦組織,隨機選6只行RT-qPCR,另6只用于Western blot檢測。各組其余大鼠于再灌注24 h后給予腹腔注射Brdu 100 mg/kg,1次/d,連續7 d。于第7日注射2 h后,深度麻醉,常規心臟灌流至肝臟變硬后斷頭,取缺血側SVZ腦組織,放入固定液中,脫水、透明、浸蠟,制作腦部冠狀切片(厚度5 μm),隔4片取1片,用于Brdu免疫組化檢測。
1.7 指標檢測
1.7.1 神經功能缺損評分 依據改良大鼠神經功能缺損評分(m-NSS)[4],從運動、感覺、反射等方面,分別于再灌注后1、3、7 d采用盲法進行神經功能評分;從運動、感覺、平衡能力及生理反射方面對大鼠各項生理功能進行等級評分,正常計0分,異常者根據量表及嚴重程度計1~6分,總分最高18分,分值越高表示神經功能損害越嚴重。
1.7.2 免疫組化檢測側腦室室管膜下區神經干細胞增殖 大鼠SVZ腦組織切片脫蠟至水,水洗3 min× 3次,0.1%Trition/0.1%檸檬酸鈉液微波修復;蘇木素染核,預冷1 mol/L鹽酸孵育10 min,2 mol/L鹽酸37 ℃孵育30 min;3%雙氧水封閉25 min;滴加Brdu抗體(1∶100),4 ℃孵育過夜;滴加HRP標記山羊抗小鼠(1∶300),37 ℃孵育1 h,水洗;DAB顯色,脫水,透明,封片。在高倍顯微鏡下,觀察5個不同視野SVZ棕色細胞的數目并記錄,即Brdu陽性細胞,以Brdu陽性代表NSCs增殖。計算Brdu陽性細胞率(視野內陽性細胞數÷視野內所有細胞數×100%)。
1.7.3 實時定量熒光PCR檢測c-jun、c-myc mRNA表達 應用Trizol試劑盒提取總RNA,以紫外分光光度計A280、A260定量測定濃度;將總RNA經瓊脂糖凝膠電泳鑒定,可見明顯的28 s、18 s兩條區帶,證明其完整性。以組織總mRNA,反轉錄合成cDNA,60 ℃退火,應用SYBR法進行RT-qPCR。引物序列依次為R-c-myc-S:GAGTCAGGGTCATCCCCATCA,R-c-myc-A:CCAAGACGTTGTGTGTCCGC,擴增長度256 bp;R-c-jun-S:AAACGACCTTCTACGACG ATGC,R-c-jun-A:CGGTGTAGTGGTGATGTGCC,擴增長度260 bp;R-actin-S:TTCCTACCCCCAATGTA TCCG,R-actin-A:CATGAGGTCCACCACCCTGTT,擴增長度281 bp。采用2-ΔΔCt法,以2-ΔΔCt值反映目的基因表達水平,其數值越大,表達越強。
1.7.4 Western blot檢測c-jun、c-myc蛋白表達 用常規方法提取SVZ腦組織總蛋白,行SDS-PAGE電泳,轉膜2 h,用5%脫脂奶粉封閉1 h。一抗4 ℃孵育過夜,c-jun、c-myc及β-actin抗體的稀釋比例均為1∶1000;二抗HRP標記山羊抗兔(1∶3000稀釋)室溫孵育1 h,加ECL化學發光法膠片曝光后用AlphaEase FC軟件分析自身灰度值,以目的蛋白條帶灰度與管家蛋白β-actin條帶灰度比值表示蛋白表達水平,比值越大,表達越強。
1.8 統計學方法
采用SPSS19.0統計軟件進行分析。實驗數據以±s表示,多組間比較采用方差分析,方差齊時選用LSD法,方差不齊時采用Tamhane's T2檢驗法,所有統計采用雙側檢驗。檢驗水準α=0.05。
2 結果
造模過程死亡23只,成模109只;7 d飼養過程中死亡29只,中途未補充大鼠,最終納入后期檢測大鼠為98只,分別為假手術組18只、模型組20只、丹小組19只、丹中組21只、丹大組20只。
2.1 丹龍醒腦方對模型大鼠神經功能缺損評分的影響
再灌注1 d,與假手術組比較,其余各組神經功能缺損評分均明顯升高(P<0.01),但隨時間變化評分均逐漸下降;再灌注3、7 d,與模型組比較,丹龍醒腦方各劑量組評分均明顯降低(P<0.05,P<0.01)。結果見表1。
2.2 丹龍醒腦方對模型大鼠側腦室室管膜下區神經干細胞增殖的影響
與假手術組比較,其余各組Brdu陽性細胞率明顯升高(P<0.01);與模型組比較,丹龍醒腦方各劑量組陽性細胞(棕色部分)數明顯升高(P<0.05,P<0.01)。結果見表1、圖1。
表1 各組大鼠神經功能缺損評分及SVZ Brdu陽性細胞率比較(±s)
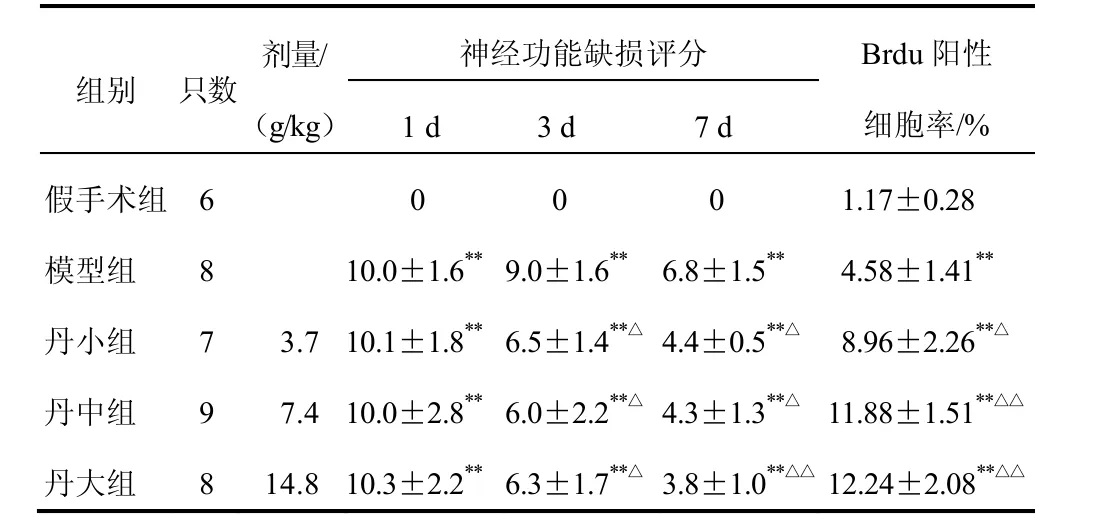
表1 各組大鼠神經功能缺損評分及SVZ Brdu陽性細胞率比較(±s)
注:與假手術組比較,**P<0.01;與模型組比較,△P<0.05,△△P<0.01(下同)
組別 只數劑量/(g/kg)1 d 3 d 7 d神經功能缺損評分 Brdu陽性細胞率/%假手術組 6 0 0 0 1.17±0.28模型組 8 10.0±1.6**9.0±1.6**6.8±1.5**4.58±1.41**丹小組 7 3.7 10.1±1.8**6.5±1.4**△4.4±0.5**△8.96±2.26**△丹中組 9 7.4 10.0±2.8**6.0±2.2**△4.3±1.3**△11.88±1.51**△△丹大組 8 14.8 10.3±2.2**6.3±1.7**△3.8±1.0**△△12.24±2.08**△△

圖1 各組大鼠SVZ NSCs增殖比較(免疫組化染色,×400)
2.3 丹龍醒腦方對模型大鼠c-myc、c-jun表達的影響
與假手術組比較,模型組c-jun、c-myc mRNA和蛋白表達差異不明顯;與假手術組、模型組比較,丹龍醒腦方各劑量組c-jun、c-myc mRNA和蛋白表達均明顯增強(P<0.01)。結果見表2、圖2。
表2 各組大鼠c-myc、c-jun表達比較(±s)

表2 各組大鼠c-myc、c-jun表達比較(±s)
組別 n 劑量/(g/kg)2-ΔΔCt值 蛋白條帶灰度值c-jun c-myc c-jun c-myc假手術組 6 0.37±0.24 0.16±0.02 0.065±0.140 0.042±0.006模型組 6 0.38±0.16 0.21±0.03 0.076±0.026 0.039±0.008丹小組 6 3.7 1.79±0.18**△△0.68±0.03**△△0.513±0.032**△△0.208±0.054**△△丹中組 6 7.4 1.84±0.20**△△0.73±0.04**△△0.492±0.045**△△0.304±0.061**△△丹大組 6 14.8 1.88±0.11**△△0.74±0.08**△△0.520±0.035**△△0.265±0.041**△△

圖2 各組大鼠SVZ c-jun、c-myc蛋白免疫印跡電泳圖
3 討論
NSCs是能主要分化為神經細胞的一種干細胞,廣泛存在于神經系統,主要集中于SVZ和海馬區。NSCs終身具有自我更新能力,在一定條件下(主要是缺血缺氧)能通過不對稱分裂增殖分化成神經元和膠質細胞,參與神經功能的修復過程,即神經再生。神經再生受多種信號通路的調控。在中樞神經系統中,Wnt/β-catenin信號通路是NSCs增殖分化的重要調控環節,其對神經再生的促進和對BMP、Notch拮抗性的“crosstalk”(對話)作用使Wnt/β-catenin在 NSCs增殖分化中處于核心地位[5]。該通路由上游的啟動因子(Wnt家族蛋白)、跨膜受體(Frizzled家族分子及LRP5/6)、胞漿調節蛋白(Dsh、APC、Gsk-3β、β-catenin)及下游核內轉錄因子T細胞因子/淋巴樣增強因子(TCF/LEF)、靶基因(c-myc、c-jun、cyclin D1、AP-1、COX-2)等組成。當Wnt信號激活、下傳,致大量β-catenin在胞漿中聚集并進入細胞核內與TCF/LEF結合形成復合體,最終激活下游靶基因c-myc、c-jun、cyclin D1等的轉錄,調節神經干細胞的增殖。c-jun、c-myc均屬即早基因(IEGs)家族,其表達產物主要為c-jun、c-myc蛋白,它們具有DNA結合活性,充當第三信使,直接或間接地激發其他一些持續存在時間較長的被稱為“晚效應基因”的表達。陳氏等[6]研究表明,通過影響一些相關的細胞因子,激活與NSCs增殖相關的信號轉導通路,可上調c-myc的表達,進而促進NSCs增殖。Nateri等[7]研究也顯示,c-jun的持續表達可使細胞增殖、分化異常,剔除c-jun基因能使小鼠腸道腫瘤變小,腫瘤細胞減少,并且延長小鼠的壽命。
本研究顯示,丹龍醒腦方能改善神經功能、促進NSCs增殖,再次驗證丹龍醒腦方不僅能多環節干預級聯反應,還能促進神經再生,進而發揮抗缺血性腦損傷作用的結論。研究部位還從以往的海馬區拓展到SVZ,這符合在內源性NSCs總體極少且分布于腦內各部的情況下,充分地利用和發掘好各部位NSCs這一未來研究的必然趨勢。同時,本研究顯示,再灌注7 d,模型組與假手術組c-jun、c-myc蛋白及mRNA表達極少,難以檢測,且組間無明顯差異。其原因可能是IEGs被第二信使介導的相關過程激活后,數分鐘內即可表達,但具有一定的時相性,維持時間不長。有研究表明,在正常神經元中c-myc表達較低或不表達,缺血再灌注損傷后陽性率明顯高于正常對照組和假手術組,再灌注6 h即開始出現,24 h達高峰,以后則呈下降趨勢[8]。另有研究以永久性大腦中動脈栓塞大鼠模型發現假手術組c-myc mRNA表達較少,大鼠缺血后6 h表達明顯上調,12 h達高峰,均高于假手術組,24 h下降且與假手術組間差異無統計學意義[9-10]。而7 d時丹龍醒腦方各劑量組c-jun、c-myc蛋白及mRNA仍有較高的表達,較之假手術組和模型組均明顯增強,表明丹龍醒腦方能促進c-jun和c-myc的表達,且可延長其表達的持續時間,其機理可能為腦缺血后Wnt/β-catenin信號通路激活。丹龍醒腦方能增強通路上游因子Wnt-3a、β-catenin的表達,進而促進和延長下游因子c-jun、c-myc的持續表達。因此,再灌注7 d,丹龍醒腦方各劑量組c-myc和c-jun處于促神經再生信號和促神經再生調節因子的持續刺激下,使其主要介導細胞增殖的基因從而誘導細胞增殖。
中醫認為,腎藏精生髓,充于腦,腦為髓海。王氏等[11]認為,個體的形成是“先天之精”的結果,肝腎精血充足能為NSCs增殖分化提供物質基礎。呂氏等[12]研究顯示,指出補腎生髓法可使腎精得補,髓海獲濟,腦神榮養,神機復靈,同時益氣活血法可使脈絡通利,以恢復腦之氣血供養,進而促進神經細胞突觸再生或抗神經細胞突觸損傷。由此可知,丹龍醒腦方可能通過其活血通絡達到改善腦內微環境和營造有利于神經再生的態勢,通過補腎生髓達到誘導相關基因的表達和促進內源性細胞因子生成,最終在神經內分泌免疫網絡綜合調控下,發揮促神經再生作用。
綜上,本研究表明丹龍醒腦方能改善MCAO/R模型大鼠神經功能,促進SVZ NSCs增殖,其機制可能與增強c-jun和c-myc表達及延長表達持續時間有關。
參考文獻:
[1] 劉旺華,雷麗萍,李花,等.丹龍醒腦方促進大鼠神經干細胞增殖及其機制的研究[J].中華老年心腦血管病雜志,2014,16(10):1090-1093.
[2] 張利美,周小青,劉旺華,等.丹龍醒腦方促進腦缺血再灌注損傷大鼠神經干細胞增殖與β-catenin、Wnt-3a表達及其機制的研究[J].湖南中醫藥大學學報,2015,35(1):7-10.
[3] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without cranietomy in rats[J]. Stroke,1989,20(1):84-91.
[4] CHEN J, SANBERG P R, LI Y, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke,2001,32(11):2682-2688.
[5] LI Y, LUO J, ZHENG G, et al. Caveolin-1 plays a crucial role in inhibiting neuronal differentiation of neural stem/progenitor cells via VEGF signaling-dependent pathway[J]. PLoS One,2011, 6(8):e22901.
[6] 陳攀,徐志偉,敖海清,等.四逆散、六味地黃丸誘導神經干細胞增殖及對c-myc mRNA,CyclinD1 mRNA表達的影響[J].中國實驗方劑學雜志, 2014,20(23):137-141.
[7] NATERI A S, PENCER-DENE B, BEHRENS A. Interaction of phosphorylated c-Jun with TCF4 regulates intestinal cancer development[J]. Nature,2005,43(7):281-285.
[8] 高亮,楊涌杰,鄭廣順.大鼠腦缺血再灌注損傷后c-myc蛋白和mRNA表達及細胞凋亡的研究[J].山西醫藥雜志,2005,34(3):191-193,265.
[9] OKUNO S, SAITO A, HAYASHI T, et al. The c-Jun N-Terminal protein kinase signaling pathway mediates Bax activation and subsequent neuronal apoptosis through interaction with Bim after transient focal cerebral ischemia[J]. J Neurosci,2004,24(36):7879-7887.
[10] 王旋,姜翠敏.大鼠缺血半暗帶區神經元凋亡與磷酸化C-Jun氨基末端激酶及原癌基因c-Myc表達的相關性[J].中國腦血管病雜志,2012, 9(3):136-141.
[11] 王立新,蔡業峰,孫景波.從中醫學角度認識腦缺血損傷后內源性神經干細胞的增殖分化[J].南京中醫藥大學學報,2008,24(4):221-223.
[12] 呂磊,胡建鵬,王鍵,等.益氣活血方與補腎生髓方對局灶性腦缺血再灌注大鼠缺血半暗帶形態學影響[J].安徽中醫學院學報,2010,29(3):39-42.
Effects of Danlong Xingnao Formula on Proliferation of Neural Stem Cells in SVZ and
Expressions of c-jun and c-myc in Cerebral Ischemia Reperfusion Rats
ZHOU Xiao-qing1,2,
CAO Ze-biao1,3, LIU Wang-hua1,2, CHEN Ping-ting1,3, LI Hua1,2, CHEN Yu-wen1(1. Institute of Diagnostics Traditional Chinese Medicine, Hunan University of Chinese Medicine, Provincial Key Laboratory of Diagnostics in Chinese Medicine, Changsha 410208, China; 2. Collaborative Center for Research and Innovation of Digital Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410208, China; 3. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha 410007, China)
Objective To study the relationship of proliferation of neural stem cells (NSCs) in SVZ and the expressions of c-jun and c-myc in rats with middle cerebral artery occlusion/reperfusion (MCAO/R) injury model administrated by Danlong Xingnao Formula. Methods The focal cerebral ischemia reperfusion injury models were prepared by longa method. Totally 150 male SD rats were randomly divided into sham-operation group, cerebral model group, Danlong Xingnao Formula low-, medium-, and high-dose groups. The treatment groups were given corresponding dose of Danlong Xingnao Formula, while the sham-operation group and model group were given the same amount of distilled water 24 h after modeling by gavage, once a day, 7 days in a row. 1 d, 3 d and 7 d after reperfusion, modified Neurological Severity Scores (m-NSS) was used to grade neurologic impairment. 7 d afterreperfusion taken to the SVZ brain tissue of ischemia side, Brdu immunohistochemical method was used to record the BrdU positive cells number. The hippocampal c-jun, c-myc mRNA and protein expressions were determined respectively by RT-qPCR method and Western blot method. Results Grades of neurologic impairment in others groups were improved obviously than sham-operation group (P<0.01); 3 d, and 7 d after reperfusion, grades of neurologic impairment in Danlong Xingnao Formula groups were obviously lower compared with model group (P<0.05, P<0.01). Brdu positive cell rates in others groups increased obviously compared with sham-operation group; Compared with model group, Brdu positive cell rates in Danlong Xingnao Formula groups increased obviously (P<0.01). The expressions of c-jun and c-myc protein and mRNA in Danlong Xingnao Formula groups improved obviously than sham-operation group and model group (P<0.01). Conclusion Danlong Xingnao Formula can improve the neural function after cerebral ischemia and stimulate the proliferation of NSCs, and the mechanism may be related to activating the expression of c-jun and c-myc and extending the duration.
Danlong Xingnao Formula; cerebral ischemia reperfusion; SVZ; proliferation of NSCs; c-jun expression; c-myc expression; rats
10.3969/j.issn.1005-5304.2016.04.013
R285.5
A
1005-5304(2016)04-0049-05
2015-07-31)
(
2015-08-23;編輯:華強)
國家自然科學基金(81373702、81473567、81202632);教育部博士點基金(20124323120003);湖南省自然科學基金(13JJ3097);湖南省教育廳科研項目(14B134、15K092)
劉旺華,E-mail:lwhww@aliyun.com

