我國(guó)藥品集中采購(gòu)制度“競(jìng)價(jià)分組”政策的評(píng)價(jià)與思考
——基于2016年各省集中采購(gòu)方案的統(tǒng)計(jì)分析
丁錦希 董 銳 李 偉 龔博君 王君焱
1.中國(guó)藥科大學(xué)國(guó)際醫(yī)藥商學(xué)院 江蘇南京 211198 2.華潤(rùn)賽科藥業(yè)有限責(zé)任公司 北京 100124
我國(guó)藥品集中采購(gòu)制度“競(jìng)價(jià)分組”政策的評(píng)價(jià)與思考
——基于2016年各省集中采購(gòu)方案的統(tǒng)計(jì)分析
丁錦希1*董 銳1李 偉1龔博君2王君焱1
1.中國(guó)藥科大學(xué)國(guó)際醫(yī)藥商學(xué)院 江蘇南京 211198 2.華潤(rùn)賽科藥業(yè)有限責(zé)任公司 北京 100124
2015年,國(guó)家相繼出臺(tái)藥品集中采購(gòu)制度改革文件,將藥品質(zhì)量作為改革的重點(diǎn)內(nèi)容。藥品集中采購(gòu)制度主要利用競(jìng)價(jià)分組區(qū)分藥品質(zhì)量層次,達(dá)到“質(zhì)量?jī)?yōu)先”的目的。但現(xiàn)階段我國(guó)競(jìng)價(jià)分組存在層級(jí)劃分不統(tǒng)一、指標(biāo)構(gòu)建不科學(xué)等問(wèn)題,弱化了集中采購(gòu)對(duì)藥品質(zhì)量的引導(dǎo)作用。本文以競(jìng)價(jià)分組作為研究對(duì)象,通過(guò)對(duì)各省(市)最新出臺(tái)的采購(gòu)文件中有關(guān)競(jìng)價(jià)分組的相關(guān)內(nèi)容進(jìn)行統(tǒng)計(jì)分析,發(fā)現(xiàn)競(jìng)價(jià)分組存在的主要問(wèn)題,在此基礎(chǔ)上探索我國(guó)競(jìng)價(jià)分組完善和優(yōu)化的策略。
藥品集中采購(gòu); 競(jìng)價(jià)分組; 政策評(píng)價(jià)
藥品質(zhì)量作為我國(guó)醫(yī)藥衛(wèi)生體制改革的重要內(nèi)容,一直以來(lái)是國(guó)家藥品監(jiān)管的重點(diǎn)。2001年,國(guó)務(wù)院印發(fā)的《醫(yī)療機(jī)構(gòu)藥品集中采購(gòu)工作規(guī)范(試行)》(以下簡(jiǎn)稱(chēng) 308號(hào)文)里首次對(duì)招標(biāo)藥品提出“質(zhì)量分層”概念,藥品采購(gòu)中的質(zhì)量層次劃分工作由此展開(kāi)。在其后的集中采購(gòu)改革文件(如《國(guó)務(wù)院辦公廳關(guān)于建立和規(guī)范政府辦基層醫(yī)療衛(wèi)生機(jī)構(gòu)基本藥物采購(gòu)機(jī)制指導(dǎo)意見(jiàn)的通知》(國(guó)辦發(fā)〔2010〕56號(hào))和《關(guān)于印發(fā)醫(yī)療機(jī)構(gòu)藥品集中采購(gòu)工作規(guī)范的通知》(衛(wèi)規(guī)財(cái)發(fā)〔2010〕64號(hào)))中均強(qiáng)調(diào)采用質(zhì)量層次劃分方法確保藥品質(zhì)量。[1]伴隨藥品集中采購(gòu)制度的不斷改革,質(zhì)量層次評(píng)審標(biāo)準(zhǔn)在實(shí)踐探索的基礎(chǔ)上不斷豐富,各省市已形成較為固定的模式。但層次劃分標(biāo)準(zhǔn)不一、“地方保護(hù)主義”摻雜、評(píng)價(jià)指標(biāo)難以真實(shí)體現(xiàn)質(zhì)量等問(wèn)題依舊突出,質(zhì)量分層并未發(fā)揮預(yù)期效果。[2]
針對(duì)上述問(wèn)題,國(guó)務(wù)院《關(guān)于完善公立醫(yī)院藥品集中采購(gòu)工作的指導(dǎo)意見(jiàn)》(國(guó)辦發(fā)〔2015〕7號(hào))(以下簡(jiǎn)稱(chēng)7號(hào)文)提出“競(jìng)價(jià)分組”概念,突出強(qiáng)調(diào)藥品質(zhì)量應(yīng)“分組”而非“分層”,表明傳統(tǒng)意義上的“質(zhì)量層次劃分”已逐步演變?yōu)椤案?jìng)價(jià)分組”。[3]隨后,國(guó)家衛(wèi)生計(jì)生委《關(guān)于落實(shí)完善公立醫(yī)院藥品集中采購(gòu)工作指導(dǎo)意見(jiàn)的通知》(衛(wèi)藥政發(fā)〔2015〕70號(hào))(以下簡(jiǎn)稱(chēng)70號(hào)文)明確指出,“集中采購(gòu)要根據(jù)仿制藥質(zhì)量一致性評(píng)價(jià)技術(shù)要求,科學(xué)設(shè)定競(jìng)價(jià)分組”,對(duì)其具體操作提出要求。各省市以7號(hào)文和70號(hào)文為基礎(chǔ),陸續(xù)出臺(tái)藥品集中采購(gòu)改革文件,其中大部分對(duì)競(jìng)價(jià)分組的設(shè)計(jì)方案做出明確規(guī)定;同時(shí),部分省市已經(jīng)開(kāi)始進(jìn)入競(jìng)價(jià)分組實(shí)踐運(yùn)作層面。
本文通過(guò)統(tǒng)計(jì)各省市最新出臺(tái)的集中采購(gòu)改革文件及競(jìng)價(jià)分組評(píng)價(jià)指標(biāo),從能夠直接反應(yīng)競(jìng)價(jià)分組制度建立與落實(shí)情況的層級(jí)設(shè)計(jì)(反映競(jìng)價(jià)分組競(jìng)爭(zhēng)程度)、指標(biāo)構(gòu)建(反映藥品質(zhì)量凸顯情況)、評(píng)審內(nèi)容(反映層級(jí)與指標(biāo)設(shè)計(jì)是否合理、科學(xué))等方面分析2015年5月—2016年5月內(nèi)各省市具體實(shí)踐情況,發(fā)現(xiàn)現(xiàn)階段我國(guó)競(jìng)價(jià)分組方案仍需改進(jìn)的問(wèn)題,探索我國(guó)“競(jìng)價(jià)分組”完善和優(yōu)化的策略。
1 實(shí)施競(jìng)價(jià)分組的原因
1.1 我國(guó)藥品質(zhì)量評(píng)價(jià)體系現(xiàn)狀
我國(guó)的藥品(尤其是仿制藥)注冊(cè)審評(píng)以《中華人民共和國(guó)藥典》、部頒標(biāo)準(zhǔn)等作為標(biāo)準(zhǔn),主要考察生產(chǎn)企業(yè)上報(bào)的綜述資料、藥學(xué)研究資料、藥理毒理研究資料、臨床試驗(yàn)資料等是否符合相關(guān)規(guī)定,對(duì)于真正涉及藥品質(zhì)量的核心要素(主要指生物等效性、體外溶出度、藥品雜質(zhì)檢驗(yàn)等)缺乏實(shí)踐層面的有效監(jiān)管,上述因素疊加在一起造成了醫(yī)藥行業(yè)普遍存在的“仿標(biāo)準(zhǔn)、不仿產(chǎn)品”的堪憂(yōu)現(xiàn)實(shí)。同時(shí),同通用名藥品多家企業(yè)生產(chǎn)的情況在我國(guó)較為普遍。截至2014年,國(guó)家食品藥品監(jiān)督管理總局(CFDA)共頒發(fā)約17.2萬(wàn)個(gè)藥品批準(zhǔn)文號(hào),市場(chǎng)流通藥品品種僅1.5萬(wàn)種[4],這種情況往往很難保證藥品質(zhì)量。如果不區(qū)分仿制藥間質(zhì)量差異,質(zhì)量高的藥品無(wú)價(jià)格優(yōu)勢(shì),必然會(huì)降低企業(yè)質(zhì)量提升動(dòng)力,導(dǎo)致企業(yè)傾向生產(chǎn)低質(zhì)量藥品,即所謂的“劣幣驅(qū)逐良幣”,從而產(chǎn)生“檸檬市場(chǎng)”(The Market of Lemons)效應(yīng),不利于我國(guó)藥品市場(chǎng)的良性發(fā)展。
因此,參考域外國(guó)家與地區(qū)(如英國(guó)、德國(guó)等)藥品質(zhì)量監(jiān)控的政策實(shí)踐,有關(guān)部門(mén)已嘗試建立符合我國(guó)實(shí)際的藥品質(zhì)量監(jiān)測(cè)體系(如“仿制藥一致性評(píng)價(jià)”政策)。目前,各項(xiàng)政策措施正處于探索階段,并不能發(fā)揮應(yīng)有的政策效果。因此,我國(guó)提出“競(jìng)價(jià)分組”作為上述問(wèn)題在此過(guò)渡時(shí)期的解決方法。
1.2 競(jìng)價(jià)分組的提出
本文將競(jìng)價(jià)分組定義為根據(jù)質(zhì)量屬性、注冊(cè)狀態(tài)、生產(chǎn)企業(yè)資質(zhì)等相關(guān)指標(biāo)將藥品劃分為不同競(jìng)價(jià)組,同組藥品展開(kāi)價(jià)格競(jìng)爭(zhēng),實(shí)現(xiàn)“優(yōu)質(zhì)優(yōu)價(jià)”目標(biāo)的一種藥品質(zhì)量評(píng)價(jià)方法。競(jìng)價(jià)分組作為新雙信封制下最主要的質(zhì)量評(píng)價(jià)方法,通過(guò)區(qū)分藥品質(zhì)量層次,確保有力競(jìng)爭(zhēng),旨在解決我國(guó)一致性評(píng)價(jià)系統(tǒng)缺失、藥品質(zhì)量層次不齊等問(wèn)題。
1.3 競(jìng)價(jià)分組的具體作用
設(shè)立“競(jìng)價(jià)分組”的初衷就是區(qū)分質(zhì)量層次,確保醫(yī)療機(jī)構(gòu)使用藥品的“優(yōu)質(zhì)優(yōu)價(jià)”,這也是藥品集中采購(gòu)制度改革中需要重點(diǎn)突破的問(wèn)題。其主要作用可歸納為三點(diǎn):
(1)區(qū)分質(zhì)量層級(jí)。從各省(市)或地區(qū)的競(jìng)價(jià)分組層級(jí)設(shè)置來(lái)看,主要將專(zhuān)利藥品、原研藥品、獲獎(jiǎng)藥品等置于較高組別,而將其他藥品按照GMP、企業(yè)資質(zhì)等指標(biāo)置于較低組別。這樣的做法,可以在一定程度上將質(zhì)量層次區(qū)分開(kāi)來(lái),有利于體現(xiàn)集中采購(gòu)“質(zhì)量?jī)?yōu)先”的原則。
(2)經(jīng)濟(jì)技術(shù)標(biāo)評(píng)審的主要依據(jù)。以浙江省采購(gòu)方案為例,浙江省經(jīng)濟(jì)技術(shù)標(biāo)評(píng)審項(xiàng)目中,與產(chǎn)品質(zhì)量相關(guān)的兩項(xiàng)主要指標(biāo)(產(chǎn)品質(zhì)量評(píng)價(jià)和臨床療效評(píng)價(jià))分值為59分,占評(píng)價(jià)體系的59%;而江蘇省相關(guān)指標(biāo)占比為40%,雖略低于浙江省,但對(duì)經(jīng)濟(jì)技術(shù)標(biāo)評(píng)審的影響依舊很大。
(3)鼓勵(lì)藥品生產(chǎn)研發(fā)創(chuàng)新。各省市競(jìng)價(jià)分組評(píng)價(jià)體系中,專(zhuān)利藥品、原研藥品、實(shí)力或資質(zhì)較強(qiáng)企業(yè)的藥品等均能處于較高的組別,對(duì)于企業(yè)進(jìn)入商務(wù)標(biāo)議價(jià),并最終中標(biāo)都有較大幫助。
1.4 我國(guó)實(shí)施競(jìng)價(jià)分組的必然性
目前,我國(guó)仿制藥一致性評(píng)價(jià)工作方案雖已確定,但參比制劑選擇,實(shí)驗(yàn)方案設(shè)計(jì)等方面仍需進(jìn)一步完善,“仿標(biāo)準(zhǔn)、不仿質(zhì)量”的現(xiàn)象依舊存在[5],故原研藥與仿制藥之間、仿制藥與仿制藥之間,在藥品質(zhì)量、尤其是臨床療效方面存在較大差異,導(dǎo)致現(xiàn)階段我國(guó)藥品質(zhì)量參差不齊,故在藥品采購(gòu)制度設(shè)計(jì)中區(qū)別質(zhì)量層次就顯得十分必要。競(jìng)價(jià)分組可以很好的區(qū)分質(zhì)量層次,且有利于雙信封制度更好的發(fā)揮藥品篩選和價(jià)格控制作用。結(jié)合我國(guó)藥品集中采購(gòu)現(xiàn)狀,現(xiàn)階段應(yīng)當(dāng)仍以競(jìng)價(jià)分組作為劃分質(zhì)量層次的主要方法。
2 我國(guó)現(xiàn)階段競(jìng)價(jià)分組的實(shí)施情況
2.1 數(shù)據(jù)來(lái)源及研究方法
本文參考2015年5月—2016年5月全國(guó)各省(市)最新出臺(tái)的藥品集中采購(gòu)文件,對(duì)各省(市)競(jìng)價(jià)分組的情況進(jìn)行統(tǒng)計(jì)。以此為據(jù),選擇醫(yī)療衛(wèi)生體制改革成效較為顯著的江蘇、廣州、北京、浙江4個(gè)重要試點(diǎn)省(市)作為重點(diǎn)調(diào)研對(duì)象,同時(shí)組織參與一系列集中采購(gòu)政策相關(guān)會(huì)議,通過(guò)專(zhuān)家訪(fǎng)談、研討會(huì)、座談會(huì)等形式完善全國(guó)競(jìng)價(jià)分組情況(如層級(jí)設(shè)置、指標(biāo)體系構(gòu)建等)的統(tǒng)計(jì)和研究(表1)。

表1 數(shù)據(jù)資料調(diào)研采集信息情況

表2 27省招標(biāo)采購(gòu)藥品競(jìng)價(jià)組劃分情況(截至2016年5月)
注:*甘肅省目前化藥方案仍為2015年11月9日出臺(tái)的實(shí)施方案,并未出臺(tái)具體的完善方案,故此處應(yīng)用中成藥采購(gòu)方案**均為試行方案
2.2 競(jìng)價(jià)分組層級(jí)設(shè)置情況
競(jìng)價(jià)分組層級(jí)就是根據(jù)藥品質(zhì)量情況所歸納的類(lèi)別,是競(jìng)價(jià)分組的主體框架。在具體層級(jí)設(shè)置完成后,將相應(yīng)的指標(biāo)納入相應(yīng)層次,才能發(fā)揮競(jìng)價(jià)分組區(qū)分質(zhì)量層次的作用。因此,層級(jí)設(shè)置就顯得格外重要。各省市參照國(guó)家要求,均出臺(tái)相應(yīng)的文件設(shè)置層級(jí),本文統(tǒng)計(jì)了目前各省市采購(gòu)文件中對(duì)競(jìng)價(jià)分組層級(jí)設(shè)置的相關(guān)規(guī)定(表2)。
根據(jù)統(tǒng)計(jì)結(jié)果,可以看出:(1)我國(guó)現(xiàn)階段質(zhì)量層次劃分多為2、3、4層,表明在[2,4]這個(gè)區(qū)間內(nèi),層級(jí)劃分的可操作性較強(qiáng);(2)劃分三個(gè)層次的省份最多,占全國(guó)近2/3,這說(shuō)明較其他兩種類(lèi)型,劃分三個(gè)層次優(yōu)勢(shì)更加明顯。
需要特別說(shuō)明的是:(1)江西和河南雖在文件中提及劃分的質(zhì)量層次數(shù),但并沒(méi)有對(duì)各層內(nèi)容或具體內(nèi)容進(jìn)行描述;(2)對(duì)質(zhì)量層次劃分做出具體規(guī)定的24個(gè)省市中,17個(gè)省市是在經(jīng)濟(jì)技術(shù)標(biāo)評(píng)審前劃分質(zhì)量層次的,7省(四川、青海、湖北、內(nèi)蒙古、天津、福建、陜西)是在經(jīng)濟(jì)技術(shù)標(biāo)評(píng)審后進(jìn)入商務(wù)標(biāo)評(píng)審時(shí)劃分質(zhì)量層次的;(3)福建和陜西劃分質(zhì)量層次以具體藥品經(jīng)濟(jì)技術(shù)標(biāo)得分為依據(jù),與其他省份不同,其他22省主要依據(jù)藥品專(zhuān)利情況、藥品注冊(cè)分類(lèi)情況、企業(yè)資質(zhì)、獲獎(jiǎng)情況等進(jìn)行質(zhì)量層次劃分。
2.3 競(jìng)價(jià)分組指標(biāo)構(gòu)建情況
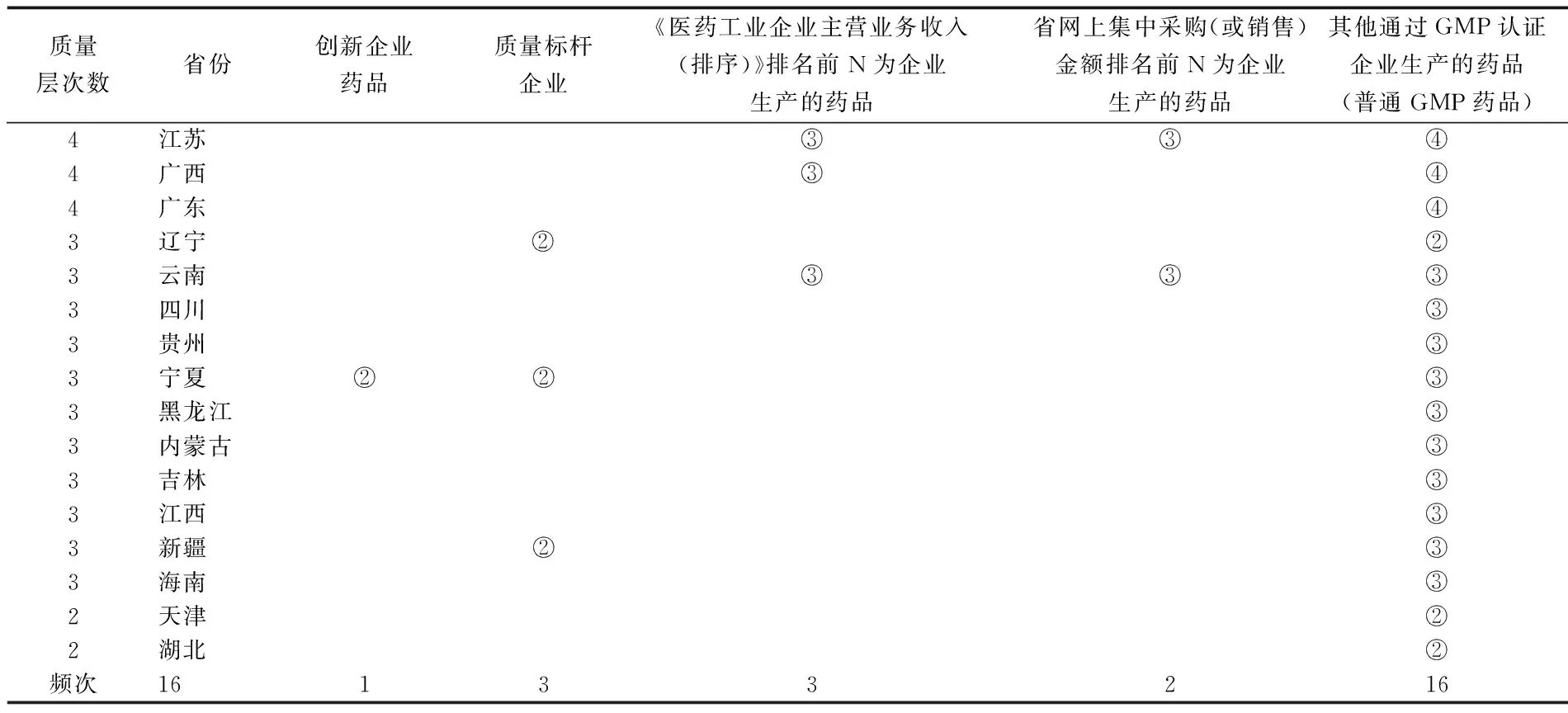
指標(biāo)體系是競(jìng)價(jià)分組發(fā)揮區(qū)分質(zhì)量層次作用最重要的依據(jù),也是經(jīng)濟(jì)技術(shù)標(biāo)分值設(shè)定的基礎(chǔ)。因此,本文根據(jù)各省市最新的藥品采購(gòu)文件,將明確規(guī)定競(jìng)價(jià)分組項(xiàng)目的16個(gè)省市的質(zhì)量層次劃分指標(biāo)進(jìn)行統(tǒng)計(jì),通過(guò)統(tǒng)計(jì)各項(xiàng)指標(biāo)在各省市競(jìng)價(jià)分組出現(xiàn)頻次、所處組別等(如①表示處于第一質(zhì)量層次),反映現(xiàn)階段我國(guó)藥品競(jìng)價(jià)分組指標(biāo)構(gòu)建情況。具體如表3—表5。

表3 省競(jìng)價(jià)分組指標(biāo)層次劃分統(tǒng)計(jì)表(1)

表4 省競(jìng)價(jià)分組指標(biāo)層次劃分統(tǒng)計(jì)表(2)
表5 省競(jìng)價(jià)分組指標(biāo)層次劃分統(tǒng)計(jì)表(3)
質(zhì)量層次數(shù)省份創(chuàng)新企業(yè)藥品質(zhì)量標(biāo)桿企業(yè)《醫(yī)藥工業(yè)企業(yè)主營(yíng)業(yè)務(wù)收入(排序)》排名前N為企業(yè)生產(chǎn)的藥品省網(wǎng)上集中采購(gòu)(或銷(xiāo)售)金額排名前N為企業(yè)生產(chǎn)的藥品其他通過(guò)GMP認(rèn)證企業(yè)生產(chǎn)的藥品(普通GMP藥品)4江蘇③③④4廣西③④4廣東④3遼寧②②3云南③③③3四川③3貴州③3寧夏②②③3黑龍江③3內(nèi)蒙古③3吉林③3江西③3新疆②③3海南③2天津②2湖北②頻次16133216
根據(jù)表3、表4及表5的統(tǒng)計(jì)情況,現(xiàn)階段我國(guó)競(jìng)價(jià)分組指標(biāo)體系構(gòu)建主要有三個(gè)特點(diǎn):(1)在18個(gè)納入統(tǒng)計(jì)的評(píng)價(jià)指標(biāo)中,指標(biāo)性質(zhì)主要可概括為藥品注冊(cè)審評(píng)情況(該類(lèi)指標(biāo)占比66.67%)*藥品注冊(cè)審評(píng)情況指標(biāo)主要包括:保護(hù)期內(nèi)的專(zhuān)利藥品、不在保護(hù)期內(nèi)的專(zhuān)利藥品、國(guó)家中藥保密處方、藥品注冊(cè)分類(lèi)第一類(lèi)新藥、中藥保護(hù)品種、進(jìn)口藥品非專(zhuān)利藥、藥品注冊(cè)分類(lèi)第二類(lèi)新藥、通過(guò)質(zhì)量一致性評(píng)價(jià)的仿制藥品、首次仿制藥品、達(dá)到國(guó)際水平的仿制藥、藥品認(rèn)證情況(該類(lèi)指標(biāo)占比11.11%)*藥品獲獎(jiǎng)情況指標(biāo)主要包括:中成藥所用中藥材通過(guò)GAP認(rèn)證的藥品、普通GMP藥品、企業(yè)情況(該類(lèi)指標(biāo)占比22.22%)*企業(yè)情況指標(biāo)主要包括:創(chuàng)新企業(yè)藥品、質(zhì)量標(biāo)桿企業(yè)、《醫(yī)藥工業(yè)企業(yè)主營(yíng)業(yè)務(wù)收入(排序)》排名前N為企業(yè)生產(chǎn)的藥品、省網(wǎng)上集中采購(gòu)(或銷(xiāo)售)金額排名前N為企業(yè)生產(chǎn)的藥品三個(gè)方面;(2)現(xiàn)階段,藥品注冊(cè)審評(píng)情況被認(rèn)為與藥品質(zhì)量關(guān)系最密切,故各省市將與其相關(guān)的指標(biāo)置于較高組別,如“不在保護(hù)期內(nèi)的專(zhuān)利藥品”、“藥品注冊(cè)分類(lèi)第一類(lèi)新藥”等指標(biāo),85%以上的省份均將其置于第一競(jìng)價(jià)組,體現(xiàn)出該類(lèi)指標(biāo)在競(jìng)價(jià)分組中的重要性;(3)企業(yè)情況指標(biāo)統(tǒng)計(jì)的結(jié)果顯示,該類(lèi)指標(biāo)在各省市競(jìng)價(jià)分組體系中占比不高,相反,與藥品直接相關(guān)的指標(biāo)被普遍應(yīng)用于評(píng)價(jià)體系中;(4)近期關(guān)注度較高的藥品質(zhì)量政策在各省市競(jìng)價(jià)分組中占比變化較大,其中,已有13個(gè)省份將仿制藥一致性評(píng)價(jià)指標(biāo)納入競(jìng)價(jià)分組,而納入首仿藥的省份也從最初的4個(gè)增長(zhǎng)至10個(gè)。
3 競(jìng)價(jià)分組存在的問(wèn)題
3.1 競(jìng)價(jià)分組層次劃分不統(tǒng)一
層級(jí)設(shè)置不統(tǒng)一系我國(guó)競(jìng)價(jià)分組現(xiàn)存最主要的問(wèn)題[7]。在70號(hào)文發(fā)布之前,我國(guó)藥品競(jìng)價(jià)分組情況非常復(fù)雜,大多數(shù)省份對(duì)采購(gòu)藥品直接進(jìn)行競(jìng)價(jià)組劃分,競(jìng)價(jià)組數(shù)量2組至8組不等[8],比較特殊的,則不對(duì)其進(jìn)行直接劃分,轉(zhuǎn)而將藥品劃分為不同評(píng)審組進(jìn)行審評(píng);70號(hào)文發(fā)布后,各省市重新制定競(jìng)價(jià)分組方案,現(xiàn)已形成以2~4組為主的競(jìng)價(jià)組劃分模式(見(jiàn)表2),情況雖有所好轉(zhuǎn),但競(jìng)價(jià)分組層次劃分仍不統(tǒng)一。不同的層級(jí)設(shè)置將引起一系列問(wèn)題:一方面會(huì)導(dǎo)致藥品質(zhì)量評(píng)價(jià)結(jié)果差異較大,難以同時(shí)發(fā)揮“增強(qiáng)競(jìng)爭(zhēng)、區(qū)分質(zhì)量”的作用,如較少競(jìng)價(jià)組的情況可加強(qiáng)標(biāo)后市場(chǎng)環(huán)節(jié)的競(jìng)爭(zhēng)力度,但質(zhì)量區(qū)分作用有限,而較設(shè)置多層次恰恰相反;另一方面,各省市劃分情況不一,加大了集中采購(gòu)的工作量和操作難度,以“新藥注冊(cè)分類(lèi)第一類(lèi)”指標(biāo)為例,大部分省市將其設(shè)置為第一競(jìng)價(jià)組,而海南和江西卻設(shè)置為第二競(jìng)價(jià)組,不同的競(jìng)價(jià)分組情況必然對(duì)企業(yè)的評(píng)標(biāo)、競(jìng)標(biāo)以及采購(gòu)部門(mén)監(jiān)管產(chǎn)生較大影響。
3.2 涵蓋類(lèi)別不全面
現(xiàn)階段競(jìng)價(jià)分組主要包含專(zhuān)利藥、原研藥、中成藥、仿制藥四大類(lèi),但大多數(shù)省份忽略了近年來(lái)廣受?chē)?guó)內(nèi)外熱捧的首仿藥品。我國(guó)競(jìng)價(jià)分組中首仿藥品受關(guān)注度不高,嚴(yán)重挫傷了我國(guó)藥品生產(chǎn)企業(yè)的研發(fā),也不利于競(jìng)價(jià)分組激勵(lì)創(chuàng)新的作用。
在我國(guó),三類(lèi)仿制藥*根據(jù)國(guó)家新的化學(xué)藥品注冊(cè)分類(lèi),原注冊(cè)分類(lèi)中的3.1類(lèi)新藥現(xiàn)統(tǒng)稱(chēng)為三類(lèi)仿制藥在業(yè)內(nèi)一般被稱(chēng)之為“首仿藥”*目前我國(guó)尚無(wú)官方文件對(duì)首仿藥進(jìn)行界定,各省市對(duì)于首仿藥的認(rèn)定也存在差異,導(dǎo)致首仿藥并未納入所有省市競(jìng)價(jià)分組體系當(dāng)中,由于其在中國(guó)市場(chǎng)處于空白,能夠優(yōu)先搶占市場(chǎng)份額*2016年7月21日國(guó)家藥品審評(píng)中心出臺(tái)《“首仿”品種實(shí)行優(yōu)先審評(píng)評(píng)定的基本原則》,對(duì)22個(gè)“首仿”品種提供優(yōu)先審評(píng)審批的政策優(yōu)惠,因此廣受中國(guó)企業(yè)的追捧,其申請(qǐng)數(shù)量也在逐年大幅度增長(zhǎng),從2008年的168增長(zhǎng)到2015年的765(圖1)。
從2009年開(kāi)始,部分省市藥品招標(biāo)采購(gòu)方案中首仿藥的定義和質(zhì)量層次劃分的依據(jù)被明確寫(xiě)入標(biāo)書(shū),表明各省市已經(jīng)開(kāi)始接納并逐步將首仿藥納入集中招標(biāo)采購(gòu)體系。根據(jù)各省市最新的藥品招標(biāo)采購(gòu)方案,目前已有12個(gè)省市將首仿藥品明確納入競(jìng)價(jià)分組體系,較2015年情況大為好轉(zhuǎn)(僅有江蘇、內(nèi)蒙古、遼寧三個(gè)省市),充分說(shuō)明首仿藥品在競(jìng)價(jià)分組設(shè)置中的重要性。但同時(shí)仍有超過(guò)50%的省市沒(méi)有將首仿藥納入競(jìng)價(jià)分組方案中,說(shuō)明其在我國(guó)受重視程度不高,證明現(xiàn)階段競(jìng)價(jià)分組涵蓋范圍并不全面(表6)。
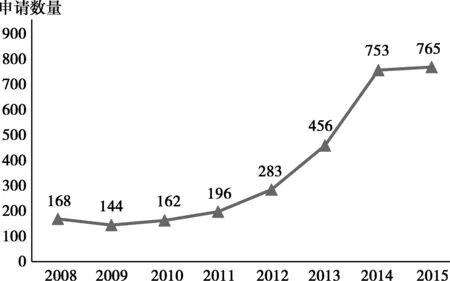
圖1 2008—2015年第三類(lèi)仿制藥臨床申請(qǐng)品種數(shù)量趨勢(shì)數(shù)據(jù)來(lái)源:insight數(shù)據(jù)庫(kù)
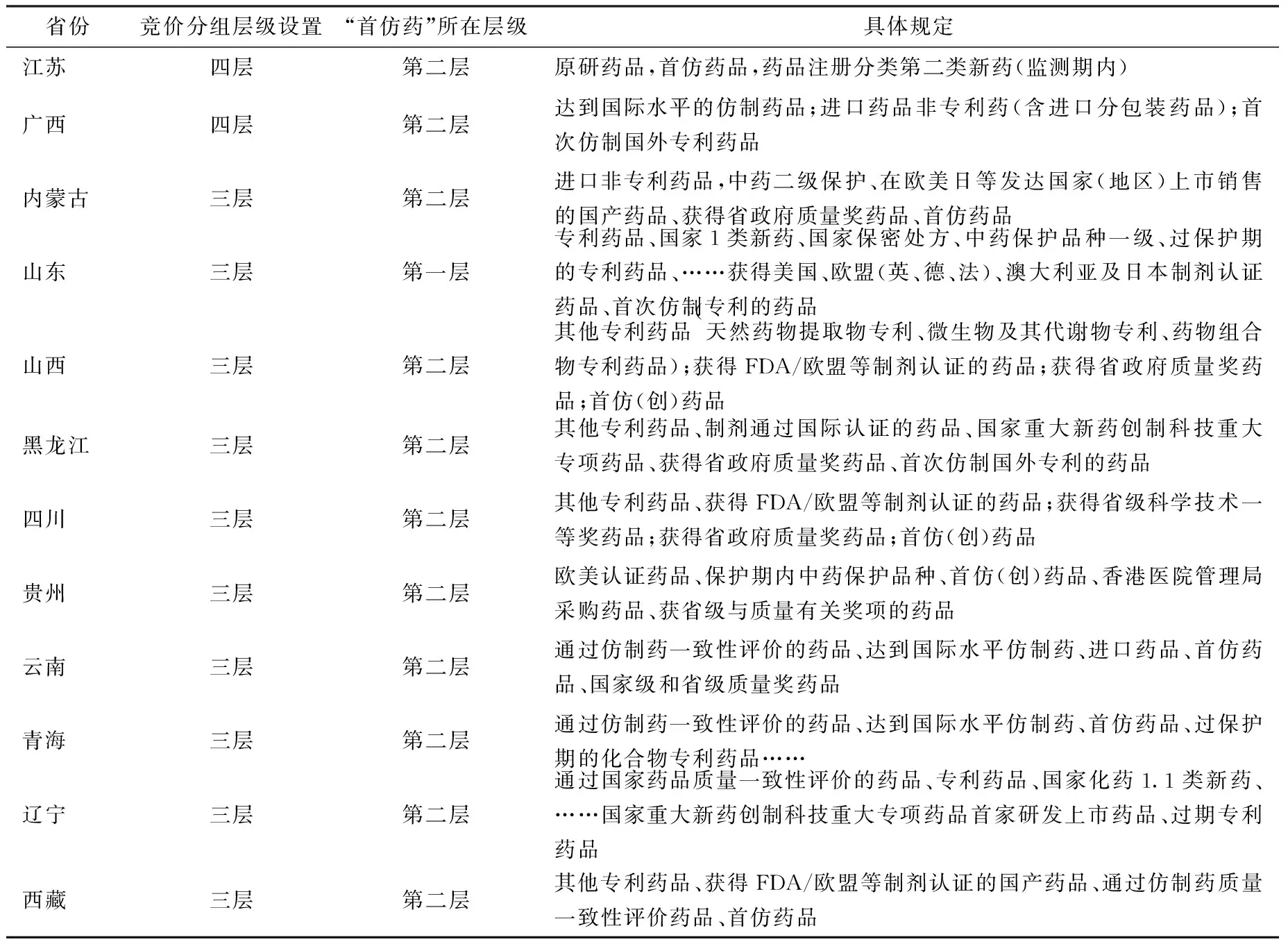
省份競(jìng)價(jià)分組層級(jí)設(shè)置“首仿藥”所在層級(jí)具體規(guī)定江蘇四層第二層原研藥品,首仿藥品,藥品注冊(cè)分類(lèi)第二類(lèi)新藥(監(jiān)測(cè)期內(nèi))廣西四層第二層達(dá)到國(guó)際水平的仿制藥品;進(jìn)口藥品非專(zhuān)利藥(含進(jìn)口分包裝藥品);首次仿制國(guó)外專(zhuān)利藥品內(nèi)蒙古三層第二層進(jìn)口非專(zhuān)利藥品,中藥二級(jí)保護(hù)、在歐美日等發(fā)達(dá)國(guó)家(地區(qū))上市銷(xiāo)售的國(guó)產(chǎn)藥品、獲得省政府質(zhì)量獎(jiǎng)藥品、首仿藥品山東三層第一層專(zhuān)利藥品、國(guó)家1類(lèi)新藥、國(guó)家保密處方、中藥保護(hù)品種一級(jí)、過(guò)保護(hù)期的專(zhuān)利藥品、……獲得美國(guó)、歐盟(英、德、法)、澳大利亞及日本制劑認(rèn)證藥品、首次仿制專(zhuān)利的藥品山西三層第二層其他專(zhuān)利藥品(天然藥物提取物專(zhuān)利、微生物及其代謝物專(zhuān)利、藥物組合物專(zhuān)利藥品);獲得FDA/歐盟等制劑認(rèn)證的藥品;獲得省政府質(zhì)量獎(jiǎng)藥品;首仿(創(chuàng))藥品黑龍江三層第二層其他專(zhuān)利藥品、制劑通過(guò)國(guó)際認(rèn)證的藥品、國(guó)家重大新藥創(chuàng)制科技重大專(zhuān)項(xiàng)藥品、獲得省政府質(zhì)量獎(jiǎng)藥品、首次仿制國(guó)外專(zhuān)利的藥品四川三層第二層其他專(zhuān)利藥品、獲得FDA/歐盟等制劑認(rèn)證的藥品;獲得省級(jí)科學(xué)技術(shù)一等獎(jiǎng)藥品;獲得省政府質(zhì)量獎(jiǎng)藥品;首仿(創(chuàng))藥品貴州三層第二層歐美認(rèn)證藥品、保護(hù)期內(nèi)中藥保護(hù)品種、首仿(創(chuàng))藥品、香港醫(yī)院管理局采購(gòu)藥品、獲省級(jí)與質(zhì)量有關(guān)獎(jiǎng)項(xiàng)的藥品云南三層第二層通過(guò)仿制藥一致性評(píng)價(jià)的藥品、達(dá)到國(guó)際水平仿制藥、進(jìn)口藥品、首仿藥品、國(guó)家級(jí)和省級(jí)質(zhì)量獎(jiǎng)藥品青海三層第二層通過(guò)仿制藥一致性評(píng)價(jià)的藥品、達(dá)到國(guó)際水平仿制藥、首仿藥品、過(guò)保護(hù)期的化合物專(zhuān)利藥品……遼寧三層第二層通過(guò)國(guó)家藥品質(zhì)量一致性評(píng)價(jià)的藥品、專(zhuān)利藥品、國(guó)家化藥1.1類(lèi)新藥、……國(guó)家重大新藥創(chuàng)制科技重大專(zhuān)項(xiàng)藥品首家研發(fā)上市藥品、過(guò)期專(zhuān)利藥品西藏三層第二層其他專(zhuān)利藥品、獲得FDA/歐盟等制劑認(rèn)證的國(guó)產(chǎn)藥品、通過(guò)仿制藥質(zhì)量一致性評(píng)價(jià)藥品、首仿藥品
3.3 評(píng)價(jià)體系的科學(xué)性仍待提高
3.3.1 指標(biāo)體系未能全面直接體現(xiàn)藥品質(zhì)量
評(píng)價(jià)體系主要通過(guò)構(gòu)建指標(biāo)對(duì)藥品進(jìn)行各方面的考察,最終在投標(biāo)企業(yè)中選擇藥品質(zhì)量好、臨床療效高、價(jià)格能夠負(fù)擔(dān)的藥品作為中標(biāo)藥品參加省級(jí)藥品集中采購(gòu),是藥品集中采購(gòu)制度的核心內(nèi)容。
目前,我國(guó)競(jìng)價(jià)分組指標(biāo)體系主要包括藥品注冊(cè)審評(píng)情況、藥品獲獎(jiǎng)情況和企業(yè)資質(zhì)三大類(lèi)(表3—表5)。其中,與藥品關(guān)系最為密切的藥品注冊(cè)審評(píng)情況難以客觀(guān)體現(xiàn)藥品質(zhì)量*競(jìng)價(jià)分組中涉及藥品注冊(cè)評(píng)審的內(nèi)容主要包括藥品專(zhuān)利情況、是否通過(guò)一致性評(píng)價(jià)、是否符合國(guó)際標(biāo)準(zhǔn)三方面。其中,專(zhuān)利情況難以充分證明藥品質(zhì)量;我國(guó)一致性評(píng)價(jià)工作尚未開(kāi)展,該條內(nèi)容尚不能發(fā)揮其應(yīng)有作用;將符合國(guó)際標(biāo)準(zhǔn)納入競(jìng)價(jià)分組的省份目前不到50%。因此,現(xiàn)階段藥品審評(píng)無(wú)法客觀(guān)體現(xiàn)藥品質(zhì)量;而獲獎(jiǎng)情況和企業(yè)資質(zhì)與藥品質(zhì)量關(guān)聯(lián)性更小。表明我國(guó)現(xiàn)階段競(jìng)價(jià)分組外圍指標(biāo)過(guò)多,難以準(zhǔn)確體現(xiàn)同通用名項(xiàng)下藥品間的質(zhì)量差異,與“優(yōu)質(zhì)優(yōu)價(jià)”的原則相背離。[8]
3.3.2 評(píng)價(jià)主體職能與藥品質(zhì)量關(guān)聯(lián)度不高
現(xiàn)階段,我國(guó)競(jìng)價(jià)分組指標(biāo)體系構(gòu)建工作主要由由衛(wèi)生計(jì)生委藥政管理部門(mén)承擔(dān)。但其主要職能范圍為公立醫(yī)院改革、基本藥物制度運(yùn)行及管理、藥品價(jià)格控制,不良反應(yīng)監(jiān)測(cè)等*《國(guó)務(wù)院關(guān)于機(jī)構(gòu)設(shè)置的通知》(國(guó)發(fā)[2013]14號(hào))主要職責(zé)第6、7、16條;其他事項(xiàng)第3條,并未涉及藥品質(zhì)量評(píng)價(jià)相關(guān)內(nèi)容;與此同時(shí),主管藥品的藥物政策與基本藥物制度司和各省藥政處主要負(fù)責(zé)競(jìng)價(jià)分組指標(biāo)體系構(gòu)建,而這些部門(mén)并不具有藥品質(zhì)量評(píng)價(jià)的相關(guān)職能。由此,評(píng)價(jià)主體與藥品質(zhì)量評(píng)價(jià)關(guān)聯(lián)度較低,成為外圍評(píng)價(jià)指標(biāo)過(guò)多,藥品質(zhì)量難以體現(xiàn)的主要原因。
4 結(jié)論與建議
4.1 設(shè)置合理的質(zhì)量層級(jí)
設(shè)置合理的質(zhì)量層次的意義在于體現(xiàn)競(jìng)價(jià)分組“質(zhì)量?jī)?yōu)先”的本質(zhì),而統(tǒng)一我國(guó)質(zhì)量層次水平就成為亟待解決的問(wèn)題。建議在保證質(zhì)量層次區(qū)分的前提下,設(shè)置較少的層級(jí),這樣既能夠保證質(zhì)量,又能夠促使各層級(jí)之間形成一定的競(jìng)爭(zhēng),有利于降低藥品價(jià)格,就各省具體情況而言,將層級(jí)設(shè)置為三層較為合理,且各省(市)層級(jí)統(tǒng)一較為容易。
4.2 引入國(guó)際質(zhì)量評(píng)價(jià)指標(biāo)
現(xiàn)階段,我國(guó)藥品注冊(cè)審評(píng)中“仿標(biāo)準(zhǔn),不仿質(zhì)量”的情況較為普遍,藥品質(zhì)量差異難以在審批環(huán)節(jié)得到準(zhǔn)確體現(xiàn);同時(shí),另一個(gè)用來(lái)體現(xiàn)藥品質(zhì)量情況的方法——競(jìng)價(jià)分組,由于其多選用與質(zhì)量關(guān)聯(lián)性不大的指標(biāo)(如企業(yè)規(guī)模、藥品注冊(cè)情況等),導(dǎo)致藥品質(zhì)量在集中采購(gòu)環(huán)節(jié)也難以凸顯。
由于國(guó)際認(rèn)證體系在“產(chǎn)品注冊(cè)”、“GMP認(rèn)證”兩個(gè)方面都提出了更高的要求,其成品藥在“質(zhì)量穩(wěn)定性”(批間差異)、“安全性”(有關(guān)物質(zhì))、“有效性”(生物利用度)等方面優(yōu)勢(shì)明顯;且國(guó)際認(rèn)證體系與國(guó)內(nèi)的“仿制藥一致性評(píng)價(jià)”都是通過(guò)使用科學(xué)規(guī)范的手段方法,對(duì)藥品質(zhì)量進(jìn)行評(píng)估,對(duì)藥品安全性和有效性的監(jiān)管更加有效。建議應(yīng)當(dāng)在競(jìng)價(jià)分組體系中引入能夠反映藥品質(zhì)量情況的指標(biāo)改善上述情況(表7)。
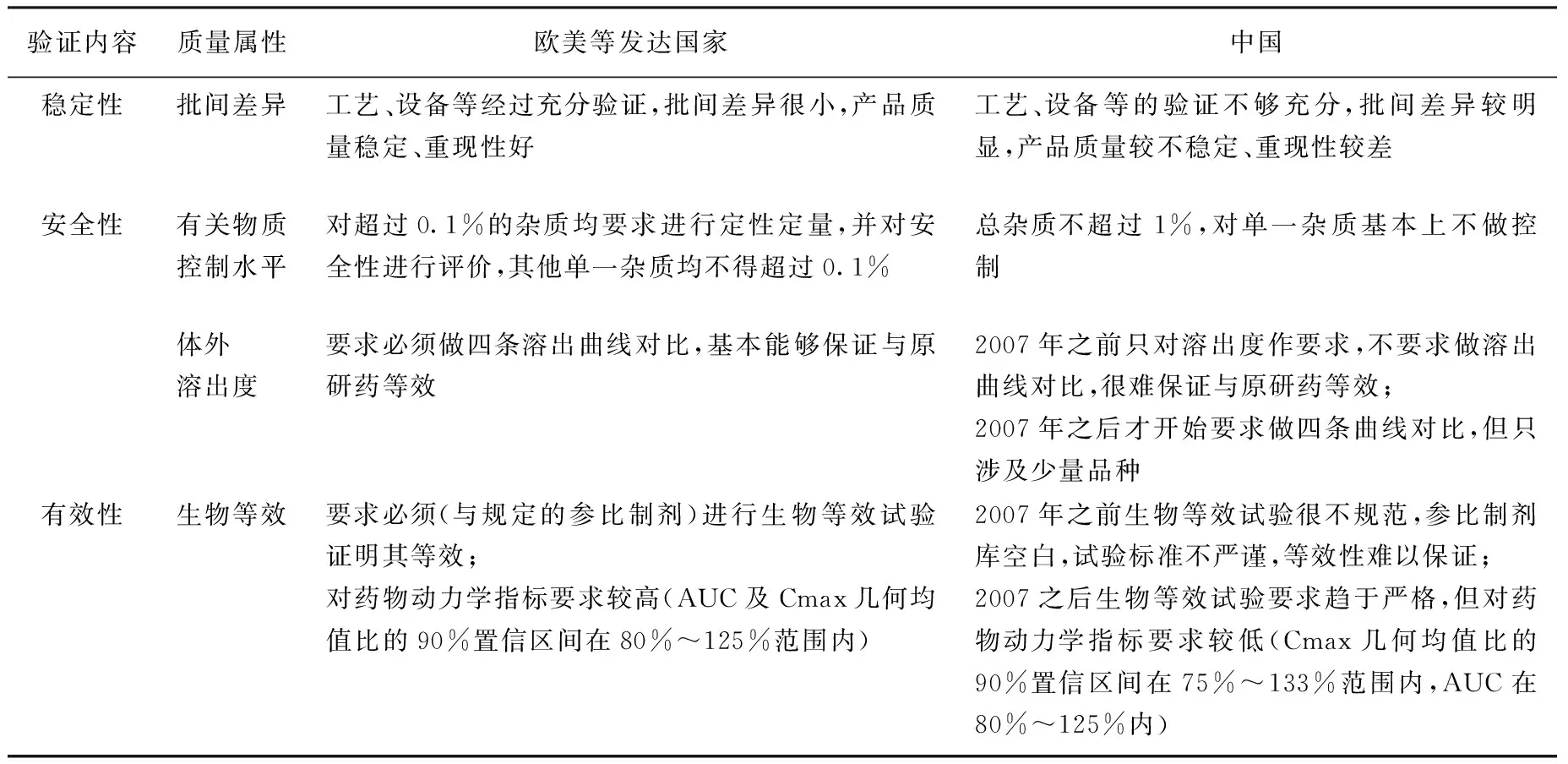
表7 國(guó)際認(rèn)證體系與中國(guó)藥品審批標(biāo)準(zhǔn)主要指標(biāo)對(duì)比情況[9]
目前,浙江、天津、湖南等10個(gè)省(市)最近一輪的藥品集中招標(biāo)采購(gòu)當(dāng)中已經(jīng)率先將“是否通過(guò)國(guó)際藥品質(zhì)量認(rèn)證體系”作為競(jìng)價(jià)分組指標(biāo),并置于較高組別當(dāng)中,這將為該指標(biāo)在競(jìng)價(jià)分組中的推廣提供實(shí)踐基礎(chǔ)。
4.3 構(gòu)建科學(xué)的評(píng)價(jià)體系
4.3.1 設(shè)置合理的評(píng)價(jià)指標(biāo)
參照70號(hào)文要求及國(guó)外藥品采購(gòu)發(fā)展趨勢(shì),本文建議構(gòu)建直接指標(biāo)與間接指標(biāo)相結(jié)合的質(zhì)量評(píng)價(jià)體系。其中,直接指標(biāo)主要負(fù)責(zé)考察藥品質(zhì)量問(wèn)題,盡可能消除同品種質(zhì)量分層的現(xiàn)象,主要包括:企業(yè)資質(zhì)認(rèn)證(如GMP、COS認(rèn)證)、一致性評(píng)價(jià)(主要是指體外溶出度檢測(cè),工藝、設(shè)備驗(yàn)證,藥品雜質(zhì)檢測(cè)等)、生物等效性評(píng)價(jià)等;而間接指標(biāo)在確保質(zhì)量的前提下,綜合考慮企業(yè)的生產(chǎn)供給能力、信用情況,為采購(gòu)方選擇藥品提供參考,如企業(yè)規(guī)模、藥品獲獎(jiǎng)情況、是否為首仿藥品等(表7)。
但是,競(jìng)價(jià)分組僅是針對(duì)我國(guó)目前現(xiàn)狀的權(quán)宜之計(jì),從未來(lái)藥品采購(gòu)發(fā)展的趨勢(shì)來(lái)看,競(jìng)價(jià)分組的形式將逐漸被一致性評(píng)價(jià)為主的評(píng)價(jià)體系代替。在該體系下,一致性評(píng)價(jià)確保藥品質(zhì)量,即原研藥與仿制藥不存在質(zhì)量差異,藥品采購(gòu)制度將回歸其服務(wù)職能,通過(guò)發(fā)揮帶量?jī)?yōu)勢(shì),來(lái)?yè)Q取價(jià)格上的優(yōu)惠,這將是我國(guó)藥品集中采購(gòu)未來(lái)發(fā)展的主要方向。
4.3.2 評(píng)價(jià)主體應(yīng)與藥品質(zhì)量評(píng)價(jià)密切相關(guān)
伴隨著評(píng)價(jià)體系的變化,評(píng)價(jià)主體也要進(jìn)行相應(yīng)調(diào)整,在遵循“各盡其能”的原則下評(píng)價(jià)主體應(yīng)當(dāng)由衛(wèi)生計(jì)生委調(diào)整為負(fù)責(zé)藥品質(zhì)量的相關(guān)部門(mén)。具體做法是,在保持現(xiàn)階段衛(wèi)生計(jì)生委和各省市藥政主管部門(mén)為評(píng)價(jià)主體的基礎(chǔ)上,逐步過(guò)渡到衛(wèi)生計(jì)生委與CFDA聯(lián)合進(jìn)行藥品質(zhì)量評(píng)價(jià),待我國(guó)一致性評(píng)價(jià)方案基本完善,藥品質(zhì)量以直接指標(biāo)評(píng)價(jià)為主后,評(píng)價(jià)主體將調(diào)整為與藥品質(zhì)量關(guān)系最為密切的部門(mén),如負(fù)責(zé)仿制藥上市前評(píng)價(jià)的藥品審評(píng)中心(CDE)及負(fù)責(zé)仿制藥上市后評(píng)價(jià)的一致性評(píng)價(jià)辦公室等。同時(shí),評(píng)價(jià)主體需協(xié)同多部門(mén)參與,確保藥品質(zhì)量評(píng)價(jià)的價(jià)值在藥品集中采購(gòu)中真正得以體現(xiàn)。
[1] 湯少梁, 張玉蓉. 藥品招標(biāo)采購(gòu)中質(zhì)量分層機(jī)制的評(píng)價(jià)研究[J]. 中國(guó)執(zhí)業(yè)藥師, 2014(8): 36- 40, 56.
[2] 尹明芳, 徐愛(ài)軍, 梁紅云, 等. 醫(yī)療機(jī)構(gòu)藥品集中采購(gòu)質(zhì)量層次劃分研究[J]. 藥學(xué)與臨床研究, 2014(1): 5-14.
[3] 陳昊. 質(zhì)量層次劃分的歷史演進(jìn)[N]. 醫(yī)藥經(jīng)濟(jì)報(bào), 2015-10-12(F02).
[4] 國(guó)家食品藥品監(jiān)督管理中心. 企業(yè)查詢(xún)[DB/OL]. [2016-09-06]. http://app1.sfda.gov.cn/data search/face3/dir.html
[5] 馮毅, 朱波. 關(guān)于我國(guó)仿制藥質(zhì)量一致性評(píng)價(jià)的研究及建議[J]. 中國(guó)新藥雜志, 2016(1): 19-26, 41.
[6] 2015—2016年我國(guó)各省市藥品集中采購(gòu)方案[S].
[7] 朱琳, 孫利華, 劉國(guó)恩, 等. 關(guān)于藥品招標(biāo)中質(zhì)量分層的思考[J]. 中國(guó)藥房, 2010(40): 3774-3777.
[8] 周明月, 宋民憲, 俞鋮航. 我國(guó)藥品招標(biāo)管理中的藥品質(zhì)量分層問(wèn)題研究[J]. 藥品評(píng)價(jià), 2015(6): 20-23, 44.
[9] 畢軍, 陳佩毅, 沈傳勇, 等. 通過(guò)國(guó)際藥品GMP認(rèn)證的藥品生產(chǎn)企業(yè)調(diào)研情況分析[J]. 中國(guó)藥事, 2014(9): 954-958.
(編輯 薛云)
Assessment and rational thinking of “Bidding Group” in Chinese centralized drug procurement system
DINGJin-xi1,DONGRui1,LIWei1,GONGBo-jun2,WANGJun-yan1
1.SchoolofPharmaceuticalBusinessofChinaPharmaceuticalUniversity,NanjingJiangsu211198,China2.ChinaResourcesSaikePharmaceuticalCo.,Ltd,Beijing100124,China
In 2015, policy reforms on centralized drug purchasing system have been released one by one, and the quality of medicines has been highly valued. Centralized drug purchasing system distinguishes different qualities of drugs mainly through bidding grouping, in order to achieve “uality priority”. However, there are yet some existing problems in group bidding policy at present, such as lack of a unified hierarchy, no scientific indicators and so on, which inevitably weaken the leading role of centralized purchasing policy over the quality of medicines. This paper, focuses on the study of group bidding, and the existing main problems are found through the statistical analysis of relevant policies introduced in different provinces. Finally, it explores some optimization strategies for “Group Bidding” which is of paramount importance.
Centralized drug procurement; Bidding group; Policy evaluation
2015年與2016年國(guó)家衛(wèi)生與計(jì)劃生育委員會(huì)委托課題(藥政[2015] 12號(hào);藥政[2016]11號(hào))
丁錦希,男(1971年—),教授,博士生導(dǎo)師,主要研究方向?yàn)獒t(yī)藥知識(shí)產(chǎn)權(quán)、醫(yī)藥政策法規(guī)。 E-mail:13605152326@163.com
R197
A
10.3969/j.issn.1674-2982.2016.09.010
2016-06-29
2016-09-06
- 中國(guó)衛(wèi)生政策研究的其它文章
- 醫(yī)學(xué)生農(nóng)村基層擇業(yè)意向調(diào)查及因素分析
——基于甘肅省的調(diào)查 - 西部醫(yī)學(xué)院校醫(yī)學(xué)生農(nóng)村地區(qū)執(zhí)業(yè)意愿及其影響因素
——基于城鄉(xiāng)戶(hù)籍比較視角 - 農(nóng)村訂單定向醫(yī)學(xué)生免費(fèi)培養(yǎng)政策實(shí)施現(xiàn)狀調(diào)查
- 我國(guó)各省藥品集中采購(gòu)政策落實(shí)比較分析
- 北京醫(yī)藥分開(kāi)試點(diǎn)成效及啟示
——以北京朝陽(yáng)醫(yī)院為例 - 院長(zhǎng)特征對(duì)民營(yíng)醫(yī)院競(jìng)爭(zhēng)力的影響研究
——基于100所民營(yíng)醫(yī)院的數(shù)據(jù)

