高中化學鹽類水解規律及其解題運用
廖信言●
江西省贛州市上猶中學(341200)
?
高中化學鹽類水解規律及其解題運用
廖信言●
江西省贛州市上猶中學(341200)
高中化學鹽類水解規律是其基礎知識的重要的組成部分,在高中化學的題型當中也占據著一定的比重,因此加強對化學鹽類水解規律的知識鞏固對學生的分數的提高也是具有重要意義的.本文對高中化學鹽類水解規律進行分析,對高中化學鹽類水解規律在題目當中的運用進行分析,幫助學生理清解題思路,從而促使其完善知識結構.
1.高中化學鹽類水解規律的條件
鹽類是高中化學當中十分重要的一個類別,鹽類水解我們可以進行總結為鹽的離子跟水電離出來的氫離子或氫氧根離子生成弱電解質的反應,稱為鹽類的水解.在哪一些情況下會出現鹽類的水解呢?這是對其鹽類的濃度、酸堿性、離子特質等進行分析,化學中鹽類的水解可以總結為誰弱誰水解,誰強顯誰性;兩強不水解,兩弱更水解,越弱越水解.這也是其一般特性下的水解.“有弱才水解”這個含義是在鹽類當中是需要有弱酸根離子或者具有弱堿金屬離子.
例如NaCl中的Na+對應的堿是強堿NaOH,則Na+是強堿金屬離子,不會水解.NaCl中的Cl-對應的酸是強酸HCl ,則Cl-是強酸根離子,也不會水解.所以,NaCl在水溶液是不會發生水解.
在化學題目當中對鹽類水解的條件進行分析,水解分析條件是有其性質上的差異,因此也有鹽類水解進行分析,從而對這一類題目規劃到例題一進行分析.來以對水解的條件進行分析也是十分重要的,鹽類的離子有其所對應的酸堿性,因此當離子的酸堿性越來越弱,水解的可能性也越來越大
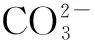
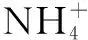
2.高中化學鹽類水解規律的解題運用
高中化學鹽類水解規律一直以來是基礎化學知識當中的重難點,為此有針對地進行訓練是對學生整體學習水平的提高.本文對高中化學條件對水電離平衡的影響以及對其在解題當中知識的運用對學生的學習時具有重要的借鑒意義以及教育意義的.學生對知識的掌握不是一蹴而就的,而是不斷地對其知識進行補充和進行自我學習與總結,這是十分重要的.在前期的知識掌握牢固之后才可以有效地對題目進行解答.
在一些情況下,對題型認識的不斷深入,在高中化學當中對何種情況下會出現鹽類水解進行分析,才能在實際當中考慮清楚多種結論,對此將在多種情況下發生的鹽類水解情況進行分析,從而對此種題型進行歸納,歸納為題型二.方便學生找準類似題型的解題方法.
例如,學生應該在哪些情況下考慮鹽的水解呢?分析鹽溶解酸堿性的時候要對水解進行分析,同時對鹽溶液當中所存在的離子的種類要對鹽的水解性進行考慮,這也是十分重要的.經常所提到的鹽類是分為強酸強堿鹽,這一類鹽基本上是很難發生水解的,除此之外還有強酸弱堿鹽以及弱酸強堿鹽,弱酸強堿鹽.每一種鹽類在不同程度上是可以進行水解的.除這四種類型的鹽類之外,還有多元弱酸或多元弱堿形成的鹽的水解,這一類是有步驟的進行的,相比較其他鹽類的水解化學方程式,這一類鹽的水解的過程是分步進行的,第一步的水解的量不斷地增多,隨之第二步的水解的程度就減慢了許多.

因此教師在進行教授的時候需要對高中化學的鹽類的水解進行分類,不同的鹽類水解的程度也有所不同,因此對水解反應當中所產生的水的多少也是有所區別.不少學生在進行做題的時候,所列出的化學反應式當中沒有水,就認為其鹽類是無法發生水解的,這一想法是錯誤的,不產生水并不代表沒有水參加.
高中化學鹽類水解規律并非是十分困難的知識點,學生的學習主要也是以理解與記憶為主,在水解過程當中的影響因素進行分析就能夠對鹽類的水解最終得到的結論是正確的.為此,教師要鍛煉學生學習的能力,增加他們對知識的掌握,才能基于此對知識進行靈活應用.樹立學生解題的自信心,伴隨著分數的增長提高學生對高中化學基礎知識的掌握.
G632
B
1008-0333(2016)28-0076-01

