凝血酶抑制劑nexin-1對腦出血大鼠腦神經損傷和血腦屏障通透性的影響
曹 華
大連醫科大學附屬第一醫院神經內科 大連 116011
?
凝血酶抑制劑nexin-1對腦出血大鼠腦神經損傷和血腦屏障通透性的影響
曹 華
大連醫科大學附屬第一醫院神經內科 大連 116011
目的 探討凝血酶抑制劑nexin-1對腦出血大鼠腦神經損傷和血腦屏障通透性的影響。方法 將大鼠隨機分為對照組、模型組和干預組,采用尾狀核注射自體動脈血的方法復制腦出血模型,在造模的過程中往干預組尾狀核部位注射凝血酶抑制劑nexin-1,其余組注射生理鹽水。在給藥12 h、24 h和36 h后分別進行腦組織形態學檢查、腦組織神經細胞凋亡檢查、腦組織含水量檢查和腦組織血腦屏障通透性檢查。結果 干預組腦神經細胞排列有輕微紊亂,形態結構異常的程度較輕,細胞核仍然有胞核固縮和胞質凝集的現象,但程度與模型組相比顯著降低;干預組腦組織凋亡神經細胞數顯著低于模型組(P<0.05);干預組腦組織含水量顯著低于模型組(P<0.05);干預組大鼠腦組織皮層和基底節的血腦屏障通透性顯著低于模型組(P<0.05)。結論 凝血酶抑制劑nexin-1對腦出血后的腦神經損傷、血腦屏障通透性起保護作用。
nexin-1;腦神經損傷;血腦屏障;通透性
腦出血在臨床中具有較高的發生率和病死率,主要是由于腦出血后會并發嚴重的炎癥反應、腦細胞毒性損傷、腦水腫等,其中腦水腫是腦出血最為常見和嚴重的并發癥[1-2]。目前國內外的學者已經研究證實凝血酶在腦出血后的炎癥反應、腦細胞毒性損傷、腦水腫等并發癥的發生和發展的過程中起非常重要的作用[3-4]。凝血酶作為一種絲氨酸蛋白酶,是血液凝固所必需的,低濃度凝血酶在腦卒中后缺血和出血中的保護作用已經很清楚,而高濃度的凝血酶則具有較強的神經毒性作用,是導致腦出血后并發癥發生的主要原因[5-6]。本課題組提出了用凝血酶抑制劑保護大鼠腦出血腦神經損傷和血腦屏障的假說。凝血酶抑制劑nexin-1是一種內生的絲氨酸蛋白水解酶,能迅速抑制凝血酶的表達及活性,因此,本文通過對腦出血大鼠外源性的加入凝血酶抑制劑,觀察凝血酶抑制劑nexin-1對腦出血后腦水腫大鼠的保護作用,為臨床上治療腦出血提供新的依據和方法。
1 材料與方法
1.1 材料
1.1.1 動物:本研究選有清潔級的Wistar大鼠,100只,雄性,體質量200~250 g,實驗動物由哈爾濱醫科大學實驗動物中心提供,實驗大鼠合格證號為SCXK(黑):2013-002。
1.1.2 主要試劑及儀器:試劑:凝血酶抑制劑nexin-1(Gibco公司),水合氯醛(山東齊魯制藥廠),伊文思藍(Bioworlde公司)。儀器:立體定位儀(Amersham Biosciences 公司),分析天平(上海精密科學儀器有限公司),分光光度計(上海美譜達儀器有限公司)。
1.2 動物分組、模型復制及給藥 本研究共分為對照組、模型組和干預組,每組又根據動物處理時間再分為3 h、6 h、12 h、24 h和60 h組。本研究中的模型組和干預組對動物模型復制采用大鼠自體動脈血注射復制腦出血大鼠模型。主要步驟:將購買的符合體質量要求的大鼠適應性喂養1周,3.5%水合氯醛腹腔注射麻醉大鼠老鼠,將麻醉后的大鼠置于立體定位儀中,在大鼠頭皮正中行切口,左側顱骨鉆孔(中線旁開3 mm,前囟前0.2 mm)。用注射器取尾動脈自體血(50 μL),不加抗凝劑。注射器迅速連上針頭,將動脈血迅速的注入顱骨下5.5 mm的左側尾狀核。然后換另一側,盡量減少反流,然后緩慢移出,用骨蠟封閉顱骨鉆孔,縫合頭皮。對于對照組大鼠步驟與上述基本一致,只是在尾狀核部位注入50 μL生理鹽水。在對照組和模型組大鼠復制模型的同時往大鼠尾狀核部位注入10 μL生理鹽水,在干預組大鼠復制模型的同時于大鼠尾狀核部注入10 μL的凝血酶抑制劑nexin-1。
1.3 指標檢測
1.3.1 腦組織形態學觀察:各組大鼠在模型復制成功并給藥后12 h、24 h和36 h后腹腔注射3.5%水合氯醛麻醉后迅速斷頭取出腦組織,將出血側大鼠大腦表面有針孔的冠狀切開,取前部腦出血周圍厚度為3 mm的腦組織標本,用10%甲醛固定、脫水、包埋,用石蠟切片機對包埋后的腦組織標本進行切片,切片厚度為5 μm,對切再進行脫蠟和HE染色,在光學纖維鏡下對各組大鼠的腦組織形態進行觀察。
1.3.2 腦組織神經細胞凋亡檢測:取各組大鼠腦組織的石蠟切片,使用TUNEL染色法對大鼠腦組織中的神經細胞凋亡進行檢測。其中以腦組織神經細胞漿或細胞核中有棕黃色顆粒出現作為腦組織神經細胞凋亡的陽性判斷標準。用倒置纖維鏡觀察,并400倍鏡的視野下隨機選取5個視野觀察并記錄視野中的陽性細胞個數。
1.3.3 腦組織含水量的檢測:采用干濕質量法對各組大鼠腦組織含水量進行檢測。各組大鼠在腹腔麻醉處死后迅速取出大腦,并快速稱取大腦的濕質量,讓后將大腦放在95 ℃的烘箱中烘烤24 h,直至烘烤后的大腦體質量衡重,快速稱取大腦的干質量。大鼠腦組織含水量=(大腦濕質量-大腦干質量)/大腦濕質量×100%。
1.3.4 大鼠血腦屏障通透性的檢測:各組大鼠在相應的處理時間點使用腹腔注射3.5%水合氯醛麻醉后,在處死前1 h通過尾靜脈將2%伊文思藍注到大鼠體內,伊文思藍的注射劑量為0.3 mL/100 g,當大鼠的眼球結膜和四肢出現藍色時標明伊文思藍注射成功,停止注射伊文思藍。在取各組大鼠的大腦皮質和紋狀體之前將生理鹽水從大鼠的左心室灌注,直至大鼠的右耳有清亮色的液體流出。取大鼠大腦,取雙側的紋狀體和皮層,將取出的紋狀體和皮層用分析天平進行精密稱重,將稱重后的紋狀體和皮層放在容量為5 mL的二甲基甲酰胺溶液的試管中,在37 ℃的條件下水浴48 h,將水浴后的紋狀體和皮層在離心機中進行離心并收集上清液,離心的條件為3 000 r/ min,離心15 min,采用分光光度法檢測上清液中伊文思藍在632 nm波長處的最大吸光度,然后在根據伊文思藍的標準曲線計算出紋狀體和皮層中的伊文思藍含量。
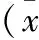
2 結果
2.1 凝血酶抑制劑nexin-1對腦出血大鼠腦組織病理形態的影響 對照組大鼠大腦皮質中的腦組織結構正常,神經細胞形態正常且排列順序整齊,腦皮層中的細胞著色均勻,細胞核呈現為藍色,細胞漿呈現為淡紅色;模型組大鼠大腦皮層中的腦組織結構出現異常變化,神經細胞之間的間隙增大且排列順序紊亂,神經細胞出現顯著變異,有部分神經細胞出現凋亡的癥狀:細胞核核質濃縮到邊集,且細胞核有固縮和溶溶解的癥狀,細胞質凝集,細胞體積減小,模型組上述腦組織病理形態異常在造模成功12 h后最為嚴重,隨后異常程度減輕;干預組腦神經細胞排列有輕微紊亂,形態結構異常的程度較輕,細胞核仍然有胞核固縮和胞質凝集的現象,但程度與模型組相比顯著降低,隨著干預時間的延長腦組織病理異常恢復的程度逐漸增加。見圖1。

圖1 凝血酶抑制劑nexin-1對腦出血大鼠腦組織病理形態的影響(HE染色×400)A對照組,B 模型組12 h,C 模型組24 h,D 模型組36 h,E 干預組12 h,F 干預組24 h,G 干預組36 h
2.2 凝血酶抑制劑nexin-1對腦出血大鼠腦組織神經細胞凋亡的影響 對各組大鼠腦組織的石蠟切片進行TUNEL染色。結果表明對照組大鼠腦組織石蠟切片中偶爾可以見到陽性的神經細胞,模型組大鼠腦組織石蠟切片中陽性的神經細胞數量顯著增加,模型組在陽性細胞數均顯著高于對照組,差異有統計學意義(P<0.05),且在造模成功后的12 h陽性細胞數最多;干預組腦組織石蠟切片中的陽性細胞數均顯著低于模型組,差異有統計學意義(P<0.05)。見表1。
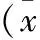
表1 各組腦出血大鼠腦組織神經細胞凋亡的 陽性細胞數比較±s)
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05
2.3 凝血酶抑制劑nexin-1對腦出血大鼠腦組織含水量的影響 對各組大鼠腦組織含水量進行檢測。結果表明對照組腦水量無顯著變化(P>0.05);模型組大鼠腦組織含水量較對照組顯著增加(P<0.05),且在造模成功后的12 h時大鼠腦組織含水量最高;干預組腦組織含水量顯著低于模型組,且干預組中隨著nexin-1干預時間的延長腦組織含水量降低,差異均有統計學意義(P<0.05)。見表2。
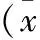
表2 各組腦出血大鼠腦組織含水量比較±s,%)
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05
2.4 凝血酶抑制劑nexin-1對腦出血大鼠腦組織血腦屏障通透性的影響 對各組大鼠腦組織血腦屏障通透性進行檢測。結果表明對照組大鼠腦組織皮層和基底節的血腦屏障通透性無顯著變化(P>0.05);模型組大鼠腦組織皮層和基底節的血腦屏障通透性較對照組顯著增加,且在造模成功后的12 h時腦組織皮層和基底節的血腦屏障通透性最大,差異有統計學意義(P<0.05);干預組大鼠腦組織皮層和基底節的血腦屏障通透性顯著低于模型組,且干預組中隨著nexin-1干預時間的延長大鼠腦組織皮層和基底節的血腦屏障通透性(P>0.05)。見表3。
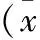
表3 各組大鼠腦組織皮層和基底節伊文思藍的濃度變化±s)
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05
3 討論
腦出血是臨床中常見的一種腦部疾病,目前在臨床中的有效治療方法主要為使用包括甘露醇在內的脫水藥物,除此之外的內科治療方法較為缺乏[7]。但腦出血在臨床中有較高的病死率和致殘率,在發病30 d內腦出血的病死率高達50%左右,未死亡的腦出血患者在6個月內僅有20%左右的患者能有功能意義上的恢復[8]。
致使腦出血患者死亡和殘疾的主要危險因素是腦出血后早期對腦神經細胞的毒性及晚期腦水腫的發生,其中腦出血后并發腦水腫是最重要的危險因素[9]。已有研究表明,腦出血后產生的血腫塊可以誘發大量凝血酶。凝血酶在正常人群大腦中的量極少,很難被檢測出來,一旦大腦中發生腦出血后則會誘導大量凝血酶的形成[10]。研究表明,小劑量的凝血酶在機體發生出血時有非常重要的保護作用[11-12]。(1)小劑量凝血酶可以保護腦神經細胞和腦星形膠質細胞,避免其因微環境的缺血、缺氧、低血糖而死亡;(2)小劑量凝血酶可以促進腦膠質細胞合成和分泌神經生長因子,進而促進腦神經細胞的軸突生長;(3)小劑量的凝血酶可以降低出血范圍的增加,減輕腦水腫。但同時還有研究發現,大劑量凝血酶在腦出血后的腦損傷中起非常重要的作用,特別是與腦出血后腦水腫的發生有十分緊密的關系。大劑量的凝血酶會促進腦出血后腦神經細胞損傷、腦血腫、炎癥、腦神經細胞凋亡等[13]。動物實驗結果已經表明,腦出血后并發腦水腫主要是由于大量凝血酶產生的毒性作用所引起[14]。凝血酶成為腦出血后并發腦水腫的啟動點。因此目前通過調節腦出血后凝血酶的水平及活性成為治療腦出血的一個新治療方法。
凝血酶抑制劑nexin-1是一種內生的凝血酶抑制劑,他是一種44 U的絲氨酸蛋白水解酶,屬于連接蛋白家族和絲氨酸超家族[15]。腦里面含有大量的凝血酶抑制劑nexin-1。凝血酶抑制劑nexin-1能迅速抑制凝血酶,通過絲氨酸蛋白酶催化劑與凝血酶形成穩定的SDS復合物[16]。凝血酶抑制劑nexin-1和凝血酶在神經系統創傷早期或損傷血腦屏障的其他情況下可以調節星型膠質細胞和神經細胞的生存能力。凝血酶抑制劑nexin-1主要分布在腦血管內和腦血管周圍,當腦內的血腦屏障的通透性增加時nexin-1可以對抗凝血原,降低凝血酶的活性,進而降低凝血酶對腦神經細胞的毒性及腦水腫[17-18]。
本研究中腦出血模型大鼠的腦組織病理形態出現了顯著的異常變化,相較于正常大鼠的腦組織腦神經細胞的排列紊亂、間隙增加,并有部分腦神經細胞出現凋亡的現象,而是用凝血酶抑制劑nexin-1進行干預后腦組織的異常病理變化的程度顯著降低,從組織病理形態上可以看出凝血酶抑制劑nexin-1對腦出血后的大腦組織具有保護作用;經nexin-1干預的腦出血大鼠腦組織中的凋亡細胞數目較模型組顯著減少,進一步說明nexin-1對腦出血后的腦組織神經細胞具有保護作用。腦組織含水量和血腦屏障通透性實驗結果表明,nexin-1可以降低腦出血后腦組織的含水量和降低血腦屏障的通透性,說明nexin-1可以通過改善腦出血后血腦屏障損傷,降低血腦屏障的通透性,降低腦水腫,達到了對腦出血的保護作用。
綜上所述,凝血酶抑制劑nexin-1對腦出血后的腦神經損傷、腦水腫起到保護作用,可以為臨床上治療腦出血后腦水腫提供新的依據和方法。
[1] 聶志紅,王德發,馬衛琴,等.醒腦靜對自發性腦出血患者血清基質金屬蛋白酶-9及神經功能的影響[J].中國醫藥導報,2014,11(5):75-77.
[2] 周慶博,賈青,張媛,等.黃芩苷對腦出血大鼠腦組織凝血酶受體-1表達及細胞凋亡的影響[J].中國中西醫結合雜志,2010,30(12):1 302-1 305.
[3] Wagner KR,Xi G,Hua Y,Zuccarello M,et al.Ultra-early clot aspiration after lysis with tissue plasminogen activator in a porcine model of intracerebral hemorrhage:edema reduction and blood brain barrier protection[J].J Neurosurg,2009,90(3):491-498.
[4] Rohatgi T,Henrich-Noack P,Sedehizade F,et al.Transient focal ischemia in rat brain differentially regulates mRNA expression of protease-activated receptors 1 to 4[J].J Neurosci Res 2004,75(2):273-279.
[5] Martini SR,Flaherty ML,Brown WM,et al.Risk factors for intracerebral hemorrhage differ according to hemorrhage location[J].Neurology,2012,79(23):2 275-2 282.
[6] Wu BH,Ma QY,Khatibi NK,et al.Ac-YVAD-CMK Decreases Blood-Brain Barrier Degradation by Inhibiting Caspase-1 Activation of Interleukin-1β in Intracerebral Hemorrhage Mouse Model[J].Transl Stroke Res,2010,1(1):57-64.
[7] 李萍,趙建軍,趙樹明.活血化瘀法治療腦出血的實驗研究進展[J].中華老年心腦血管病雜志,2012,14(10):1 117-1 118.
[8] Dowlatshah D,Demchuk AM,Flaherty ML,et al.Defining hematoma expansion in intracerebral hemorrhage:Relationship with patient outcomes[J].Neurology,2011,76(14):1 238-1 244.
[9] Xue M,Del Bigio MR.Comparison of brain cell death and inflammatory reaction in three models of intracerebral hemorrhage in adult rats[J].J Stroke Cerebrovasc Dis,2013,12(3):152-159.
[10] Vajda Z,Pedersen M,Fuchtbauer EM,et al.Delayed onsetof brain edema and mislocalization of aquaporin-4 indystrophin-null transgenic mice[J].Proc Natl Acad Sci USA,2012,99(20):13 131-13 136.
[11] Kasuya H,Shimizu T,Takakura K.Thrombin activity in CSF after SAH is correlated with the degree of SAH,the persistence of subarachnoid clot and the development of vasospasm[J].Acta Neurochir(Wien),1998,140(6):579-584.
[12] Sinnreich M,Marita M,Niclou SP,et al.Prothrombin overexpressed in post-natal neurons requires blood factors for activation in the mouse brain[J].J Neur Chem,2010,88(66):1 380-1 388.
[13] Striggow F,Riek M,Breder J,et al.The protease thrombin is an endogenous mediator of hippocampal neuroprotection against ischemia at low concentrations but causes degeneration at high concentrations[J].Proc Natl Acad Sci USA,2010,97(5):2 264-2 269.
[14] Riek-Burchardt M,Striggow F,Henrich-Noack P,et al.Increase of prothrombin-mRNA after global cerebral ischemia in rats,with constant expression of protease nexin-1 and protease activated receptors[J].J Neurosci Lett,2012,329(2):181-184.
[15] Wu H,Zhao R,Qi J,et al.The expression and the role of protease nexin-1 on brain edema after intracerebral hemorrhage[J].J Neurol Sci,2008,270(1/2):172-183.
[16] Reinhard E,Suidan HS,Pavlik A,et al.Glia-derived nexin/ protease nexin-1 is expressed by a subset of neurons in the rat brain[J].J Neurosci Res,2014,37(2):256-270.
[17] Richard B,Arocas V,Guillin MC,et al.Protease nexin-1:a cellular serpin down-regulated by thrombin in rat aortic smooth muscle cells[J].J Cell Physiol,2014,201(1):138-145.
[18] Hoffman MC,Nitsch C,Scotti AL,et al.The prolonged presence of glia-derived nexin an endogenous protease inhibitor in the hippocampus after ischemia-induced delayed neuronal death[J].Neuroscience,1992,49(2):397-408.
(收稿2016-06-09)
The effects of thrombin inhibitor nexin-1 on brain nerve damage and blood-brain barrier permeability in rats with cerebral hemorrhage
CaoHua
DepartmentofNeurology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China
Objective To explore the effects of thrombin inhibitor nexin-1 on brain nerve damage and blood-brain barrier (BBB) permeability in rats with cerebral hemorrhage.Methods The model of intracerebral hemorrhage (ICH) was duplicated and established by infusing autologous arterial blood into caudate nucleus of rats which were randomly divided into control group,model group and intervention group.In the process of molding,the intervention group also received injection of thrombin inhibitor nexin-1,however other two groups received normal saline.Then 12 hours,24 hours and 36 hours after administration,we respectively detected morphological examination,neuronal apoptosis,water content and BBB permeability of brain tissues.Results The intervention group showed slighter disorder in neuron arrangement,milder abnormal morphology and lower degree of nucleus condensation and cytoplasm aggregation compared with the other two groups.And the number of neuronal apoptosis,water content and BBB permeability of brain tissues in the intervention group were significantly lower than those in the model group (P<0.05).Conclusion Thrombin inhibitor nexin-1 has protective effects on brain nerve damage and blood-brain barrier (BBB)permeability after cerebral hemorrhage.
Nexin-1;Brain nerve damage;Blood-brain barrier;Permeability
R-332
A
1673-5110(2016)24-0004-04

