Lin28B/let-7d環路調控成纖維細胞功能參與肺纖維化發生
梁海海, 李天宇, 解 巖,單宏麗
(1.哈爾濱醫科大學藥學院藥理學教研室,省部共建生物醫藥重點實驗室培育基地,心血管藥物研究教育部重點實驗室,黑龍江 哈爾濱 150081;2.哈爾濱醫科大學大慶校區基礎醫學院生理學教研室,黑龍江 大慶 163319)
Lin28B/let-7d環路調控成纖維細胞功能參與肺纖維化發生
梁海海1, 李天宇1, 解 巖2,單宏麗1
(1.哈爾濱醫科大學藥學院藥理學教研室,省部共建生物醫藥重點實驗室培育基地,心血管藥物研究教育部重點實驗室,黑龍江 哈爾濱 150081;2.哈爾濱醫科大學大慶校區基礎醫學院生理學教研室,黑龍江 大慶 163319)
目的 研究Lin28B/let-7d環路誘導肺成纖維細胞增殖、分化的作用及分子機制,為臨床肺纖維化的治療提供新的策略。方法 氣管注射博來霉素(bleomycin,BLM)造成小鼠肺纖維化模型;血管緊張素Ⅱ(Ang Ⅱ)及轉化生長因子(transforming growth factor, TGF)-β1誘導人胚肺成纖維細胞(MRC-5)纖維性變;qRT-PCR檢測組織及細胞中Lin28B、collagen 1α1、collagen 3α1變化;Western blot檢測Lin28B蛋白表達;MTT、Edu染色和免疫熒光實驗分別檢測細胞活力、增殖及成纖維細胞向肌成纖維細胞的轉變。結果 Lin28B在肺纖維化小鼠和細胞中表達明顯升高。Lin28B可誘導MRC-5細胞膠原合成增加,而過表達let-7d則減輕Lin28B的這一作用。進一步研究發現,Lin28B可誘導成纖維細胞增殖,并促進成纖維細胞向肌成纖維細胞轉變,這一作用是通過抑制let-7d來實現的。結論 Lin-28B通過抑制let-7d進而促進成纖維細胞增殖、分化,最終增加成纖維細胞膠原合成,誘發肺纖維化的發生,Lin28B可能作為肺纖維化的治療新靶點。
肺纖維化;Lin28B;let-7d;MRC-5細胞;肌成纖維細胞;細胞增殖
特發性肺纖維化(idiopathic pulmonary fibrosis, IPF) 是一種病因不明、發病機制不清的致死性彌漫性肺間質疾病,IPF是間質性肺炎中發病率最高、最常見、預后最差的疾病,其5年生存率不超過50%,嚴重危害著人類健康[1]。因此,探索其發病機制,尋找新的治療靶點是目前本領域研究的熱點難點問題。
微小核苷酸(microRNAs, miRNAs)是一類長度約19~22個堿基的非編碼RNA分子,其可通過作用于目的基因的3′-非編碼區(3′-untranslated region,3′-UTR)進而抑制目的基因翻譯或直接使其降解[2]。已有研究證實,多個miRNAs參與肺纖維化的發生、發展過程。Let-7d是第一個被證實參與肺纖維化發生的miRNA[3],研究表明,let-7d可通過調控肺泡上皮細胞和肺成纖維細胞,進而抑制肺纖維化的發生,但是其上游調控機制尚不清楚。
RNA結合蛋白Lin28B可通過抑制let-7進而發揮促腫瘤作用[4]。本課題組以往研究發現,Lin28B可通過抑制let-7d,誘導肺泡上皮細胞轉變為肌成纖維細胞,進而增加細胞膠原合成,誘發肺纖維化的發生[5]。但其對成纖維細胞的作用尚未闡明。本研究旨在研究Lin28B/let-7d對成纖維細胞的作用,并探討其分子機制,以期為肺纖維化的治療及藥物研發提供新靶點。
1 材料與方法
1.1 材料
1.1.1 細胞株 人胚肺成纖維細胞(MRC-5細胞)購自中國科學院典型培養物保藏委員會細胞庫。
1.1.2 試劑 博來霉素(bleomycin, BLM)購自Merck Millipore公司;血管緊張素Ⅱ(AngⅡ)、噻唑藍(MTT)購自Sigma公司;Lin28B-TAT購自Pepro Tech公司;實驗所用抗體(Lin28B、α-SMA)均購自Abcam公司;DMEM、胎牛血清(FBS)、0.25%胰酶購自Gibco公司;let-7d及陰性對照序列(NC)購自上海吉瑪制藥技術有限公司;Lipofectamine 2000購自Invitrogen公司;蛋白提取及免疫印跡試劑購自北京碧云天生物技術研究所;RNA提取及定量PCR所需試劑購自美國Applied Biosystems公司;Edu細胞增殖試劑盒購自廣州市銳博生物科技有限公司。
1.1.3 儀器 熒光顯微鏡購自Olympus公司;酶標儀購自Tecan公司;電泳儀/轉膜儀購自Bio-Rad公司;Odyssey雙色紅外激光成像系統購自LICOR公司;qRT-PCR儀購自Applied Biosystems公司。
1.2 方法
1.2.1 肺纖維化小鼠模型構建 健康8周齡C57BL/6小鼠(購自北京維通利華實驗動物技術有限公司),用1%戊巴比妥鈉(40 mg·kg-1)腹腔注射麻醉,將小鼠仰位固定于鼠板,75%酒精消毒后,暴露氣管。將小鼠隨機分為2組:注射生理鹽水組(Saline)及注射博來霉素組(BLM),將BLM或Saline注射于小鼠氣管內,按5 mg·kg-1體質量或50 μL·30 g-1體質量。28 d后形成肺纖維化模型。
1.2.2 細胞培養 MRC-5細胞于含10% FBS的DMEM培養液中,置于5% CO2培養箱中培養,實驗時,接種細胞密度為2.0×108·L-1,細胞于培養板內貼壁后,給予1 μmol·L-1Ang Ⅱ或20 μg·L-1的Lin28B-TAT處理,同時,按照Lipo2000說明書轉染let-7d及NC,48 h后進行后續實驗。
1.2.3 Western blot 將組織或細胞加入裂解液裂解,超聲破碎,離心,取上清, BCA 法進行蛋白定量。將60 μg蛋白與5×上樣緩沖液混合均勻,100℃樣品變性5 min,快速置冰上1 min。電泳后70 V恒壓轉膜110 min。室溫封閉2 h,PBS 洗去封閉液,一抗4 ℃過夜,然后用紅外熒光標記二抗避光孵育1 h,以上過程均需避光。
1.2.4 qRT-PCR 使用TRIzol法提取細胞總RNA,并用隨機引物逆轉錄為cDNA,根據Applied Biosystems的擴增試劑盒進行定量PCR檢測,目的基因量=2-△△CT計算目的基因相對含量。
1.2.5 細胞增殖活力檢測 將MRC-5細胞接種于96孔培養板中,體系為180 μL,加入不同處理因素,培養48 h后,每孔加入20 μL 5 g·L-1的MTT溶液,充分混勻后繼續培養4 h,棄去上清,每孔加入150 μL DMSO,震蕩使沉淀充分溶解,酶標儀測各孔吸光度值。
1.2.6 EdU染色法檢測細胞增殖 將MRC-5細胞接種于蓋玻片上,于12孔板內培養,經過不同因素處理48 h后,棄去培養液,按照試劑盒說明書進行染色,最后于熒光顯微鏡下觀察細胞。
1.2.7 細胞免疫熒光化學 將MRC-5細胞接種于蓋玻片上,于12孔板內培養,經過不同因素處理48 h后,棄去培養液,用PBS輕輕沖洗3遍,加500 μL 4%多聚甲醛,37℃、10 min固定細胞,棄去多聚甲醛,用0.1 mol·L-1PBS輕輕沖洗細胞3次;加入500 μL穿透液(1 mL PBS+4 μL Triton+0.01 g BSA),室溫孵育1 h,棄去穿透液,用PBS沖洗細胞3次,加入1 mL封閉用山羊血清,37 ℃,封閉1 h,回收山羊血清,用PBS洗細胞3次,加入α-SMA一抗,4 ℃過夜,次日用PBS洗細胞3次;加入熒光標記的二抗,室溫孵育1 h,回收二抗,用PBS洗細胞3次;加入DAPI染色細胞核,室溫染色5 min,PBS洗3次,于熒光顯微鏡下觀察細胞。
2 結果
2.1 Lin28B在肺纖維化中表達升高 為了明確Lin28B在肺纖維化中的作用,我們通過氣管注射BLM構建小鼠肺纖維化模型,4周后取材,通過qRT-PCR及Western blot檢測發現,與注射生理鹽水組小鼠相比,注射BLM組小鼠肺組織中Lin28B的mRNA和蛋白水平均明顯升高(Fig 1A、1B)。為進一步明確Lin28B在肺纖維化中的變化,我們使用血管緊張素Ⅱ(Ang Ⅱ)處理MRC-5細胞,如Fig 1C和1D所示,Ang Ⅱ處理48 h后,MRC-5細胞中Lin28B表達水平明顯增加。同時,使用TGF-β1處理MRC-5細胞后,Lin28B表達亦明顯升高(Fig 1E、1F)。以上結果提示,Lin28B可能參與肺纖維化的發生。
2.2 Lin28B通過抑制let-7d增加肺成纖維細胞膠原生成 為進一步明確Lin28B對肺纖維化的作用,我們使用Lin28B-TAT 處理MRC-5細胞,并轉染let-7d。如Fig 2所示,Lin28B能明顯增加MRC-5細胞中膠原合成,而過表達let-7d則可減輕Lin28B所誘導的膠原合成。Lin28B可能通過抑制let-7d,進而調控成纖維細胞功能,最終參與肺纖維化的發生。
2.3 Lin28B/let-7d環路促進成纖維細胞增殖 在肺纖維化的發生過程中,成纖維細胞的增殖和肌成纖維細胞的生成是造成細胞外基質異常沉積的直接原因。為了探究Lin28B/let-7d環路參與肺纖維化的細胞機制,我們首先檢測Lin28B/let-7d環路對肺成纖維細胞增殖的作用。結果如Fig 3所示,Lin28B可促進成纖維細胞增殖,而過表達let-7d則明顯抑制Lin28B誘導的細胞增殖,表明Lin28B/let-7d環路可通過促進成纖維細胞增殖,進而參與肺纖維化的發生。
2.4 Lin28B/let-7d環路誘導肌成纖維細胞生成 α-平滑肌肌動蛋白(alpha smooth muscle actin, α-SMA)被認為是肌成纖維細胞的標志性蛋白,我們通過α-SMA染色證實,Lin28B/let-7d環路可誘導肺成纖維細胞向肌成纖維細胞的轉換,進而促進肌成纖維細胞生成,誘導肺纖維化(Fig 4)。
3 討論
IPF的病理改變以肺泡上皮損傷、炎性細胞蓄積、成纖維細胞增殖以及細胞外基質的異常沉積為主要特征,這個過程最終引起肺彈性和肺泡表面積的喪失,進而導致氣體交換和肺功能的損害。肌成纖維細胞是誘發IPF的主要效應細胞,肌成纖維細胞同時具有成纖維細胞和平滑肌細胞的特點,并且大量合成、分泌細胞外基質[6]。肺部肌成纖維細胞有多種來源,包括成纖維細胞、上皮細胞、骨髓源性循環成纖維細胞等,其中上皮細胞和成纖維細胞被認為是肌成纖維細胞的主要來源[7]。因此,通過調控上皮細胞及成纖維細胞,干擾肌成纖維細胞的生成是治療IPF的重要方向
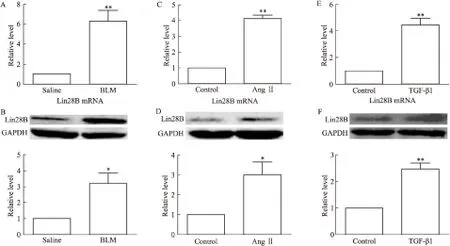
Fig 1 Lin28B incerased in lung fibrosis(n=5) qRT-PCR(A) and Western blot(B) detected the alteration of Lin28B in the lung of mice after treatment with BLM; C-D: Lin28B was up-regulated in MRC-5 cells treated by Ang Ⅱ; E-F: Lin28B was increased in MRC-5 cells treated by TGF-β1.*P<0.05,**P<0.01vssaline or control
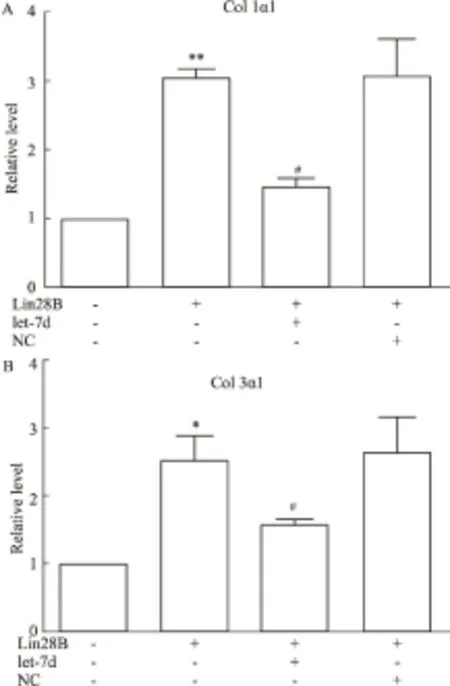
Fig 2 Lin28B promoted collagen synthesis in MRC-5 cells(n=4)
A: Lin28B increased the expression of collagen 1α1 at mRNA level; B: Lin28B increased the expression of collagen 3α1 at mRNA level.*P<0.05,**P<0.01vscontrol;#P<0.05vsLin28B
。
Let-7d是第一個被證實在IPF中發揮調節作用的miRNA。Pandit等[3]利用miRNA芯片技術分析了IPF患者和正常肺組織,發現IPF患者肺組織中包括let-7d在內的18個miRNAs表達明顯下調。在體外實驗中,肺泡上皮細胞A549經TGF-β1刺激后,let-7d表達量減少,而HMGA2表達量增加,進一步研究證實TGF-β1通過Smad3與let-7d啟動子結合,抑制let-7d表達。同時,特異性抑制小鼠肺組織中let-7d可誘導上皮間質轉化,使肺泡壁增厚,最終導致肺纖維化。此外,研究還發現,let-7d可以通過影響肺成纖維細胞的形態及功能,進而調控肺纖維化的發生[8]。然而,關于let-7d的上游調控機制尚不清楚。
Lin28是一種高度保守的RNA結合蛋白,其包括2個同源基因,Lin28A和Lin28B。研究顯示,Lin28可以抑制let-7的成熟過程,而let-7亦可以通過結合在Lin28的3′-非編碼區,進而抑制Lin28表達[9]。已有研究證實,Lin28/let-7d反饋環路參與多種病理生理學過程,包括胚胎發育、干細胞功能的調節及腫瘤的發生[4,10-12]。Zhang等[10]研究表明,過表達Lin28A或者Lin28B可以增強NANOG、OCT4及SOX2誘導多能干細胞的重編程效率。Albino等[4]研究發現,Lin28通過下調let-7進而促進腫瘤干細胞的生成及前列腺癌的發生。
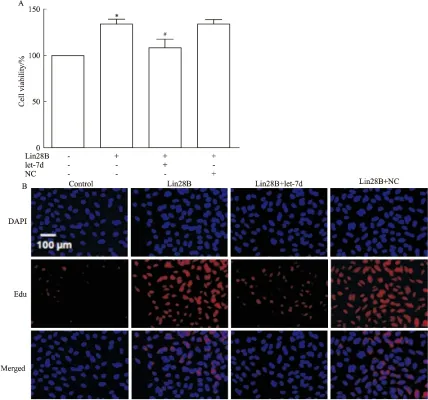
Fig 3 Lin28B/let-7d axis induced fibrogenesis in MRC-5 cells (n=6)
A: Lin28B/let-7d axis increased cell viability in MRC-5 cells; B: Lin28B /let-7d axis promoted proliferation of MRC-5 cells.*P<0.05vscontrol;#P<0.05vsLin28B
然而,Lin28B/let-7d環路是否參與肺纖維化的發生?Lin28是否可以通過調控let-7d進而誘導肺纖維化?Lin28B是否可以作為肺纖維化的治療新靶點?目前均不清楚。我們前期研究發現,Lin28B在肺纖維化小鼠和IPF肺組織中表達明顯升高,同時,Lin28B通過抑制let-7d表達進而誘導上皮間質轉化和細胞纖維性變;反之,特異性敲除Lin28B可以減輕TGF-β1誘導的上皮間質轉化及肺纖維化[5]。
我們前期研究發現,miRNA-26a可通過轉錄后抑制HMGA2,從而抑制上皮間質轉化及EMT的發生[13]。此外,miR-21、miR-9等多個miRNAs均被證實參與肺纖維化的病理進程[14-15],且多個miRNAs參與肺泡上皮細胞和成纖維細胞功能的調控[16]。那么,這些miRNAs之間有何內在聯系?在近期的一項研究工作中,我們發現miR-26a可以通過靶向Lin28B增加let-7d表達水平,提示miR-26a與let-7d具有協同治療肺纖維化的作用[5]。在此基礎上,我們構建了肺纖維化中miRNAs-TF-miRNAs調控網絡,揭示了肺纖維化中miRNAs之間直接的相互調控關系。然而,不同miRNAs之間的確切調控關系,還有待我們進一步的探究和驗證。
那么,作為肺纖維化中肌成纖維細胞的另外一個重要來源,Lin28B是否可以通過調控let-7d影響肺成纖維細胞形態及功能,進而參與肺纖維化發生?
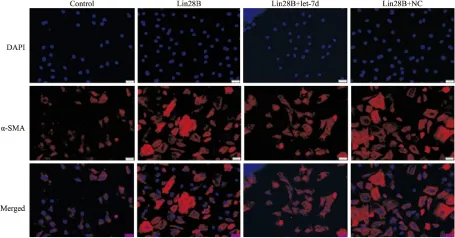
Fig 4 Lin28B /let-7d axis provoked fibroblasts-to-myofibroblasts transition
在本研究工作中,我們發現,Lin28B在發生纖維性變的肺成纖維細胞中表達明顯升高,同時證實,Lin28B通過抑制let-7d表達,進而誘導肺成纖維細胞增殖,并促進肺成纖維細胞向肌成纖維細胞轉變,最終促進膠原生成。結合之前的研究工作[5],我們推斷,靶向抑制Lin28B可能通過減輕上皮間質轉化及肺成纖維細胞形態改變,進而抑制肺纖維化的發生,Lin28B/let-7d反饋環路可作為肺纖維化的治療新靶點。
(致謝:本實驗在哈爾濱醫科大學藥學院藥理學教研室單宏麗課題組實驗室完成。)
[1] Daccord C, Maher T M. Recent advances in understanding idiopathic pulmonary fibrosis[J].F1000Res, 2016, 5.pii: F1000 Faculty Rev-1046.
[2] Ambros V. microRNAs: tiny regulators with great potential[J].Cell, 2001, 107(7):823-6.
[3] Pandit K V, Corcoran D, Yousef H, et al. Inhibition and role of let-7d in idiopathic pulmonary fibrosis[J].AmJRespirCritCareMed,2010,182(2):220-9.
[4] Albino D, Civenni G, Dallavalle C, et al. Activation of the Lin28/let-7 axis by loss of ESE3/EHF promotes a tumorigenic and stem-like phenotype in prostate cancer[J].CancerRes, 2016, 76(12):3629-43.
[5] Liang H, Liu S, Chen Y, et al. miR-26a suppresses EMT by disrupting the Lin28B/let-7d axis: potential cross-talks among miRNAs in IPF[J].JMolMed(Berl), 2016, 94(6):655-65.
[6] Liang H, Xu C, Pan Z, et al. The antifibrotic effects and mechanisms of microRNA-26a action in idiopathic pulmonary fibrosis[J].MolTher, 2014, 22(6):1122-33.
[7] Hinz B, Phan S H, Thannickal V J, et al. The myofibroblast: one function, multiple origins[J].AmJPathol, 2007, 170(6):1807-16.
[8] Huleihel L, Ben-Yehudah A, Milosevic J, et al. Let-7d microRNA affects mesenchymal phenotypic properties of lung fibroblasts[J].AmJPhysiolLungCellMolPhysiol, 2014, 306(6):L534-42.
[9] Desjardins A, Bouvette J, Legault P. Stepwise assembly of multiple Lin28 proteins on the terminal loop of let-7 miRNA precursors[J].NucleicAcidsRes, 2014, 42(7):4615-28.
[10]Zhang J, Ratanasirintrawoot S, Chandrasekaran S, et al. Lin28 regulates stem cell metabolism and conversion to primed pluripotency[J].CellStemCell, 2016, 19(1):66-80.
[11]McDaniel K, Hall C, Sato K, et al. Lin28 and let-7: roles and regulation in liver diseases[J].AmJPhysiolGastrointestLiverPhysiol, 2016, 310(10):G757-65.
[12]Takashima Y, Terada M, Udono M, et al. Suppression of lethal-7b and miR-125a/b maturation by Lin28b enables maintenance of stem cell properties in hepatoblasts[J].Hepatology, 2016, 64(1):245-60.
[13]Liang H, Gu Y, Li T, et al. Integrated analyses identify the involvement of microRNA-26a in epithelial-mesenchymal transition during idiopathic pulmonary fibrosis[J].CellDeathDis, 2014, 5:e1238.
[14]Fierro-Fernandez M, Busnadiego O, Sandoval P, et al. miR-9-5p suppresses pro-fibrogenic transformation of fibroblasts and prevents organ fibrosis by targeting NOX4 and TGFBR2[J].EMBORep, 2015, 16(10):1358-77.
[15]Liu G, Friggeri A, Yang Y, et al. miR-21 mediates fibrogenic activation of pulmonary fibroblasts and lung fibrosis[J].JExpMed, 2010, 207(8):1589-97.
[16]劉曉麗,王如峰,胡秀華. MicroRNAs在呼吸系統疾病預防和治療中的研究進展[J].中國藥理學通報,2015,31(7):895-9.
[16]Liu X L, Wang R F, Hu X H. Advanced study on microRNAs involved in prevention and treatment of respiratory system diseases[J].ChinPharmacolBull, 2015, 31(7):895-9.
Lin28B/let-7d axis contributes to pulmonary fibrosis by affecting mesenchymal phenotypic properties of lung fibroblasts
LIANG Hai-hai1, LI Tian-yu1, XIE Yan2, SHAN Hong-li1
(1.DeptofPharmacology,CollegeofPharmacy,HarbinMedicalUniversity,State-ProvinceKeyLaboratoriesofBiomedicine-PharmaceuticsofChina,KeyLaboratoryofCardiovascularResearch,MinistryofEducation,Harbin150081,China; 2.DeptofPhysiology,HarbinMedicalUniversity-Daqing,DaqingHelongjiang163319,China)
Aim To examine the role and uderlying mechanisms of Lin28/let-7d axis in the proliferation of lung fibrobalsts and fibroblasts-into-myfibroblasts transition, and provide novel strategy for the treatment of idiopathic pulmonary fibrosis(IPF). Methods We induced experimental lung fibrosis in mice by intratracheally injection of bleomycin(BLM). Ang Ⅱ and TGF-β1 were used to induce fibrogenesis in cultured MRC-5 cells;qRT-PCR and Western blot were applied to determine the changes of Lin28B, collagen 1α1 and collagen 3α1; MTT assay, Edu satining and immunofluoresence were used to examine the cell viability, proliferation and fibroblasts-into-myofibroblasts transition in MRC-5 cells. Results Lin28B was increased in the lung of mice with experimental lung fibrosis and in MRC-5 cells treated with AngⅡ or TGF-β1. Moreover, Lin28B enhanced collagen deposition via inhibiting expression of let-7d, which maybe contribute to the progression of IPF. In addition, further studies showed that Lin28B promoted proliferation and fibroblasts-into-myofibroblasts in MRC-5 cells. Conclusion Lin28B/let-7d axis contributes to fibrogenesis via promotes fibroblasts-into-myofibroblasts transition, which may provide novel approaches for lung fibrosis treatment.
pulmonary fibrosis; Lin28B; let-7d; MRC-5 cell; myofibroblasts; cell proliferation
時間:2017-1-13 11:38:00
http://www.cnki.net/kcms/detail/34.1086.R.20170113.1138.014.html
2016-09-15,
2016-10-25
黑龍江省教育廳科學技術研究資助項目(No 12541362)
梁海海(1984-),男,博士,副教授,研究方向:心肺系統藥理學,E-mail: lianghaihai@ems.hrbmu.edu.cn; 單宏麗(1972-),女,博士,教授,博士生導師,研究方向:心血管藥理學,通訊作者,E-mail: shanhongli@ems.hrbmu.edu.cn
10.3969/j.issn.1001-1978.2017.02.007
A
1001-1978(2017)02-0175-06
R-332;R322.35;R329.24;R563.1302.2

