光化學分離水溶液中鉑族金屬元素的研究>
——Pd(Ⅱ)的光還原
丁作銘,李富海,劉 哲,方 仲,林銘章,2,*
光化學分離水溶液中鉑族金屬元素的研究>
——Pd(Ⅱ)的光還原
丁作銘1,李富海1,劉 哲1,方 仲1,林銘章1,2,*
采用光化學法將Na2PdCl4水溶液中的二價鈀離子(Pd(Ⅱ))還原至鈀單質,通過改變照射光波長、自由基清除劑種類、Cl-濃度、pH值等參數以獲得光還原Pd(Ⅱ)的最佳條件。采用紫外-可見吸收光譜(UV-vis)和X射線光電子能譜(XPS)等表征手段分別對上清液和生成的沉淀進行表征。結果表明:使用光化學法能成功地還原出水溶液中的鈀離子,提取率可達98.4%;相比之下,采用異丙醇作為自由基清除劑時能更有效地提取溶液中的鈀元素。高濃度的Cl-抑制Pd(Ⅱ)的還原;適當提高pH值可以促進Pd(Ⅱ)的還原。此外,還驗證了從Na2PdCl4和NdCl3混合溶液中光還原并分離Pd(Ⅱ)的可行性。
Pd(Ⅱ);光還原;鉑族金屬;分離
為實現核能的可持續發展,我國決定對乏燃料進行后處理,以提高鈾和钚的利用率。后處理會產生大量的高放射性水平廢液(簡稱高放廢液,HLLW),高放廢液經玻璃固化后最終進入地質處置。高放廢液玻璃固化的熔制溫度不宜超過1 200 ℃,因為高溫不僅會導致玻璃固化工廠內設備腐蝕,還會導致放射性元素揮發等問題。然而,高放廢液中含有大量的如鈀(Pd)、釕(Ru)、銠(Rh)等鉑族元素[1],它們的熔點都超過了1 200 ℃,對于設備的運轉會產生不利的影響[2]。因此,為了使玻璃固化工廠能夠順利運轉,對于鉑族等元素的分離回收技術的開發尤為重要。另外,提取高放廢液中的鉑族金屬元素,能夠充分地利用資源,具有重要的經濟價值,同時還可以減輕環境負擔,符合循環經濟的要求[3]。
目前,從高放廢液中提取金屬元素主要依賴于離子交換分離及電化學分離等方法[4-5]。然而,離子交換法所用的離子交換樹脂,以及電化學分離法采用的電極,需要長時間浸泡在溶液中,容易產生次級廢物。相比之下,光化學法基本不引入其它化學物質或材料,只是采用傳統有機小分子作為自由基清除劑,可以解決這一問題。采用紫外或可見光照射含有金屬陽離子的溶液,在存在適當的自由基清除劑的條件下,隨著光照過程的持續,金屬離子的價態將會變低,直至還原成金屬原子。這些金屬原子或金屬原子與金屬離子一起,聚集生長成微小顆粒甚至沉淀,然后通過過濾或離心機分離就能夠達到回收的目的。相對于輻射法(γ射線或加速電子輻照),無論是紫外連續光源還是激光,設備簡單,操作簡易,工藝流程容易實現。此外,光化學法還具有較高的選擇性,可以通過控制反應參數(如照射光波長、陰離子、pH 值等)先后將不同的金屬離子各自還原成單質,從而實現多種金屬元素的分離回收。
盡管近年來各國也針對光還原金屬元素開展了諸多相關研究[6-10]。然而,這些研究大多是關于金屬離子價態變化的基礎研究[11],很少有針對金屬離子混合溶液的研究。本工作擬驗證Na2PdCl4水溶液在自由基清除劑存在的條件下被光還原的可行性,并探究照射光波長、自由基清除劑種類、Cl-濃度、 pH 值等參數對Pd(Ⅱ)光還原的影響,以探究最優光還原參數,為實現鉑族金屬元素的光還原及分離做準備。此外,還探究從鈀和釹離子的混合溶液中光還原并分離金屬鈀的可行性。
1 實驗部分
1.1 試劑和儀器
Na2PdCl4(相對分子質量為294.21)和NdCl3(相對分子質量為250.60),Aladdin公司;甲醇、乙醇、異丙醇、叔丁醇,化學純,國藥集團化學試劑有限公司;用于配制相關溶液的超純水由超純水器提供。
XPA系列光化學反應儀(自帶配套10 mL圓柱形石英試管),南京胥江機電廠;光源,10 W低壓汞燈(單波長254 nm),500 W汞燈(光譜分布和相對強度列入表1),南京胥江機電廠;Kertone Lab VIP系列超純水器,科爾頓(中國)水務有限公司;AR124CN型電子分析天平,感量為0.000 1 g,上海奧斯豪儀器有限公司;PHSJ-3F型實驗室pH計,分辨率為0.01,上海儀電科學儀器股份有限公司;HC-2518型高速離心機,安徽中科中佳科學儀器有限公司;Hetratherm Ovens OGH&OMH Series烘箱,美國Thermo Scientific公司;UV-2600紫外-可見分光光度計,島津(中國)有限公司;ESCALAB-250電子能譜儀,能量分辨率不大于0.45 eV,美國Thermo-VG Scientific公司。
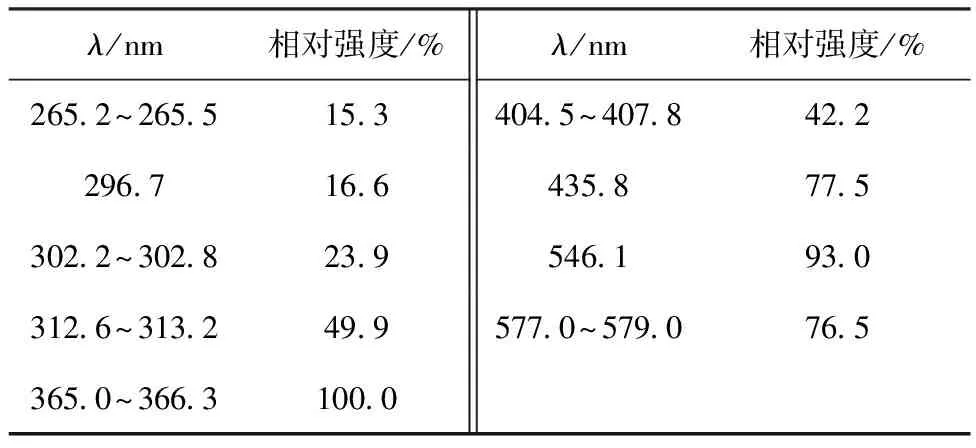
表1 500 W中壓汞燈的光譜分布和相對強度Table 1 Spectrum distribution and relative intensity of 500 W mercury lamp
1.2 實驗方法
將配好的Na2PdCl4反應液(配方見結果與討論)轉移至10 mL圓柱形石英管中,通氮氣10 min以除氧,封膜,將反應液置于距離汞燈光源7 cm處照射。照射過程中,反應液在試管中圍繞光源勻速旋轉,并均勻接受光照;通自來水冷卻光源和石英試管,溫度穩定在(25±3) ℃。照射一定時間后,用離心機將反應液中的上清液和沉淀分離。采用紫外-可見分光光度計測量上清液的吸收光譜。將收集到的沉淀物水洗3次,乙醇洗3次,分散在乙醇中,滴到硅片上,于烘箱中烘干,之后采用X射線光電子能譜(XPS)分析沉淀的組分和價態。
2 結果與討論
2.1 照射光波長對Pd(Ⅱ)還原的影響
采用異丙醇作為自由基清除劑,研究了波長為 254 nm和365 nm的紫外光以及500 W中壓汞燈(全波長)對Pd(Ⅱ)光還原效果的影響。其中, 254 nm的紫外光由10 W低壓汞燈提供,365 nm的紫外光由500 W汞燈配上365 nm的透光片(尺寸為42.5 mm×128 mm×1 mm,透光性能列入表2)提供。

表2 365 nm 透光片透光性能Table 2 Light transmittance of 365 nm translucent sheet
254 nm 紫外光、365 nm 紫外光和500 W中壓汞燈照射Na2PdCl4水溶液上清液UV-vis光譜隨照射時間的變化示于圖1。由圖1 可知,反應液照射前的UV-vis光譜在420 nm處和紫外區存在明顯的吸收峰,這些吸收峰均為Na2PdCl4水溶液的特征吸收峰。隨著照射時間的增加,以上吸收峰的吸光度均逐漸降低,說明上清液中的Pd(Ⅱ)含量逐漸降低。當反應進行2.5 h后,以上吸收峰的吸光度均趨近于0,說明此時上清液中的Pd(Ⅱ)濃度幾乎為0,即大部分的Pd(Ⅱ)都已被還原。
采用254 nm 處吸光度表征上清液中Pd(Ⅱ) 被還原的比率。根據Lambert-Beer 定律可知,溶液的吸光度A與溶液的濃度c、吸光系數ε以及液層厚度b成正比(式(1))。因此,對于單一溶劑體系,只需確定溶液某一波長吸光度的變化,即可確定溶液中溶劑濃度的變化率n(式(2))。通過計算可知,采用254 nm 紫外光照射反應液,光照2.5 h后溶液中Pd(Ⅱ) 被還原的比率為87.3%。
A=εbc
(1)
(2)
式中:c0,初始溶液中Na2PdCl4的濃度;cn,反應一段時間后溶液中Na2PdCl4的濃度;A0,初始溶液某一特定波長對應的吸光度;An,反應一段時間后溶液同一特定波長對應的吸光度。
由圖1(b)可知,當反應進行2.5 h后,420 nm處吸收峰峰值不變,說明此時溶液中的Pd(Ⅱ)幾乎未被還原。由圖1(c)可知,當反應進行1 h后,200~500 nm處光譜的吸光度均趨近于0,說明此時上清液中的Pd(Ⅱ)濃度幾乎為0,即大部分的Pd(Ⅱ)都已被還原。采用420 nm 處特征吸收峰的吸光度表征上清液中Pd(Ⅱ)被還原的比率,通過計算可知,采用中壓汞燈照射反應液,光照1 h后溶液中Pd(Ⅱ)被還原的比率為86.8%。與圖1 (a) 結果相比,采用中壓汞燈僅需 1 h即可還原等量的Pd(Ⅱ),因此可知采用500 W中壓汞燈為光源時,Pd(Ⅱ)的還原效率高于低壓汞燈。
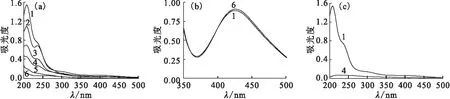
(a)、(c):c0(Na2PdCl4)=0.25 mmol/L;(b):c0(Na2PdCl4)=1.5 mmol/L照射時間,h:1——0,2——0.25,3——0.5,4——1,5——1.5,6——2.5圖1 254 nm 紫外光(a)、365 nm 紫外光(b)和500 W中壓汞燈(c)照射Na2PdCl4水溶液上清液UV-vis光譜隨照射時間的變化Fig.1 UV-vis absorption spectra of the supernatant of Na2PdCl4 aqueous solution exposed to 254 nm UV light(a), 365 nm UV light(b) and 500 W middle pressure mercury lamp(c)
由以上結論可知:254 nm的紫外光可將Na2PdCl4水溶液中的Pd(Ⅱ)還原,而365 nm的紫外光照射Na2PdCl4水溶液幾乎沒有還原效果,當用500 W中壓汞燈(全波長)為光源時,Pd(Ⅱ)的還原效率最高,因此后續的實驗中主要采用500 W汞燈做為光源。
2.2 自由基清除劑對Pd(Ⅱ)光還原的影響
采用500 W汞燈做光源,研究了自由基清除劑分別為0.5 mol/L甲醇、乙醇、異丙醇和叔丁醇的Na2PdCl4水溶液UV-vis光譜隨照射時間的變化,結果示于圖2。由圖2可知:當選擇乙醇和異丙醇作為自由基清除劑時,反應進行2.5 h后,上清液300~500 nm內吸光度趨近于0,表明大部分的Pd(Ⅱ)已被光還原;當選擇甲醇和叔丁醇作為自由基清除劑時,需光照7 h才能使上清液300~500 nm內吸光度趨近于0,表明選擇甲醇和叔丁醇作為自由基清除劑時,對Na2PdCl4光還原速率較低。
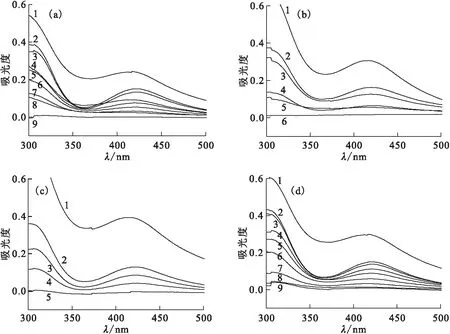
c0(Na2PdCl4)=1 mmol/L,自由基清除劑濃度為0.5 mol/L照射時間,h:1——0,2——0.25,3——0.5,4——1,5——1.5,6——2.5,7——3.5,8——5,9——7圖2 自由基清除劑分別為甲醇(a)、乙醇(b)、異丙醇(c)和叔丁醇(d)的Na2PdCl4水溶液上清液UV-vis光譜Fig.2 UV-vis absorption spectra of the supernatant of Na2PdCl4 aqueous solution in the presence of methanol(a),ethanol(b), 2-propanoland(c) and tertiary butanol(d) as a radical scavenger
采用420 nm 處吸收峰的吸光度表征上清液中Pd(Ⅱ) 被還原的比率。存在不同自由基清除劑Na2PdCl4水溶液420 nm 處吸光度差值隨時間(t)的變化結果示于圖3。從圖3可以看出,當甲醇、乙醇、異丙醇和叔丁醇分別作為Na2PdCl4水溶液體系的自由基清除劑時,光還原速率有如下關系式:異丙醇>乙醇>叔丁醇>甲醇。當照射時間為2.5 h時,溶液中Pd(Ⅱ) 被還原的比率分別為:異丙醇98.4%,乙醇94.4%,叔丁醇80.1%,甲醇77.6%。
一般認為,當醇作為金屬離子光還原反應的自由基清除劑時,溶液中的金屬離子會通過與醇的碰撞奪走一個α氫[12-13]。Matsushima等[13]測量了鈾酰-醇這一體系光解反應的Stern-Volmer常數Ksv。得到甲醇、乙醇、異丙醇和叔丁醇的Ksv分別為12、60、113、5 L/mol。這與α氫的C—H鍵的鍵能呈負相關,即α氫越容易脫去,反應速率越快。而叔丁醇沒有α氫,因而反應速率遠不如異丙醇。這一結論與本工作結果相符。
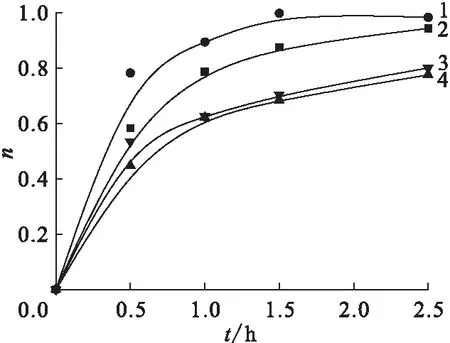
λ=420 nm 自由基清除劑:1——異丙醇,2——乙醇,3——叔丁醇,4——甲醇圖3 不同自由基清除劑 Na2PdCl4水溶液中Pd(Ⅱ)還原比率Fig. 3 Reduction ratio of Pd(Ⅱ) in the presence of different kind of radical scavengers in Na2PdCl4 aqueous solution
將反應中生成的黑色沉淀物收集起來,進行X射線光電子能譜(XPS)表征,其中電子結合能按照以表面污染C1s(284.6 eV)為標準進行能量校正。采用0.5 mol/L異丙醇作為自由基清除劑,紫外光照射Na2PdCl4水溶液后沉淀物的Pd 3d光電子能譜示于圖4(a)。Pd的可能成分有光還原的單質Pd、前驅體Na2PdCl4和Pd的水解產物(PdO)。以3d5/2電子為例,一般認為Pd、PdO、Na2PdCl4的3d5/2電子結合能分別為335.4[14]、336.1[15]、337.7 eV[15]。由圖4可知:XPS譜的主要峰位在335.4 eV附近,這說明沉淀物的主要成分是Pd,即反應液在500 W汞燈照射下,大部分Pd(Ⅱ) 被光還原為單質;337.7 eV附近單位時間內測得的光電子數目很低,這說明Na2PdCl4的含量很低,可以忽略不計;在336.1 eV附近還有一個弱峰,這說明沉淀物中還含有一定量的PdO,這可能是因為光照促進了Na2PdCl4水解的緣故。
為了得到沉淀物中Pd和PdO含量的相對百分比,需要對圖4(a)進行分峰擬合處理,圖4(b)給出了對Pd 3d5/2電子能譜的分峰擬合結果。分峰擬合時首先扣除Shirley本底,根據前面的分析,分出兩個峰,第一個峰在335.36 eV附近,對應Pd,第二個峰在336.25 eV附近,對應PdO,可以看出這兩個峰擬合后的合峰與原始數據符合的相當好。這兩個峰的峰面積之比就是Pd和PdO相對含量之比,比值為0.802∶0.198。
2.3 Cl-對Pd(Ⅱ)光還原的影響
采用500 W汞燈作為光源,0.5 mol/L異丙醇作為自由基清除劑,通過改變反應液中NaCl的濃度,研究了Cl-濃度對Pd (Ⅱ)光還原的影響。本實驗中c0(Na2PdCl4)=1 mmol/L,Cl-濃度分別為0、2、5、10、50 mmol/L。采用420 nm處吸收峰的吸光度表征不同照射時間內上清液中Pd(Ⅱ) 的濃度。不同Cl-濃度的Na2PdCl4水溶液中Pd(Ⅱ)還原比率隨時間的變化示于圖5。由圖5可知,隨著Cl-濃度增大,Pd(Ⅱ)的光還原效果開始下降,Cl-會抑制Pd(Ⅱ)的光還原。Pd(Ⅱ)有很強的配位能力,最多可與4個配體配位形成四面體配合物,其在水溶液中很容易與Cl-、H2O、OH-等配體配位。Na2PdCl4在水溶液中的存在形式為Pd(Ⅱ)氯水配合物,而Pd(Ⅱ)氯水配合物在水溶液中的化學種態十分復雜,往往隨氯離子濃度和酸度的不同而發生水合、氯代及水解,形成一系列氯水合、羥水合配合物[16]。高濃度的Cl-意味著Pd(Ⅱ)有更大的機會與Cl-配位,而Pd(Ⅱ)與異丙醇等自由基清除劑的配位就變得困難,這對還原不利。
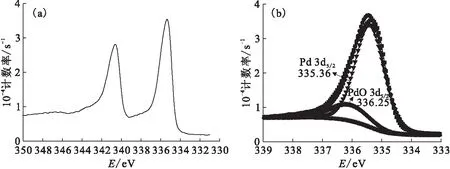
0.5 mol/L異丙醇為自由基清除劑,c0(Na2PdCl4)=1 mmol/L●——測試值,■——擬合值,▲——本底,▼—— 335.36 eV峰,◆—— 336.25 eV峰圖4 沉淀物的Pd 3d光電子能譜(a)和Pd 3d5/2光電子能譜分峰擬合結果(b)Fig.4 Pd 3d XPS spectra(a) of collected precipitation and XPS peak differentation imitating results of Pd 3d5/2 electron spectra(b)
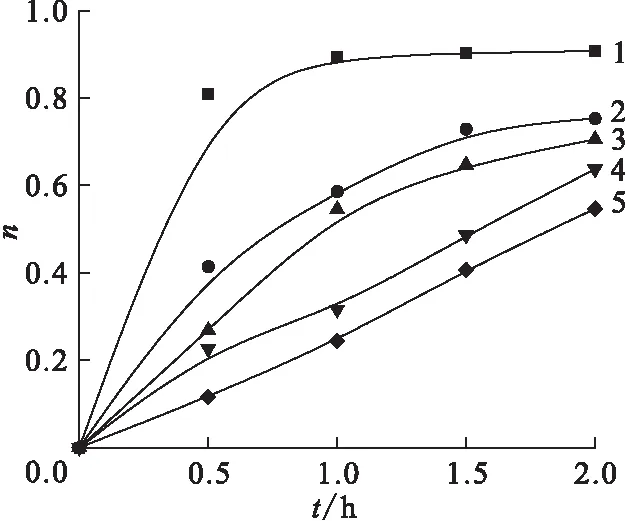
λ=420 nm c(Cl-),mmol/L:1——0,2——2,3——5,4——10,5——50圖5 不同Cl-濃度Na2PdCl4水溶液中Pd(Ⅱ) 還原比率Fig.5 Reduction ratio of Pd(Ⅱ) >with different concentration of Cl- in Na2PdCl4 aqueous solution
2.4 初始pH值對Pd(Ⅱ)光還原的影響
采用500 W汞燈作為光源,0.5 mol/L異丙醇作為自由基清除劑,通過向反應液中加入不同濃度的HClO4和NaOH來調節其pH值,研究了溶液初始pH值對Pd(Ⅱ)光還原的影響。本實驗的初始pH值分別為0.85、1.49、2.89、3.65、3.91(反應液中不加入任何HClO4和NaOH時,pH0=3.65)。pH0<4.00時,Na2PdCl4水溶液中Pd(Ⅱ)還原比率隨時間的變化示于圖6。由圖6可知:當pH0為0.85~3.91,pH0值越高,Pd(Ⅱ)的光還原程度越高;當溶液pH0=3.91時,反應進行2.0 h 后Pd(Ⅱ)的光還原率最高。然而,當溶液初始pH值調至4以上時,在沒有光照的條件下,溶液中的Pd(Ⅱ)即可迅速與OH-配位,發生水解反應,生成棕色沉淀。因該反應與本研究無關,故不予討論。
由以上結論可知,在初始pH<4時,提高pH值對Pd(Ⅱ)的光還原有利,反應最佳pH0=3.91。但隨著初始pH值的升高,溶液中的Pd(Ⅱ)會發生水解反應。因此,適當地調高pH值可促進Pd(Ⅱ)光還原反應的進行。
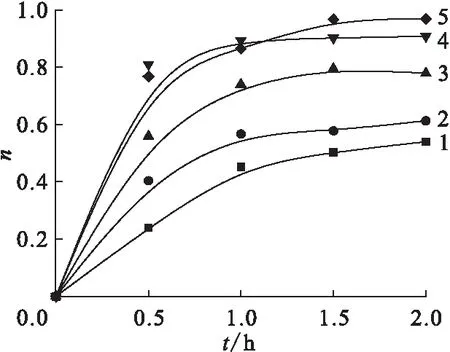
c0(Na2PdCl4)=1 mmol/L pH0:1——0.85,2——1.49,3——2.89, 4——3.65,5——3.91圖6 不同pH0值Na2PdCl4水溶液中Pd(Ⅱ) 還原比率Fig.6 Reduction ratio of Pd(Ⅱ) with different pH0 value in Na2PdCl4 aqueous solution
2.5 還原并分離鈀-釹離子混合溶液中Pd(Ⅱ)的可行性研究
近年來,水溶液中鑭系元素和其他金屬元素混合物的液-液萃取已被廣泛研究[14]。然而,利用光化學法分離并還原鉑族金屬和鑭系元素的研究卻鮮有報道。因此,探究了選擇性光還原Na2PdCl4-NdCl3混合溶液中Pd(Ⅱ)的可行性。將1 mmol/L Na2PdCl4與5 mmol/L NdCl3配制成混合溶液,采用0.5 mol/L異丙醇作為自由基清除劑,500 W汞燈照射反應液。實驗方法與之前所述相同。
Na2PdCl4-NdCl3混合溶液上清液的UV-vis吸收光譜隨照射時間的變化示于圖7。由圖7可知,NdCl3在紫外和可見光波段內呈現出多個吸收峰。分別采用794 nm和420 nm處的吸收峰值來表征上清液中Nd(Ⅲ)和Pd(Ⅱ)的濃度,其數值的變化示于圖8。由圖8可知,Pd(Ⅱ)的濃度隨著照射時間的增加而減少,而Nd(Ⅲ)的濃度幾乎保持不變。證明溶液中的Nd(Ⅲ)并未發生光化學反應。
采用X射線光電子能譜進一步確認還原產物,沉淀物的Pd 3d和Nd 3d光電子能譜結果示于圖9。由圖9(a)可知,335.4 eV和340.9 eV處的峰值為Pd 3d吸收峰,證明還原產物中存在鈀單質。Nd 3d峰應出現在980.4 eV和1 003.5 eV[17]處。然而,由圖9(b)可知,這兩個峰的強度很低,且Pd 3d和Nd 3d的原子百分比的比值為185∶1(初始比值為1∶5),證明沉淀中Nd單質的含量很低,可忽略不計。因此,采用光化學法可選擇性還原Na2PdCl4-NdCl3混合溶液中的Pd(Ⅱ),還原產物為鈀單質。
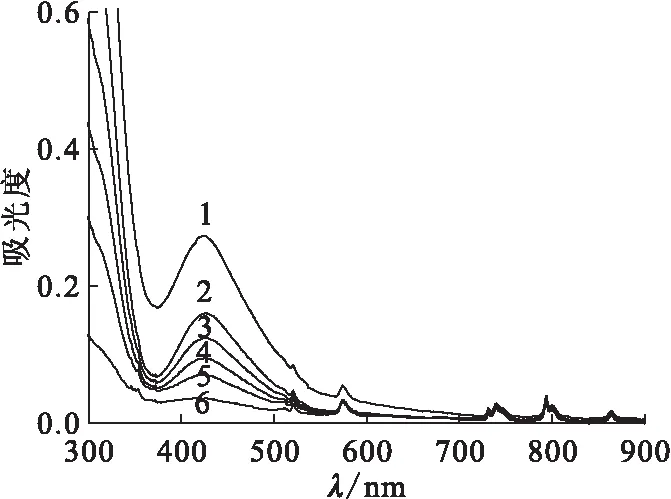
照射時間,h:1——0,2——0.5,3——1,4——1.5,5——2,6——2.5圖7 Na2PdCl4-NdCl3混合溶液上清液的UV-vis吸收光譜Fig.7 UV-vis absorption spectra of the supernatant of Na2PdCl4 mixed with NdCl3 aqueous solution
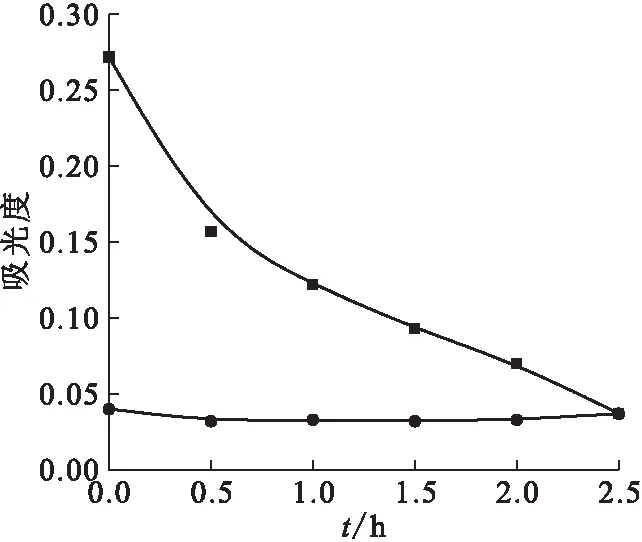
■——Pd(Ⅱ),●——Nd(Ⅲ)圖8 Nd(Ⅲ)特征吸收峰(794 nm)和Pd(Ⅱ)特征吸收峰(420 nm)處的吸光度隨時間的變化Fig.8 Absorbance variations at the characteristic absorption peaks of Nd(Ⅲ)(794 nm) and Pd(Ⅱ)(420 nm) as a function of time
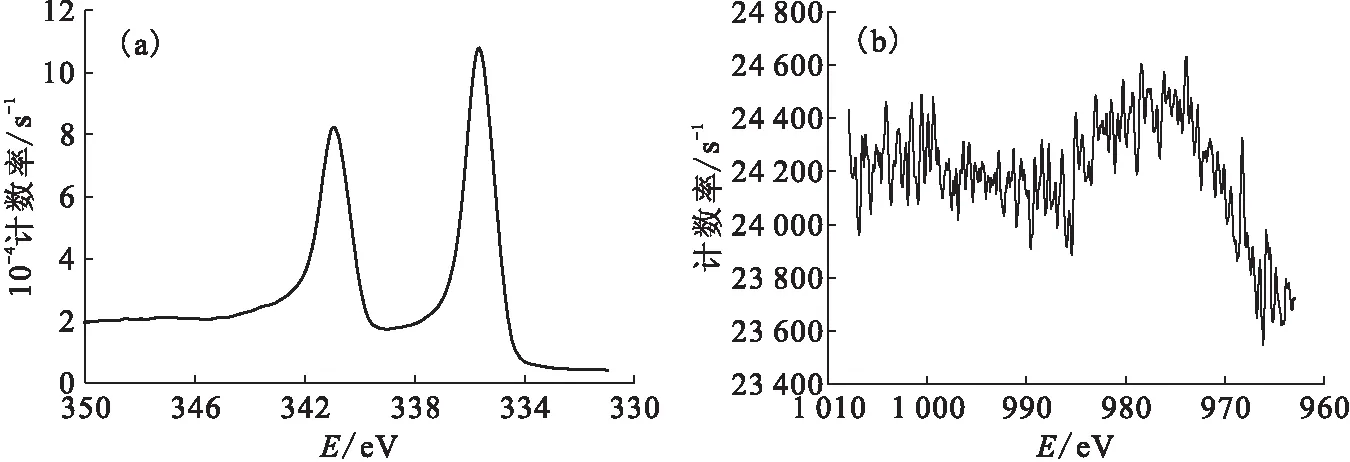
圖9 沉淀物的Pd 3d(a)和Nd 3d(b)光電子能譜Fig.9 XPS spectrum of Pd 3d(a) and Nd 3d(b) for the collected precipitation
3 結 論
驗證了Na2PdCl4溶液在自由基清除劑存在條件下被紫外光照射還原的可行性,并探究了照射光波長、自由基清除劑種類、Cl-濃度和pH值等不同實驗條件對光還原的影響。結果表明:異丙醇作為自由基清除劑時,Pd(Ⅱ)的還原效果最明顯;高濃度的Cl-會顯著抑制Pd(Ⅱ)的光還原;適當提高溶液的pH值對Pd(Ⅱ)的光還原有利,光還原Pd(Ⅱ)的最佳pH0=3.91。本實驗還成功還原并分離Na2PdCl4-NdCl3混合溶液中的Pd(Ⅱ)。本研究的實施,為高放廢液中鉑族金屬元素的提取提供了另一種途徑,為將來把光化學方法拓展到核燃料循環的其它過程打下了基礎,對發展我國核能事業,節省核燃料資源,減少環境污染,具有十分重要的意義。
[1] Bush R P. Recovery of platinum group metals from high level radioactive waste[J]. Platinum Metals Rev, 1991, 35: 202-208.

[3] Jensen G A, Platt A M, Mellinger G B, et al. Recovery of noble-metals from fission-products[J]. Nucl Technol, 1984, 65: 305-324.
[4] Suzuki T, Fujii Y, Koyama S, et al. Nuclide separation from spent nuclear fuels by using tertiary pyridine resin[J]. Prog Nucl Energy, 2008, 50: 456-461.
[5] Ozawa M, Suzuki S, Takeshita K. Advanced hydrometallurgical separation of actinides and rare metals in nuclear fuel cycle[J]. Solvent Extr Res Dev, Jpn, 2010, 17(9): 19-34.
[6] Sarkany A, Papp Z, Sajo I, et al. Unsupported Pd nanoparticles prepared by gamma-radiolysis of PdCl2[J]. Solid State Ionics, 2005, 176: 209-215.
[7] Harada M, Takahashi S. Synthesis of ruthenium particles by photoreduction in polymer solutions[J]. J Colloid Interface Sci, 2008, 325: 1-6.
[8] Harada M, Inada Y. In situ time-resolved XAFS studies of metal particle formation by photoreduction in polymer solutions[J]. Langmuir, 2009, 25: 6049-6061.
[9] Harada M, Tamura N, Takenaka M. Nucleation and growth of metal nanoparticles during photoreduction using in situ time-resolved SAXS analysis[J]. J Phys Chem C, 2011, 115: 14081-14092.
[10]Kusaba M, Tsunawaki Y, Nakashima N. Formation of Cd particles by UV laser irradiation[J]. Thin Solid Films, 2008, 517: 1500-1502.
[11]Nishida D, Kusaba M, Yatsuhashi T, et al. Reduction of Eu3+to Eu2+by an intense femtosecond laser pulse in solution[J]. Chem Phys Lett, 2008, 465: 238-240.
[12]Baird C P, Kemp T J. Luminescence, spectroscopy, lifetimes and quenching mechanisms of excited states of uranyl and other actinide ions[J]. Prog React Kinet, 1997, 22(2): 87-139.
[13]Matsushima R, Sakuraba S. Substituent effects on photochemical reaction rates of uranyl-alcohol system[J]. J Am Chem Soc, 1971, 13(21): 5421-5423.
[14]Barra T L. An ESCA study of termination of the passivation of elemental metals[J]. J Phys Chem, 1978, 82(16): 1801-1810.
[15]Briggs D, Seah M P, Bubert H. Practical surface analysis. Vol. 1: Auger and X-ray photoelectron spectroscopy[J]. Angew Chem Ger Ed, 1995, 107(11): 1367-1367.
[16]van Middlesworth J M, Wood S A. The stability of palladium(Ⅱ) hydroxide and hydroxy-chloride complexes: an experimental solubility study at 25-85 ℃ and 1 bar[J]. Geochim Cosmochim Acta, 1999, 63(11-12): 1751-1765.
[17]Ley L, Cardona M. Photoemission in solids Ⅱ: case studies[M]. Berlin: Springer-Verlag, 1979: 27.
1.中國科學技術大學 核科學技術學院,安徽 合肥 230027;2.中國科學院 核能安全技術研究所,安徽 合肥 230031
Photochemical Separation of Platinum Group Metals in Aqueous Solution ——Photoreduction of Pd(Ⅱ)
DING Zuo-ming1, LI Fu-hai1, LIU Zhe1, FANG Zhong1, LIN Ming-zhang1,2,*
1.University of Science and Technology of China, Hefei 230027, China;2.Institute of Nuclear Energy Safety Technology, Hefei 230031, China
In present work, the photochemical method was proposed to reduce Pd(Ⅱ) ions in Na2PdCl4aqueous solution, and the effects of various experimental parameters including the wavelength of light, radical scavengers, concentration of Cl-and pH values were studied. The supernatant and precipitation products have been characterized by the UV-vis spectra and XPS respectively. The results indicate that Pd(Ⅱ) ions in aqueous solution can be extracted by the photoreduction method by a ratio of 98.4%, and the generation of Pd atoms is more efficient in the presence of 2-propanol than ethanol, methanol or tertiary butanol. High concentration Cl-will suppress the reduction of Pd(Ⅱ), and high pH value can enhance the reduction of Pd(Ⅱ). In addition, the extraction of palladium metal from the mixed solution of Na2PdCl4and NdCl3was also demonstrated.
Pd(Ⅱ); photoreduction; platinum group metals; separation
2015-10-15;
2016-01-06;
時間:2017-01-03
國家自然科學基金資助項目(21377122)
丁作銘(1991—),女,安徽蕪湖人,碩士研究生,核科學與技術專業
*通信聯系人:林銘章(1965—),男,福建泉州人,博士生導師,從事輻射化學與放射化學研究,E-mail: gelin@ustc.edu.cn
O644.14
A
0253-9950(2017)01-0022-08
10.7538/hhx.2016.YX.2015082

