碘[131I]愛克妥昔單抗注射液免疫反應活性的分析方法
賈瑩瑩,崔海平,沈振芳,冉宇靚,王曉靜,*
碘[131I]愛克妥昔單抗注射液免疫反應活性的分析方法
賈瑩瑩1,崔海平1,沈振芳1,冉宇靚2,王曉靜1,*
研究建立了碘[131I]愛克妥昔單抗注射液免疫反應活性檢驗分析方法。用活細胞結合百分數(shù)法,對細胞選擇、反應時間、反應溫度和分離方法進行研究,并應用該方法分析愛克妥昔單抗注射液免疫活性的穩(wěn)定性及批間變異系數(shù)。結果表明:選擇CEA表達陽性的LS180活細胞,反應時間為16 h,反應溫度為4 ℃,分離方法為直接分離法。該方法批間變異系數(shù)小于10%,重復性好,可以用于分析碘[131I]愛克妥昔單抗注射液的免疫反應活性。
131I;單克隆抗體;免疫反應活性
單克隆抗體類藥物一般包括兩類[1-2]:(1) 抗腫瘤單抗,即未與藥物或放射性核素偶聯(lián)的裸抗體,包括抗體及其片段,具有兩種功能,一是與靶分子特異性結合的結合功能;二是殺傷腫瘤細胞的效應功能,即主要是通過依賴補體的細胞毒性和抗體依賴細胞介導的細胞毒作用兩種免疫機制實現(xiàn);(2) 抗腫瘤單抗偶聯(lián)物,或稱免疫偶聯(lián)物,它由單抗與“彈頭”兩部分構成,可用作“彈頭”的物質(zhì)主要有3類,放射性核素、藥物和毒素,與單抗連接分別構成放射免疫偶聯(lián)物、化學免疫偶聯(lián)物和免疫毒素;單克隆抗體與上述“彈頭”結合,可加強對腫瘤靶細胞的殺傷作用[3]。
碘[131I]標記的單克隆抗體注射液在治療肺癌、肝癌等惡性疾病的治療上有一定的療效[4-7],目前國內(nèi)碘標記單克隆抗體有利卡汀和唯美生。利卡汀是以HAb18 單克隆抗體的F(ab′)2片段為導向載體,將放射性核素131I有選擇性和針對性地帶到肝癌部位,利用其發(fā)出的β射線有效殺死癌細胞,但全身其它器官無放射性藥物的蓄積。唯美生又名為腫瘤壞死靶向治療單抗(tumor necrosis therapy),是一種特異性結合腫瘤壞死區(qū)細胞核從而導向治療實體瘤的新型單抗[8-10]。現(xiàn)針對癌胚抗原表達陽性的大腸癌開發(fā)出新的碘[131I]愛克妥昔單抗注射液,用含有高效表達的重組嵌合抗癌胚抗原(CEA)單克隆抗體基因的中國倉鼠卵巢(CHO)細胞[11],經(jīng)細胞培養(yǎng),高度純化并標記碘[131I]后加入適量人血白蛋白穩(wěn)定劑制成的放射性液體制劑,主要用于治療癌胚抗原表達陽性的大腸癌。其中免疫反應活性是碘[131I]愛克妥昔單抗注射液的質(zhì)量指標之一,因此對免疫反應活性分析方法進行研究十分必要。
目前標記抗體均采用一種細胞濃度(即單一的抗原濃度)來評價標記抗體的結合百分比,這種單一抗原濃度計算的結合百分比十分不穩(wěn)定,隨著細胞數(shù)量的誤差、細胞培養(yǎng)狀態(tài)導致的細胞表面抗原分子表達密度的不同、加入標記抗體濃度的不同或誤差,該法均能產(chǎn)生較大的誤差;并且單一濃度細胞法測定的并不是真正的免疫結合百分比例,它只保證了真正的免疫結合百分比例不低于所測定的值,因此不能詳細地了解標記抗體的實際結合活性。
本工作擬采用活的人腫瘤細胞最大程度地模擬標記抗體在病人體內(nèi)將要結合的靶細胞,采用低溫下反應避免活細胞的新陳代謝活動對抗原抗體結合的影響,同時采用過夜反應來使抗原抗體結合免疫反應充分到達平衡,保證所檢測結果的真實性,并且采用多個濃度的測定值外推,可以克服上述誤差大的缺點,并可以計算實際的免疫結合百分比。
1 實驗原理
采用活細胞結合百分數(shù)法[12]測量免疫反應活性。供試品標記抗體中保留有活性的抗體能與細胞表面的CEA分子結合,采用大大過量的CEA陽性的活細胞作為固相化抗原,在此反應體系中加入一定量的標記抗體孵育一定時間,這時大部分仍保持有活性的標記抗體應結合于細胞表面,通過洗滌除去未結合的以及喪失活性的標記抗體,最后計算殘留的放射劑量,并外推至抗原數(shù)量無窮大,即可獲得供試品碘[131I]標記抗體的免疫反應活性,并判斷供試品的免疫反應活性是否符合規(guī)定,具體計算方法如下式。
A=N/Ntot
其中:A,直接結合百分數(shù);N,特異性結合的計數(shù)率,min-1;Ntot,總計數(shù)率,min-1。
以Ntot/N為縱坐標,相應的細胞濃度(3.2×107、1.6×107、0.8×107、0.4×107、0.2×107/mL)的倒數(shù)為橫坐標,制作曲線圖,在EXCEL軟件中做直線擬合,外推至細胞濃度無窮大(x=0),求出此時的y值,計算供試品碘[131I]愛克妥昔單抗注射液的免疫反應活性=1/y×100%。測量的供試品免疫反應活性應不小于50%,以此判斷所測定供試品是否合格。
2 實驗方法
2.1 材料與儀器
碘[131I]愛克妥昔單抗注射液,由原子高科股份有限公司提供;CEA陽性的人結腸癌細胞LS180,細胞活度大于95%,購自美國ATCC(在血清培養(yǎng)狀態(tài)下測定)。
氯化鈉、氯化鉀、磷酸氫二鈉、磷酸二氫鉀,分析純(AR),國藥集團化學試劑有限公司;牛血清蛋白(BSA),AR,北京海天生物科技有限公司;乙二胺四乙酸(EDTA),常州海豐化工有限公司。
TDL-40B型離心機,上海安亭儀器廠; KK25V61T1型冰箱,海爾公司;WH-986型混漩儀,上海醫(yī)科大學儀器廠;GAMMA-C12 γ計數(shù)器,DPC公司。
2.2 細胞的選擇
CEA是一個有價值的腫瘤標志,有大量的相關抗原。CEA分子特征可以轉化到不同來源的細胞,如黑色素瘤、結腸腺癌、神經(jīng)母細胞瘤、肺癌、乳腺癌、胰腺癌、白血病與前列腺腫瘤的抗原,這種僅限于在腫瘤細胞膜表達的分子特征,可用于鑒別人腫瘤細胞、正常胚胎和成人組織交叉反應[13]。故只有細胞膜表面的CEA分子的結合才是與治療效果相關的有效結合,選用CEA表達陽性的活細胞作為模擬腫瘤宿主細胞與單抗注射液反應。LS180不僅是結腸癌細胞,而且在細胞膜表面高表達靶抗原CEA,其表達強度在目前已知的結腸癌細胞中幾乎是最高的幾種細胞系之一,符合免疫結合活性測定的細胞的要求,且較LS174T細胞更易培養(yǎng),操作時實用性較強。
細胞準備:取約1.7×108個活細胞,用PBS洗滌細胞2次,再用適量EDTA的消化液消化細胞,然后加入適量含血清的完全培養(yǎng)基終止消化,吹散成單個細胞狀態(tài),采用臺盼藍染色法計數(shù)細胞數(shù)量和活度。1 000 g離心5 min收獲細胞,再用40 mL不含血清的培養(yǎng)基重懸細胞至每毫升3.52×107個細胞。
2.3 反應時間的選擇
由于其他單抗注射液的測定免疫反應活性時細胞濃度單一化,免疫反應活性不夠精確,故設定梯度細胞濃度分別與標記抗體在4 ℃反應,反應時間設為1、2、4、8、16、20 h。
2.4 反應溫度的選擇
確定了細胞濃度外推法和最佳反應時間以后,設定不同的反應溫度4 ℃與37 ℃,觀察免疫反應活性的改變。
2.5 分離方法的選擇
分別用直接離心法、葡聚糖凝膠層析法[14](尖底)、葡聚糖凝膠層析法(圓底)進行洗脫,測定計數(shù)率,確定合適的分離方法。
3 結果和討論
3.1 方法學建立
3.1.1 反應時間的確定 不同濃度細胞分別與標記抗體在4 ℃反應,設定不同反應時間,得到的放射性檢測結果列入表1。由表1可知:隨著細胞濃度降低,Ntot/N逐漸增加,但在1、2、4、8 h時,Ntot/N增加幅度過大,無法求出當細胞濃度無限大時的Ntot/N值。反應16 h和20 h細胞濃度的倒數(shù)對直接結合百分數(shù)倒數(shù)的線性擬合圖示于圖1。由圖1可知:16 h和20 h細胞免疫反應活性分別約為75%和79%,均達到合格標準;當反應時間達到16 h以上時,才可能將抗原數(shù)量外推至無窮大,獲得穩(wěn)定的免疫反應活性。因此本實驗選擇16 h作為反應時間。

表1 不同反應時間的計數(shù)率Table 1 Counting rate of different reaction time
注:t=4 ℃;A-1=Ntot/N=總計數(shù)率/(各組細胞濃度計數(shù)率-本底對照計數(shù)率)(下同);括號內(nèi)數(shù)據(jù)為總計數(shù)率

圖1 反應16 h(a)和20 h(b)細胞濃度的倒數(shù)對直接結合百分數(shù)倒數(shù)的線性擬合圖Fig.1 Reciprocal cell concentration-combined with the reciprocal of the percentage chart reacting for 16 h(a) and 20 h(b)
3.1.2 反應溫度的確定 4 ℃與37 ℃各細胞濃度的計數(shù)率比較列入表2。由表2可知,在37 ℃下各個細胞濃度的計數(shù)率均低于4 ℃下各個細胞濃度的值,同時由于在37 ℃時,LS180活細胞會不斷分泌出可溶性CEA分子,很難控制反應時的抗原濃度,故選擇較短的時間進行免疫反應。由表2還可知,37 ℃下免疫反應不充分,所以選擇4 ℃作為反應溫度。細胞濃度的倒數(shù)對直接結合百分數(shù)倒數(shù)的線性擬合示于圖2。由圖2可知,在4 ℃反應16 h,細胞免疫反應活性約為76%,達到合格標準。
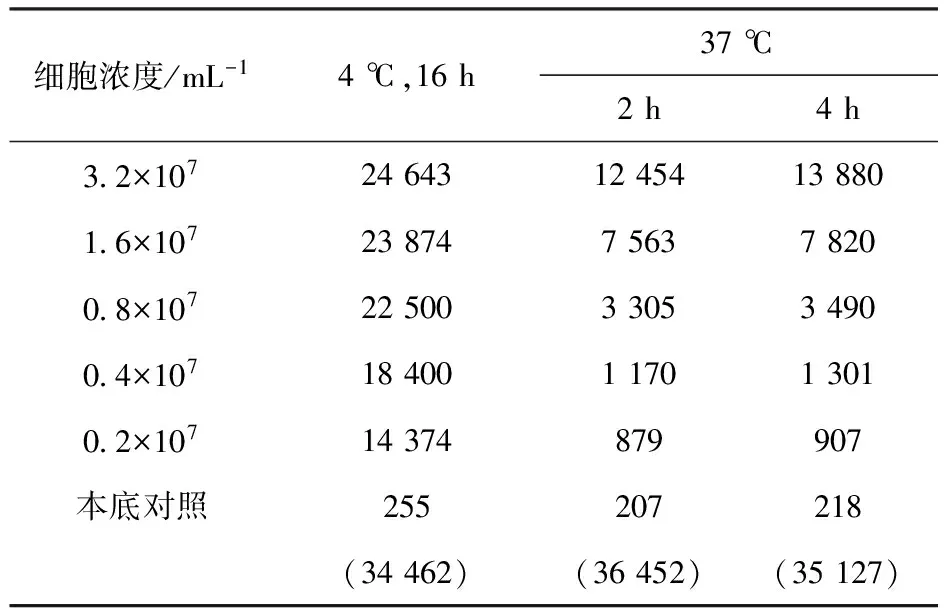
表2 4 ℃與37 ℃各細胞濃度的計數(shù)率Table 2 Counting rate of each cell concentration at 4 ℃ and 37 ℃ min-1
注:括號內(nèi)數(shù)據(jù)為總計數(shù)率
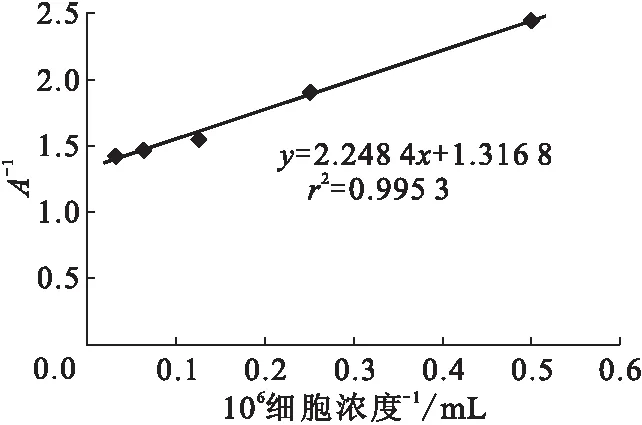
4 ℃反應16 h圖2 細胞濃度的倒數(shù)對直接結合百分數(shù)倒數(shù)的線性擬合圖Fig.2 Reciprocal cell concentration-combined with the reciprocal of the percentage chart
3.1.3 分離方法的確定 將直接離心法、葡聚糖凝膠層析法[14](尖底)、葡聚糖凝膠層析法(圓底)測定的放射性計數(shù)率列入表3。由表3可知,直接離心法與凝膠柱法(圓底)測得的數(shù)據(jù)比較準確。但由于凝膠柱法(圓底)需要剪掉底部軟管,容易造成未結合抗體回流至柱芯,得到的放射性計數(shù)率不能準確表示免疫反應活性;而直接離心法更加簡單、快速,易于操作,故選擇直接離心法。

表3 不同分離方法測定的計數(shù)率Table 3 Counting rate of different separation methods min-1
3.2 方法學驗證
本實驗建立碘[131I]愛克妥昔單抗注射液免疫反應活性檢測方法后,共做三批樣品發(fā)貨的免疫反應活性分析,而后每天取出一件-20 ℃冷凍保存的碘[131I]愛克妥昔單抗注射液進行48、72、96 h檢測,共計12次,實驗結果列入表4。由表4可知,三批樣品直接結合百分數(shù)的標準偏差(s)最大為5.017%,批間變異系數(shù)(CV)最大為7.81%,反應了本方法檢測碘[131I]愛克妥昔單抗注射液免疫反應活性有較高的精密度,隨機誤差相對小,這是一種準確性高的測定方法。
3.3 碘[131I]愛克妥昔單抗注射液免疫反應活性的質(zhì)量穩(wěn)定性
由表4中三批數(shù)據(jù)繪制成免疫反應活性變化曲線示于圖3。由圖3可知,碘[131I]愛克妥昔單抗注射液在5 d內(nèi)直接結合百分數(shù)隨時間的推移而逐漸降低,免疫反應活性均大于50%,達到實驗要求。
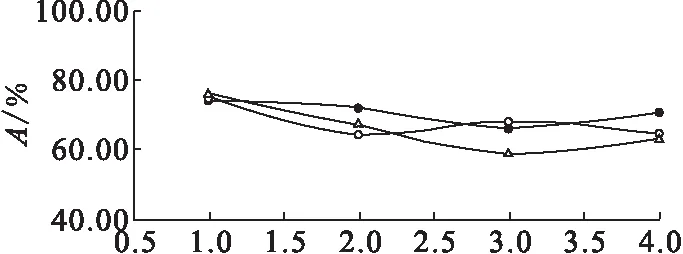
●——樣品1,○——樣品2,△——樣品3圖3 免疫反應活性變化曲線圖Fig.3 Immune activity change curves
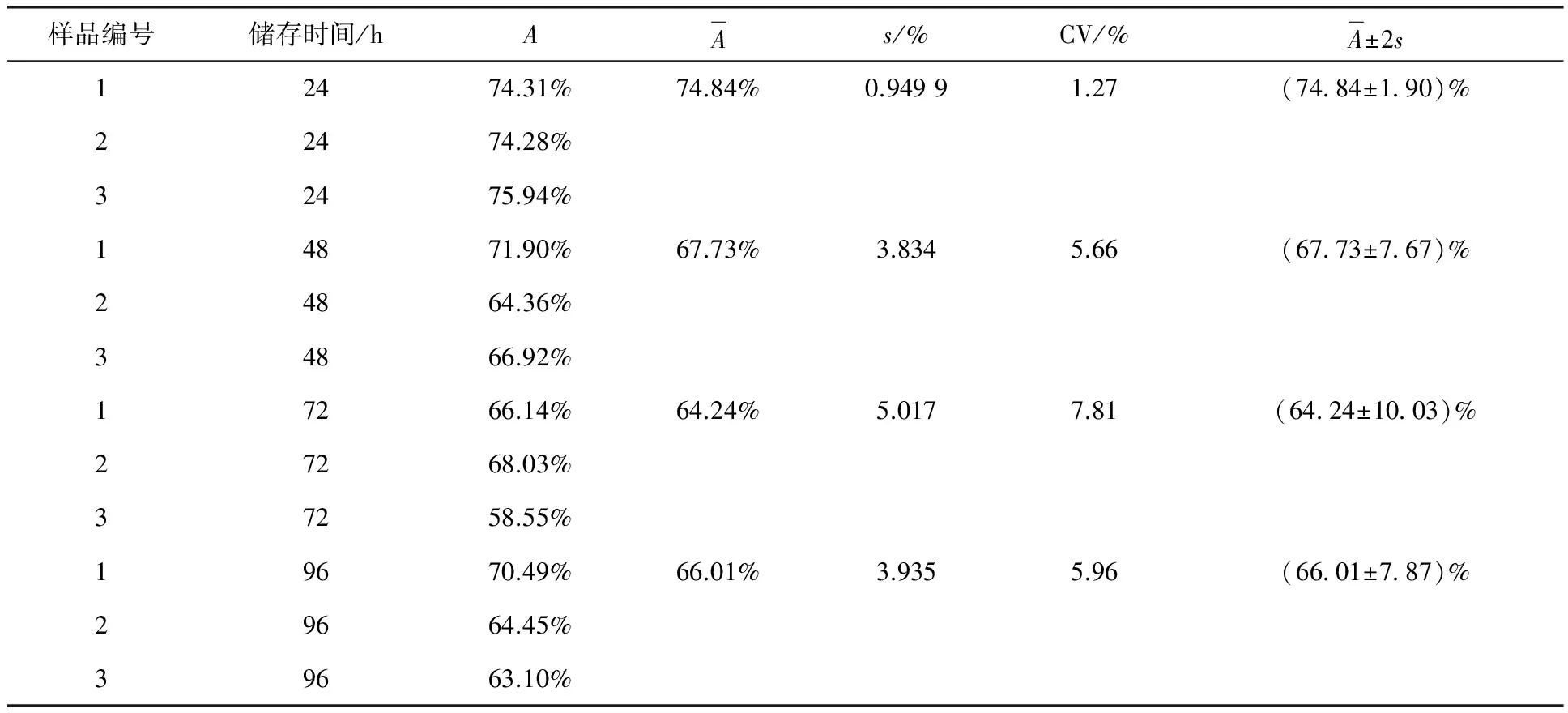
樣品編號儲存時間/hAAs/%CV/%A±2s12474.31%74.84%0.94991.27(74 84±1 90)%22474.28%32475.94%14871.90%67.73%3.8345.66(67 73±7 67)%24864.36%34866.92%17266.14%64.24%5.0177.81(64 24±10 03)%27268.03%37258.55%19670.49%66.01%3.9355.96(66 01±7 87)%29664.45%39663.10%
4 結 論
通過采用活細胞結合百分數(shù)法,選擇CEA表達陽性的LS180活細胞,反應時間為16 h,反應溫度為4 ℃,分離方法為直接分離法,該方法批間變異系數(shù)小于10%,能夠較準確地測出愛克妥昔單抗注射液的免疫反應活性,提高了檢測的準確性。
[1] Admas G P, Weiner L M. Monoclonal antibody therapy of cancer[J]. Nat Biothechnol, 2005, 23(9): 1147-1157.
[2] 甄永蘇.抗腫瘤抗生素與癌癥靶向治療[J].中國抗生素雜志,2006,31(2):65-68.
[3] 張浩然.131I-chTNT靶向治療分化型甲狀腺癌肺轉移瘤的臨床應用研究[D].吉林:吉林大學中日聯(lián)誼醫(yī)院,2010.
[4] 于華,柳炳吉,鄭飛波,等.131I-chTNT治療惡性腫瘤并發(fā)骨轉移瘤的初步研究[J].青島大學醫(yī)學院學報,2012,48(5):416-417.
[5] 劉雪輝,譚建.131I-chTNT放射免疫治療晚期肺癌的研究進展[J].生物醫(yī)學工程與臨床,2008,12(2):159-162.
[6] 譚艷,肖恩華.利卡汀治療原發(fā)性肝細胞癌的最新進展[J].中南藥學,2008,6(5):632-634.
[7] 杜陽峰,羅榮城,李貴平,等.抗乙型肝炎表面抗原Fab片段聯(lián)合抗細胞核單抗為載體的肝癌放射免疫治療實驗研究[J].南方醫(yī)科大學學報,2008,28(3):460-462.
[8] Sun L Q, Vogel C A, Milimanoff R O, et al. Timing effects of combine radioimmunotherapy and radiotherapy on a human solid tumor in nude mice[J]. Cancer Res, 1997, 57(7): 1312-1319.
[9] 陳紹亮,孫小光,修雁,等.131I-chTNT在荷人肝癌裸鼠動物模型中的定位研究[J].中華核醫(yī)學雜志,1998,18:215-217.
[10]Epstein A L, Chen F M, Taylor C R. A novel method for the detection of necrotic lesions in human cancers[J]. Cancer Res, 1988, 48(20): 5842-5848.
[11]羅先富,章斌,馬鴻冰,等.抗人CD40mAb5H6的125I標記及其卵巢癌細胞株HO8910體外結合的生物學特性[J].細胞與分子免疫學雜志,2008,24(6):591-593.
[12]許元生,熊東生,范冬梅,等.125I標記抗CD20HI47F(ab′)2性質(zhì)研究[J].放射免疫學雜志,2004,17(3):161-162.
[13]吳敏,臧仁杰,唐思倫.抗癌胚抗原單克隆抗體-抗原表位分析及其它應用[J].國外醫(yī)學分子生物學分冊,1987,9:201-205.
[14]馮強,米力,邊惠潔,等.131I-肝癌單抗片段HAb18F(ab′)2注射液藥盒的制備[J].同位素,2002,15(3):137-140.
1.原子高科股份有限公司,北京 102413;2.中國醫(yī)學科學院 北京協(xié)和醫(yī)學院 腫瘤醫(yī)院 分子腫瘤學國家重點實驗室,北京 100021
New Method to Inspection Immune Activity of Iodine[131I] Aiketuoxi Monoclonal Antibody Injection
JIA Ying-ying1, CUI Hai-ping1, SHEN Zhen-fang1, RAN Yu-liang2, WANG Xiao-jing1,*
1.Atom-Hitech Company, Beijing 102413, China;2.State Key Laboratory of Molecular Oncology, Cancer Hospital, Chinese Academy of Medical Sciences(CAMS)&Peking Union Medical College, Beijing 100021, China
A method for identifying the immuneactivity of iodine [131I]aiketuoxi monoclonal antibody injection was developed. The paper reported the method of percentage of living cells. Cell selection, the effect of temperature, time and separation method were studied, and as well as the stability of the product and the coefficient of variation were analysed by the method. The cell line was CEA expression positive LS180 cell, reaction time was 16 h, reaction temperature was 4 ℃, and it used a direct separation method. The variation coefficient of the method was less than 10%. The method has good reproducibility and can be used for analysis the immuneactivity of iodine [131I]aiketuoxi monoclonal antibody injection.
131I; monoclonal antibody; immunoreactivity
2015-11-16;
2016-01-15;
時間:2017-01-03
賈瑩瑩(1984—),女,安徽含山人,碩士,工程師,放射性同位素技術專業(yè)
*通信聯(lián)系人:王曉靜(1970—),女,遼寧錦州人,研究員,主要從事放射性藥物研究工作,E-mail: wangxj70@163.com
R811
A
0253-9950(2017)01-0121-05
10.7538/hhx.2016.YX.2015100

