我國基本藥物循證遴選評價指標體系的構建
楊 涵 肖 潔 胡 明
四川大學華西藥學院 四川成都 610041
我國自2009年正式建立國家基本藥物制度以來,先后公布2009、2012年版國家基本藥物目錄(NEML),并提出根據循證醫學、藥物經濟學對納入遴選范圍的藥品進行技術評價和目錄調整。[1]但由于基本藥物目錄的制定和調整考慮多方面的因素,且涉及多個部門,部門之間合作較為松散,導致我國基本藥物目錄的更新速度較慢,缺乏時效性。目前我國基本藥物目錄的遴選方法主要依靠專家經驗,評價結果缺乏有力的證據支持,且部分納入基本藥物目錄的品種在醫療機構中的適用性較差。此外,基本藥物調入調出的原因及相關信息還未做到公開透明,專家信息的非公開化導致對專家的監督力度不夠,使得公眾對基本藥物目錄遴選程序的權威性產生質疑。以上遴選過程出現的問題中,評價指標和方法的不完善是根本的問題。
WHO示范目錄遴選程序和標準為國際上基本藥物遴選管理提供了成熟的思路和方法,WHO在遴選基本藥物過程中探索引入循證思路,強調考慮疾病負擔、公共衛生相關性、藥品質量、有效性、安全性和比較成本—效果的科學證據。[2]另外南非、泰國基于ISafE和分級的評估、制定與評價方法的評估指標等也為基本藥物遴選評價提供了參考。[3]近年我國學者開展了一系列關于基本藥物遴選的研究,這些研究總體思路參考WHO、泰國或其他國家地區的方法,引入循證醫學和藥物經濟學的理念;建立的評價指標或模型雖然各不相同但總體以藥物有效、安全、經濟為中心;對于指標的量化方法大多選用專家咨詢法。可以看出我國基本藥物的遴選正在努力與國際接軌,在評價方法中引入循證方法是主要趨勢。因此,借鑒WHO-EML(WHO-Essential Medicine List)的遴選方法,結合我國實際國情,采用循證的理念探索適用于我國的基本藥物遴選評價指標及方法,為完善我國基本藥物遴選機制提供較具現實意義的參考。
1 研究方法
1.1 文獻研究
檢索WHO官方網站,對WHO-EML遴選的程序和要求進行梳理,提煉出本研究可以參考的內容;以“基本藥物目錄、遴選”等中文關鍵詞檢索CNKI、CBM、VIP、萬方等中文數據庫,收集整理國內研究基本藥物遴選程序與方法的文獻。在此基礎上初步構建基本藥物遴選評價指標。
1.2 專家咨詢調查和層次分析法
采用專家咨詢法,對初步構建的基本藥物遴選評價指標進行論證和調整。采用層次分析法,通過調查問卷的形式請專家打分。由專家對指標所構建的判斷矩陣進行兩兩打分,確定各指標的權重,最終構建基本藥物循證遴選評價指標體系。
1.3 咨詢表和專家信息
本研究通過郵件向專家發放“基本藥物循證遴選指標體系專家咨詢表”和指標及量化方法說明,咨詢表由1個一級指標矩陣和5個二級指標矩陣構成,“目錄收載情況、可供應性、使用方便性”三個一級指標下分別僅有1個二級指標。邀請基本藥物評價和循證醫學領域的專家,對構建的指標矩陣中的元素兩兩比較打分。本研究共邀請專家12位,發放問卷12份,回收10份,回收率83.3%,專家的基本信息見表1。10位專家中,7位來自科研院校,3位來自醫療機構,專家年齡分布在30~60歲之間,博士學歷和正高職稱的專家占大多數,從事專業年限均較長,對問題熟悉和很熟悉的專家共9人。專家對本問卷的問題熟悉度較高。
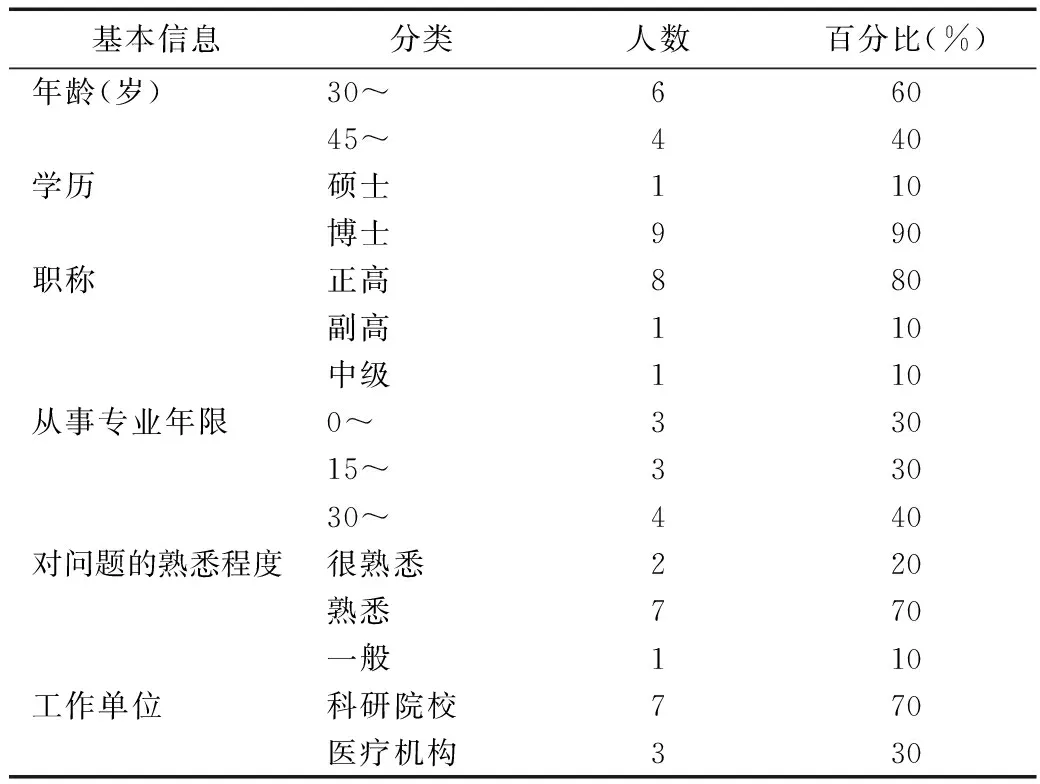
表1 專家基本信息
2 基本藥物遴選評價指標
2.1 指標篩選
研究通過檢索CNKI、CBM、VIP及萬方等數據庫,在文獻研究的基礎上,參考WHO基本藥物遴選申請及評審要求,初步擬定了由8個一級指標、9個二級指標構成的基本藥物評價指標體系。采用專家咨詢法,邀請國內循證醫學、藥物經濟學以及藥物政策領域的專家12人,于2016年5月在成都召開專家論證會議,針對指標體系的初稿進行深入討論,在最初的指標體系中刪除了1個一級指標(臨床適用性),增加了1個一級指標(使用方便性),同時對二級指標進行了細化,提高其可操作性。最終確定了基本藥物循證遴選評價指標體系,共包括一級指標8個,二級指標18個。
建立的指標體系中,在臨床指南推薦性上,考慮到各個地區制定的指南質量不一,對我國的參考價值也不同,將臨床指南按地區分為中國大陸、東南亞地區以及歐美地區。在質量可靠性二級指標的確定同臨床指南推薦性,將藥品標準分為我國現行藥典、我國其他藥品標準以及國際上先進藥典三部分;考慮到我國同一通用名的藥品仿制藥廠家很多,整體質量不統一,本研究以待評價藥品是否有原研品種在我國上市或是否通過仿制藥一致性評價來衡量藥品品種的整體質量。有效性指標主要通過評價有效性相關的文獻,鑒于有效性文獻的類型會影響其研究質量和結果真實性,按照收集的文獻研究類型并參考2001年美國紐約州立大學發布的“證據金字塔”[4],選取金字塔的前4類研究作為有效性指標的二級指標。安全性中以不良反應嚴重程度和官方發布的安全性信息為二級指標。經濟性參考WHO-EML遴選標準以日均費用和經濟學文獻研究為二級指標(表2)。
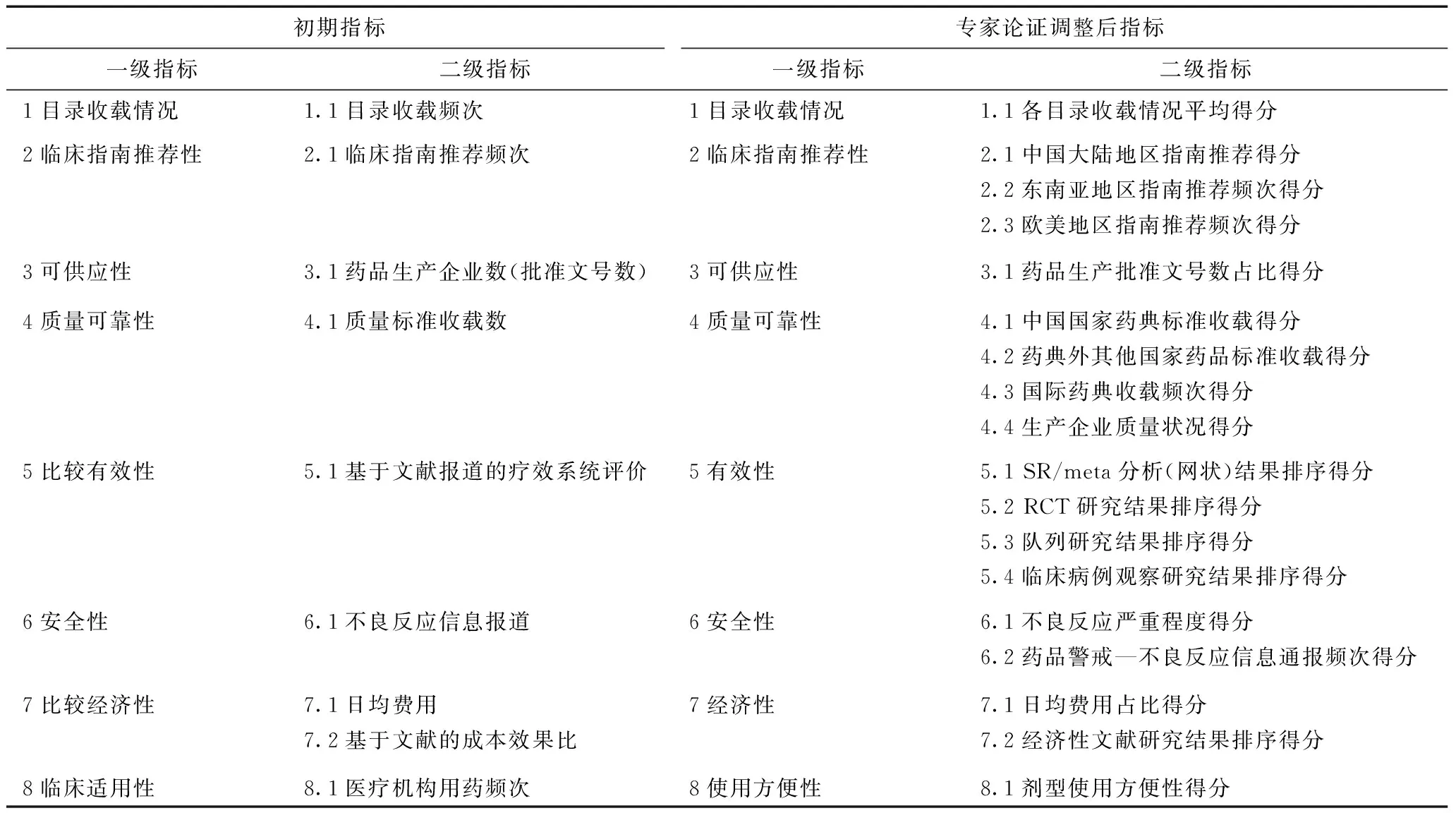
表2 基本藥物循證遴選評價指標論證前后對比
2.2 指標量化方法
2.2.1 目錄收載情況

2.2.2 臨床指南推薦性
臨床指南是臨床用藥的重要參考,可以為臨床用藥提供具體的治療信息,是評價藥品的重要證據。由于不同疾病納入的指南不盡相同,為制定統一的評分標準,同時考慮不同地區人群差異和由此帶來的指南參考性差異,將納入指南粗分為中國內地指南、東南亞國家及地區指南以及歐美國家指南三個部分,按其收錄頻次,在0~10范圍內進行評分(若指南中僅推薦了藥品的所屬類別,按0.5次計算)。中國內地臨床指南推薦一次計10分,否則計0分;日本、臺灣地區臨床指南推薦一次計5分,兩地區指南均推薦則計10分,均不推薦計0分;歐美國家地區指南主要納入美國、英國、加拿大和歐盟4個主流國家及地區的指南,根據收錄頻次分別計0、1.25、2.5、3.75、5、6.25、7.5、8.25、10分。各部分所占權重采用層次分析法計算。此外,本研究所指指南是由權威疾病委員會制定的臨床指南,不包括專家共識、治療標準等。
2.2.3 可供應性
保障基本藥物可公平獲得是基本藥物制度的主要目標之一,但我國目前仍有部分基本藥物的供應得不到保障,因此,設立可供應性指標,從藥品的現有市場信息反映其可供應性。
用藥品在市數量或產品種數反映藥品的可供應性較為合理,由于藥品在市數據的不可得性,本研究根據國家食品藥品監督管理總局藥品注冊數據,計算待評價藥品的生產批準文號數占比,作為衡量藥品市場信息的量化指標,并將其按以下公式標準化得分。可供應性得分范圍為0~10分,所占權重采用層次分析法計算。此外,具體評價某省的基藥目錄及補充目錄時,建議采用該省藥品集中采購服務中心的交易數據,即同一藥品的投標企業數和中標企業數來衡量可供應性。
其中,X為某藥品的生產批準文號數,∑x為所有待評價藥品的生產批準文號數之和。
2.2.4 質量可靠性
本研究從藥品標準收錄情況(藥典等國家標準)和生產企業的質量狀況(是否有原研廠家或通過仿制藥一致性評價)兩個方面對待評價藥品品種的整體質量進行考量。其中,藥品標準收錄情況包括中國藥典、歷版藥典、局(部)頒標準、國際藥典、英國藥典、美國藥典和歐盟藥典。收載情況按照收載頻次進行評分,中國藥典收載一次計10分;歷版藥典、局(部)頒標準二者均收載計10分,其中一者收載計5分;國際藥典、英國藥典、美國藥典和歐盟藥典根據國家或地區收載次數分別計0、2.5、5、7.5、10分。
質量方面,有原研廠家或通過仿制藥一致性評價計10分,無原研廠家且未通過仿制藥一致性評價計0分。所占權重采用層次分析法計算。
2.2.5 有效性
由于不同疾病的結局指標種類繁多,為制定適合于大部分疾病、藥品的評價方法,統一采用待評價藥品之間的療效排序來表示其臨床效果。療效數據主要從研究文獻中提取。按文獻研究類型分四類:SR或Meta分析、RCT研究、隊列研究、臨床病例觀察研究。
SR或Meta分析中可能會得到待評價藥品多組療效結果排序,如A>B,C>D>E,F>D,……,將每一組排序里的藥品按照不同間隔在0~10范圍內賦值,并以該組GRADE(grading of recommendations assessment, development and evaluation)質量等級作為權重,根據 GRADE質量評價結果,將GRADE質量評價的等級轉化為以下得分:高(1)、中等(0.8)、低(0.6)、極低(0.4)。各個藥品的得分為藥品在每組排序里得分的均值,如C>D>E,C:9,D:6,E:3,質量等級為低;F>D,F:10,D:5,質量等級為極低,最終D藥品療效排序得分為(6*0.6+5*0.4)/2=2.8。某藥品SR/Meta分析(網狀)的有效性得分如下:
其中,X1表示某藥品在某個療效排序中的得分,W1表示該藥品該療效排序的GRADE質量評價得分,n表示該藥品療效排序個數。
其余三種文獻研究的計算方法同該法,此外,本研究所指RCT是指設計嚴格的隨機對照試驗,所占權重采用層次分析法計算。
2.2.6 安全性
(1)不良反應嚴重程度
待評價藥品的主要不良反應來自藥品說明書,不良反應嚴重程度的量化主要參考文獻中專家咨詢結果[5],將不良反應嚴重程度按照傷害層級分級[6],若某藥品出現兩種以上傷害層級的不良反應,以最高傷害層級計分(取評分范圍的中值)(表3)。

表3 不良反應嚴重程度量化表
注:輕微傷害:藥品不良反應(ADR)傷害具有一過性的特點,即發生不良反應后經過停藥、對癥治療等處理后患者自愈或恢復,無需住院或進一步治療,并且對其原有疾病或預后基本無影響。中度傷害:ADR導致器官功能異常,血液化驗指標異常等,需要針對ADR進行住院治療(治療時間<3d),經治療異常情況基本恢復,或對原有疾病的治療有一定的影響(延長住院時間<7d)。較重傷害:針對ADR進行住院治療(治療時間≥3d),加重原有疾病或延長原有疾病的住院時間(延長住院時間≥7d),經治療可以恢復。嚴重傷害:ADR導致人體的某些器官或功能部分喪失,需要持續治療,或某些器官或功能的永久損害,造成傷殘,但無需持續醫學支持,不會危及生命或縮短壽命。特別嚴重傷害:ADR導致的人體的某些器官或功能的永久損害,造成嚴重殘疾,需要持續醫學支持才能維持生命。死亡:ADR導致人體死亡
(2)藥品警戒—不良反應信息
通過CFDA官網,查找待評價藥品的安全性信息數據庫(包括藥品不良反應信息通報、藥物警戒快訊,時間范圍為2001年至今),按照其在安全性信息中被通報的次數,分別計10、8、6、4、2、0分。
2.2.7 經濟性
經濟性的評估從日均費用體現和經濟學評價文獻兩方面考量。從各大醫藥數據網站(如藥智數據、搜搜醫藥等)上搜集藥品中標價格,由中標價格分別計算各藥品的日均費用(日均治療費用=中標價/包裝轉換比×限定日劑量/規格),其中,限定日劑量(DDD)參考WHO網站、藥品說明書或咨詢臨床醫生。根據以下公式將日均費用轉換為10分制得分:
其中,X為該藥品日均費用,∑x為所有待評價藥品的日均費用之和。
藥物經濟學評分方法和有效性評分方法類似,分為經濟性結果排序得分和文獻質量得分。經濟性結果排序得分和有效性結果得分方法一致,文獻質量評價采用方煜、胡明[7]的研究,整理確定了26條評價項目對篩選出的文獻進行方法學質量評價,總分為26分,按得分分為低、較低、中等、高、較高、高5個等級(表4)。

表4 藥物經濟學文獻質量評價量化表
最終某藥品的藥物經濟學文獻得分為:
其中,X1表示某藥品在某排序中的得分,W表示該排序的質量評價得分,n表示該藥品經濟學研究排序個數。
2.2.8 使用方便性
本研究按照2012年版國家基本藥物目錄的說明部分,將各具體劑型分為口服、注射、外用以及其他劑型,并對以上幾種劑型進行評分,參考趙靜在2016年針對各個劑型使用方便性的專家咨詢結果,各大類劑型方便性得分取各具體劑型方便性得分的均值[5],得分如表5所示。

表5 各類藥品劑型使用方便性量化表
2.2.9 某待評價藥品推薦結果
根據以上指標的評分方法,結合藥品實際數據收集情況,對該藥品的各個指標進行評分,最終某藥品的得分為:
A=∑An×Wn
其中,A表示某藥品的最終得分,An表示該藥品各個二級指標的得分,Wn表示各二級指標專家給出的權重。
根據待評價藥品的得分進行排序,將排名前30%左右的藥品作為強推薦備選藥品,排名在30%~60%左右的藥品作為弱推薦備選藥品,排名在后30%左右的藥品作為不推薦藥品。
3 基于層次分析法的指標權重分析
編制Excel數據錄入表,將回收的專家問卷信息錄入,計算幾何平均數,并構建新的判斷矩陣,將新矩陣中的數據錄入軟件yaahp10.5進行計算,經檢驗所有新建矩陣CR<0.1,一致性良好,無需修正或剔除。最終得到基本藥物循證遴選評價指標體系權重(表6)。一級指標的權重從高到低排序為有效性、安全性、臨床指南推薦性、質量可靠性、經濟性、使用方便性、目錄收載情況、可供應性。

表6 指標體系權重分布

(續)
4 討論與建議
4.1 研究特色及創新
綜合國際經驗,健全的基本藥物遴選機制應包括以下三個要素:一是獨立的遴選機構,二是由多利益主體組成的決策主體,三是規范的遴選程序。其中,遴選程序是將目錄遴選的政策問題轉化為具體評估問題的過程,是實現基本藥物遴選的基礎,而在具體評估問題過程中,可操作的評價指標是必不可少的。我國的遴選程序在邏輯上并不存在缺陷或漏洞,但缺乏具體的評價指標和證據支持,所以評價指標對基本藥物遴選有重要的實際意義。我國基藥遴選需要觀念轉變,除臨床必需的一些常用藥外,一些高值創新藥也可考慮納入遴選評價范圍,而這勢必會對遴選指標有更高的要求。總體來說,無論是從現階段我國遴選程序的完善還是未來遴選趨勢的變化,建立可量化的基本藥物循證遴選評價指標非常重要。
本研究綜合參考WHO、國內外文獻以及專家意見,首次構建了基本藥物遴選指標體系,該指標體系具有普遍適用性,可供國家基本藥物目錄相關部門參考。所建立的指標體系較為全面細化,除納入常見的安全有效和經濟外,還納入質量可靠、目錄推薦、指南推薦、使用方便和市場供應進行評價,對待評價藥品的評價較為全面,評價結果可以較為準確的反映藥品的實際水平。此外,該指標設計具有一定的普適性,理論上可以適用于大部分常見疾病藥品的評價。
4.2 研究局限性
本研究主要存在以下幾點局限性:一是指標建立和權重確定中采用專家咨詢和層次分析法,可能存在主觀因素的影響。層次分析法只能在現有方案或決策中選擇最優的,不能增添新的方案。其次,層次分析法確定權重時,主觀因素的影響難以避免,且被調查者不易理解該方法并在實際填寫問卷時很容易出現邏輯混亂,缺乏一致性。二是指標的量化標準稍顯固化。本研究建立的指標體系是以固定權重和細化指標構成,但基本藥物遴選評價是一個綜合、復雜且具有一定個性化的問題,不同疾病、不同待評價藥品收集的證據類型各不相同,目前的數據收集方法規避了一些存在差異化的數據,若將本指標用于各種不同疾病藥品的評價時,量化標準可能需要根據實際情況進行調整。三是有些指標還需調整完善,如藥品可供應性采用藥品生產批準文號數不能反映真實生產情況,實際生產中有較多并未投產的情況,需考慮其他更為有效的細化指標,如采用各省集中采購某藥的品種數量化省級補充目錄的可供應性。
因此建議在正式使用該指標體系評價基藥目錄時,可以在定量結果的基礎上,綜合藥品的其他信息確定最終推薦結果,即某藥品得分排序應為強推薦,如在收集證據過程中發現其存在嚴重不良反應,可以將其調整到弱推薦或不推薦。關于可供應性方面,建議相關部門能夠建立相關數據庫以顯示各藥品在市情況,并嚴格規范生產批準文號的申請與頒發,對藥物的生產管理及供應至關重要。
[1] 李幼平, 沈建通. 基本藥物目錄遴選與使用的發展與創新[J]. 中國循證醫學雜志, 2013, 13(11): 1273-1279.
[2] Anon. WHO medicines strategy:Revised procedure for updating WHO’s Model List of Essential Drugs[J]. Foot & Ankle International, 1998, 19(3): 166-168.
[3] 王莉, 袁強, 成嵐, 等. 我國基本藥物目錄遴選與評價方法的問題與反思[J]. 中國藥房, 2010(16): 1453-1456.
[4] 童峰, 鄭昊, 劉卓. 從循證醫學到循證實踐的思辨與發展[J]. 醫學與哲學(A), 2017(2): 38-42.
[5] 趙靜. 應用層次分析法優化基本藥物遴選的研究[J].衛生經濟研究, 2016(12): 13-18.
[6] 盛紅彬, 黃登笑, 陸逸雁, 等. 藥品不良反應傷害分級的初步研究[J]. 海交通大學學報(醫學版), 2009(29): 1515-1517.
[7] 方煜. GLP-1類似物及DPP-4抑制劑治療II型糖尿病的療效及經濟學評價[D]. 成都: 四川大學, 2015.

