醫療器械的可用性工程淺析
李慶雨,施燕平,劉美麗,楊婧
1.山東省醫療器械產品質量檢驗中心,山東 濟南 250101;2.山東恒信檢測技術開發中心,山東 濟南 250101
醫療器械的可用性工程淺析
李慶雨1,施燕平1,劉美麗2,楊婧2
1.山東省醫療器械產品質量檢驗中心,山東 濟南 250101;2.山東恒信檢測技術開發中心,山東 濟南 250101
本文介紹了有源醫療器械可用性和可用性工程的含義以及可用性工程的工作過程并結合風險管理的要求,以及可用性工程和風險管理之間的關系。對于風險管理過程而言,與可用性關聯的問題,諸如與安全性有關的特征,應在風險分析時予以考慮;可用性確認的結果最好也在剩余風險的評價中考慮;風險管理過程中的生產后信息的評價宜包括可用性。可用性工程過程的目標是在用戶接口的可用性方面提供對患者、操作者和其他人員的安全。因此,可用性工程應及早進行并持續貫穿醫療器械的整個開發周期,最終形成可用性工程文檔;可用性工程文檔可以是風險管理文檔的一部分。
醫療器械;可用性;可用性工程;風險管理;人機交互
引言
近年來,醫療器械應用越來越廣泛,在保證其“安全、有效”的同時,對其人機交互方面也提出了更多的要求,即可用性[1-2]。標準YY/T 1474-2016《醫療器械可用性工程對醫療器械的應用》[3]是目前國內即將實施的可用性標準,該標準等同采用國際標準版本為IEC 62366-2007[4],規定了有關醫療器械可用性的分析、確定、設計、驗證和確認過程,適用于評定醫療器械可用性問題引起的風險。YY/T 0316-2016《醫療器械風險管理對醫療器械的應用》[5]規定了分析、評價、控制和監視醫療器械風險的過程要求,兩個標準相互依存和補充,成為控制醫療器械風險的重要依據。
1 可用性和可用性工程
簡單地講,可用性就是在保證安全性的前提下考核人機交互的有效性、效率、易學度、滿意度;是在設備預期使用/預期用途范圍內,指定的操作者在指定環境下完成指定目標的有效性、效率和滿意度的度量。
可用性工程指運用下面所述知識以達到足夠的可用性,這些知識包括:人類行為、能力、局限性、設計特性(即設計工具、裝置、系統、任務、工作)、環境方面的知識[6]。可用性工程過程的目標是在用戶接口的可用性方面提供對患者、操作者和其他人員的安全,因此,可用性工程應及早進行并持續貫穿醫療器械的整個開發周期,最終形成可用性工程文檔。
2 醫療器械的可用性工程
雖然可用性的定義中包含了4個方面的特性,但是其中的效率和滿意度兩方面的特性與醫療器械的人機交互和安全性非直接相關,醫療器械的可用性工程對此不予關注。另外兩個特性,即有效性和易學度,成為醫療器械的可用性工程關注的內容。
按照醫療器械的使用者對它們實施的行為是否偏離了制造商合理風險控制措施的范圍,可以分為正常使用和非正常使用。醫療機構的統計表明,醫療設備使用過程中的錯誤逐年增多[7],有些錯誤源于操作者對于醫療器械的故意或故意省略行為造成的,使得制造商提供的風險控制措施變得無效,屬于非正常使用;有些錯誤的產生是由于可用性設計缺陷導致的,問題的實際原因可能存在于設計而不是使用者[8],這種情況屬于正常使用,這些錯誤稱為使用錯誤。可用性工程不考慮非正常使用引起的風險,只關注于醫療器械的正常使用和使用錯誤。可用性工程過程試圖通過降低使用錯誤和使用錯誤的風險來實現合理的可用性。
使用錯誤包含有意的行為和無意的行為,而使用錯誤中的有意行為指的是合理可預見的誤用,是由于很容易預見的操作者行為導致的未按制造商預期的方式來使用。例如,“一臺沒有測量結束提示功能的血壓計,使用者在還沒有完成測量時就移開了袖帶”就屬于有意行為導致的使用錯誤,是一種合理可預見的誤用;“由于兩個按鈕位置太近導致使用者誤操作”則屬于無意行為導致的使用錯誤。缺乏人性化的界面設計而誘使操作者作出錯誤決定是導致使用錯誤的直接原因。
非正常使用只包含有意的行為,其結果是往往導致制造商提供的風險控制措施無效,例如,“使用者無視袖帶標識把血壓計的成人袖帶用于兒童”就是有意的行為,越過了制造商的合理的風險控制措施。由于合理可預見的誤用和非正常使用都是有意的行為,使這兩個概念不宜區分,且有時兩者會相互轉化,因此,制造商在風險管理過程中應結合特定醫療器械的使用情景,定義哪些是合理可預見的誤用,定義哪些是非正常使用,并在風險管理過程文檔中明確用于降低合理可預見的誤用所采取的風險控制措施。
不充分的可用性導致使用錯誤已經變為相關風險逐步增加的誘因。可用性工程過程目是實現預期的合理的可用性,以減少使用錯誤和相關的風險。對于制造商來講,其有義務來控制一些使用錯誤。
3 可用性工程過程
可用性工程正是運用了人類當今的知識水平和行為特征,以達到足夠的可用性并同時降低風險的目的,包含了分析、設計、驗證和確認可用性的全部過程。可用性工程的核心內容就是圍繞設計和實施用戶接口展開;可用性工程的目的是醫療器械提供充分的可用性,使得由于正常使用和使用錯誤導致的風險是可以接受的。可用性工程的整個過程,見圖1。
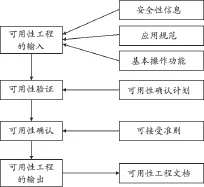
圖1 一個簡單的可用性工程過程
可用性工程的過程可以大致概述為如下過程:由可用性工程的輸入開始,首先運用可用性規范進行可用性驗證,然后對照可用性確認計劃完成可用性確認,并形成可用性工程文檔,以保證醫療器械能夠提供充分的可用性,使得由于正常使用和使用錯誤導致的風險是可接受的。
3.1 可用性工程輸入
可用性工程輸入是整個可用性工程的工作對象,主要涉及3個方面的內容:應用規范、作為風險控制措施的安全性信息和基本操作功能。其中應用規范包括預期用途、患者情況、使用部位、預期的用戶特征和使用條件等相關情況。基本操作功能包括了三方面的功能:一是經常使用的功能;二是與基本安全和基本性能相關的功能;三是人機交互涉及到的其它功能。當制造商使用了固有安全設計和防護措施之后,還需要使用安全性信息來控制風險時,該安全性信息,例如說明書、培訓和培訓材料、維護信息等,也成為用戶接口的一部分,是可用性工程關注的重要內容。
3.2 可用性驗證
可用性驗證是通過檢查用戶接口的實現并收集樣機的相關數據來完成的,依據的是可用性規范。可用性規范是定義與可用性相關的用戶接口要求的文件,提供了進行可用性驗證時用到的可進行測試的要求、可用性目標和可接受性準則,是進行用戶接口可用性驗證的依據。
可用性驗證的目的就是證實用戶接口符合制造商所制定的可用性規范。由于可用性工程的迭代特性,進行規范的可用性驗證可以幫助制造商調整用戶接口的設計方案,完善產品的組成,例如說明書或培訓等。
3.3 可用性確認
可用性確認時按照可用性確認計劃對用戶接口的設計完成確認的過程。可用性確認計劃由制造商制定和維護,是進行可用性確認的依據。可用性的確認是指“通過提供客觀證據對特定的預期用途或應用要求已得到滿足的認定”,因此,可用性確認計劃是針對基本操作功能而言,旨在制定用于基本操作功能可用性確認的方法、建立基本操作功能可用性確認的成功的標準、指定預期操作者代表。
可用性確認的方法可以是定量的,也可以是定性的;可以在專業實驗室中進行,也可以在模擬的環境或實際使用環境中進行。制造商進行可用性確認時,應基于產品的預期用途,采用多個方法針對基本操作功能的可用性進行。若結果符合標準的要求,在可用性工程文檔中進行記錄即可,否則還須增加進一步的用戶接口設計和實施活動或在其不可行時完成受益和風險的評估;受益超過風險,則風險可接受;風險超過受益,則風險不可接受。
3.4 可用性工程輸出
可用性工程的輸出可以記錄在可用性工程文檔。可用性工程文檔是指可用性工程過程產生的一組記錄和其它文件,記錄了可用性工程過程及其結果。制造商通常可以把這些記錄和結果融入到風險管理文檔中,以便更好地完成可用性工程和風險管理過程,同時方便檢索和溯源。
3.5 可用性驗證和可用性確認之間的關系
可用性驗證的目的是驗證醫療器械符合可用性規范,用戶接口符合設計規范;可在模擬環境中的樣機上完成或獲取數據。
可用性確認的目的是確保制造的醫療器械是正確的,滿足預期用途的可用性要求。可用性確認比可用性驗證更重要的地方是能夠發現用戶和醫療器械之間的非預期的交互行為。例如,可用性驗證時未發現的操作細節很可能會在確認時顯現,并對驗證后的用戶接口設計進行最終確認。
3.6 可用性工程中常用的技術方法
目前有許多技術和方法可以用于醫療器械的可用性工程中,例如參與式設計、設計審核、有聲思維法、功能分析、啟發式評估、失效模式和效果分析、問卷和調查等。每種方法均有各自的優缺點,例如啟發式評估能夠在設計早期發現用戶接口方面存在的問題,但是對于專家的依賴程度較高[9];失效模式和效果分析是一種前瞻性的可靠性分析方法[10],但是耗費的數據和人力等資源較多;出聲思維法具有所需被試人數少、費用較低等優點[11],但是在缺乏統一的理論指導時其優勢較難體現。
這些技術和方法可以幫助醫療器械的開發者設計出更適用、更安全的用戶接口。由于采用單一的方法滿足不了可用性工程過程的所有階段,一般應采用多種方法貫穿于產品的開發周期,通常由從事可用性工程過程的專業人員依據產品的全生命周期中每個階段的需要來選擇,優先選擇能產生客觀數據的方法,以供可用性確認使用;即使設計不成功,也能幫助查找原因。醫療器械制造者應把這些技術和方法與可用性工程結合在一起,迭代地進行設計和開發,貫穿于醫療器械的全生命周期過程中,完成用戶接口的設計和實現。
4 可用性工程過程和風險管理過程的關系
可用性工程過程和風險管理過程的關系,見圖2。總體來說,可用性工程和風險管理的過程互為輸入,不可分割。

圖2 可用性工程過程及與風險管理過程的關系
另外,針對IEC 60601-1中所定義的“醫用電氣設備”考慮可用性工程時,亦應關注標準IEC 60601-1-6[12];且“安全”應涵蓋IEC 60601-1第三版中的“基本性能和基本安全”的含義,因此,相應的風險管理過程中涉及到的“安全”也應采用這樣的含義。
可用性工程中識別的與安全性有關的特征是兩者均需要考慮的內容,其確定的已知的或可預見的危險或危險情景能幫助制造商在風險管理中識別危險,反過來,在風險管理中識別的危險和與基本性能和基本安全相關的功能可以幫助制造商完善對可預見的危險的確定過程。
對于可用性工程過程,醫療器械的風險分析的結果應作為可用性規范的輸入;風險分析的結果或者對風險分析結果的引用位置也應記錄在可用性工程文件中。由風險分析中可得出的基本性能和基本安全,與此相關的功能是可用性工程中的基本操作功能;作為風險控制措施的安全信息也是可用性工程中必須考慮的內容。風險分析中總結的與醫療器械相關的危害也是可用性驗證的基礎。風險分析中確定的剩余風險的可接受準則也成為可用性確認成功的判定準則。
對于風險管理過程而言,與可用性關聯的問題,諸如與安全性有關的特征(包含用戶特征、使用情景等應用規范和經常使用的功能)、已知的或可預見的危險和危險情況(包含可能的使用錯誤、類似產品的用戶接口危險信息、用戶接口的評審結果等),應在風險分析時予以考慮;可用性確認的結果最好也在剩余風險的評價中考慮;風險管理過程中的生產后信息的評價宜包括可用性。可用性工程過程的目標是在用戶接口的可用性方面提供對患者、操作者和其他人員的安全。因此,可用性工程應及早進行并持續貫穿醫療器械的整個開發周期,最終形成可用性工程文檔;可用性工程文檔可以是風險管理文檔的一部分。
5 結束語
在醫療器械的設計中實施有效的可用性工程,對于醫療機構而言,能夠提高工作滿意度和質量,避免醫療事故,降低運行成本[13],意義重大。但是,可用性方法所帶來的經濟上的好處,許多是在產品發布以后才顯現出來的[14-16],這對于制造商而言可能存在一定的惰性;對于監管部門和專門的技術委員會而言可能會疏漏。因此,可用性工程的規范化推廣和應用需要監管部門、技術委員會和制造商共同努力。
[1] 國家食品藥品監督管理總局.醫療器械監督管理條例(國務院令第650號) [EB/OL].http://www.sda.gov.cn/WS01/ CL0784/97814.html.
[2] 王蘭明.關于改革和完善中國醫療器械注冊管理制度的探討[J].中國醫療器械雜志,2012,36(6):426-432.
[3] YY/T 1474-2016,醫療器械可用性工程對醫療器械的應用[S].
[4] IEC 62366-1-2007,Medical devices – Application of usability engineering to medical devices[S].
[5] YY/T 0316-2016,醫療器械 風險管理對醫療器械的應用[S].
[6] IEC 60601-1-2012,Medical electrical equipment -- Part 1: General requirements for basic safety and essential performance[S].
[7] 張仁敏.醫療設備可用性工程與使用安全性[J].醫療衛生裝備,2013,34(7):101-121.
[8] 劉歆.醫療器械設計中的可用性及標準要求[J].中國醫療器械雜志,2010,34(1):47-49.
[9] 王建冬.國外可用性研究進展述評[J].現代圖書情報技術, 2009,(9):7-16.
[10] 劉朧,劉虎沉.運用FMEA的產品可用性評價方法[J].工業工程, 2010,13(3):47-50.
[11] 周榮剛,張侃.可用性測試中的出聲思維法[J].人類工效學, 2005,11(3):55-57.
[12] IEC 60601-1-6-2013 Medical electrical equipment - Part 1-6: General requirements for basic safety and essential performance - Collateral standard: Usability[S].
[13] 周丹.急救醫學裝備工程導論[M].北京:人民軍醫出版社,2006.
[14] Nielsen J.可用性工程[M].北京:機械工業出版社,2004.
[15] 張元,駱雯,管倖生.可用性目標在可穿戴設備設計中的應用研究[J].包裝工程,2015,(8):72-75.
[16] 魏永俠.交互設計中的產品可用性目標研究[J].包裝工程,2011,(14):71-73.
本文編輯 蘇欣
Analysis of Usability Engineering to Medical Devices
LI Qing-yu1, Shi Yan-ping1, LIU Mei-li2, YANG Jing2
1. Shandong Quality Inspection Center for Medical Devices, Jinan Shandong 250101, China; 2. Shandong Heng Xin Inspection Technique Exploiture Center, Jinan Shandong 250101, China
This article introduced the usability of active medical devices, meaning of usability engineering as well as the working process of usability engineering; and also introduced the relationship between usability engineering and risk management in combination with the requirements of risk management. For the risk management process, issues related to usability, such as safety-related features, should be considered in risk analysis; results of usability validation should better be taken into account in the assessment of residual risks; it is better to include usability in the post-production information assessment during risk management process. The goal of usability engineering process is to provide for the safety of patient, operator, and other personnel in terms of usability of user interface. For this reason, usability engineering should be conducted early and carried out throughout the entire development cycle of the medical device, finally forming the usability engineering documents, which can be part of risk management document.
medical devices; usability; usability engineering; risk management; man-machine interaction
TG174.2;TG14
A
10.3969/j.issn.1674-1633.2017.02.001
1674-1633(2017)02-0001-04
2016-11-10
國家重點研發計劃試點專項(2016YFC0106001)。
王瑾曄,教授。
通訊作者郵箱:jinyewang@sjtu.edu.cn

