一種高鹽廢水去除硬度的方法及最佳工藝參數探討
蔣小友,于 望,吳 軍,劉斯勤
(揭陽市表面處理生態工業園有限公司,廣東 揭陽 522000)
1 引言
目前我國水資源匱乏,污水再生利用是解決水資源短缺的重要戰略和必要途徑。但是污水成分復雜,除含有常規化學污染物外,還存在多種多樣的微量有毒有害化學污染物和致色致臭物質。由于反滲透系統對污水中有機物、病原微生物、硝酸鹽氮以及難降解有機物具有良好的去除效果,已逐漸在污水再生利用領域得到推廣利用。反滲透系統在生產高質量再生水的同時,會有副產物RO濃水產生。RO濃水的水量通常占進水量的25%~50%,具體取決于RO系統的回收率[1]。隨著世界范圍內反滲透工藝使用范圍和數量的不斷擴大,RO濃水水量也不斷增加,RO濃水的直接排放除了水資源浪費外,還會嚴重影響日益嚴峻的水環境系統。由于海水淡化反滲透和苦咸水脫鹽反滲透歷史較久,一些污水處理項目采用將反滲透濃水通過海水淡化反滲透及苦咸水脫鹽反滲透進一步濃縮,提高污水的回用率同時也減少了濃鹽水的排放,經過濃縮處理的濃鹽水通過蒸發結晶實現資源化利用。但是濃鹽水中的鈣鎂等物質會使蒸發器結垢,如果不采取預處理將會降低蒸發器的使用壽命同時也增大了運行勞動強度,本文以廣東某電鍍園區零排放項目為研究背景探討濃鹽水除鈣鎂的工藝及最佳工藝的運行參數。
2 工藝探討
本文以阻垢劑法、石灰軟化法、石灰純堿軟化法、混凝沉淀法、沸石法及氧化鋁法為研究對象,探討了濃鹽水除硬度的工藝。
2.1 阻垢劑法
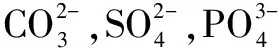
2.2 石灰軟化法
石灰軟化法是利用石灰去除水中二氧化碳及碳酸鹽硬度并將鎂的非碳酸鹽硬度轉變成相應的鈣硬度。
為了避免生石灰的粉塵污染,本文實驗采取將生石灰溶解水中形成氫氧化鈣進行實驗。方程式如下:
CaO+H2O=Ca(OH)2
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O
Ca(OH)2+Mg(HCO3)2=CaCO3↓+ MgCO3+2H2O
MgCO3+Ca(OH)2=CaCO3↓+ Mg(OH)2↓
形成的碳酸鈣及氫氧化鎂都是難溶物質,從水中沉淀析出。
2.3 石灰純堿軟化法
石灰純堿軟化法適用于硬度高、堿度低的水質,在投加石灰的同時補充適量的碳酸鈉達到去除硬度的目的。反應如下:
CaSO4+Na2CO3=CaCO3↓+Na2SO4
CaCl2+Na2CO3=CaCO3↓+2NaCl
MgSO4+Na2CO3=MgCO3↓+2NaCl
MgCO3+Ca(OH)2=CaCO3↓+ Mg(OH)2↓
Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O
Mg(HCO3)2+2Ca(OH)2=2CaCO3↓+Mg(OH)2↓+2H2O
2.4 混凝沉淀法
混凝法的基本原理是在廢水中投入混凝劑,因混凝劑為電解質,在廢水里形成膠團,與廢水中的膠體物質發生電中和,形成絨粒沉降。混凝沉淀不但可以去除廢水中的粒徑為10-6~10-3mm的細小懸浮顆粒,而且還能夠去除色度、油分、微生物、氮和磷等富營養物質、重金屬以及有機物等。
廢水在未加混凝劑之前,水中的膠體和細小懸浮顆粒的本身質量很輕,受水的分子熱運動的碰撞而作無規則的布朗運動。顆粒都帶有同性電荷,它們之間的靜電斥力阻止微粒間彼此接近而聚合成較大的顆粒;其次,帶電荷的膠粒和反離子都能與周圍的水分子發生水化作用,形成一層水化殼,阻礙各膠體的聚合。一種膠體的膠粒帶電越多,其電位就越大;擴散層中反離子越多,水化作用也越大,水化層也越厚,因此擴散層也越厚,穩定性越強。按機理,混凝可分為壓縮雙電層、吸附電中和、吸附架橋、沉淀物網鋪4種。本文選用鋁礬土+PAM進行實驗。
2.5 沸石法
沸石是一種含水的堿或堿土金屬的鋁硅酸鹽礦物,是由硅氧四面體和鋁氧四面體組成的架狀硅酸鹽。其鋁氧四面體中氧原子有一價未得到飽和,整個鋁氧四面體帶有負電,由附近帶正電的陽離子如K+、Na+、Ca2+、Mg2+等堿或堿土金屬離子來補償平衡。沸石晶格內部有很多大小均一的通道和孔穴,孔穴之間通過開口的通道彼此相連,并且與外界溝通,孔穴和孔道可占沸石晶格體積的30%以上,其中存在著許多可以脫附的水。沸石晶格中的K+、Na+、Ca2+等陽離子易與周圍水中的陽離子發生交換作用,交換后沸石晶格結構不會被破壞。沸石可用做吸附劑、干燥劑、催化劑及洗滌劑。
2.6 氧化鋁法
氧化鋁吸附劑為白色球狀多孔性顆粒,粒度均勻,表面光滑,機械強度大,吸濕性強,吸水后不脹不裂保持原狀,產品無毒、無味、無臭,不溶于水及有機溶劑,氧化鋁吸附劑具有許多毛細孔道,表面積大,可作為吸附劑、干燥劑及催化劑使用。同時還根據吸附物質的極性強弱來確定,對水、氧化物、醋酸、堿等具有較強的親合力,活性氧化鋁是一種微水深度干燥劑,也是吸附極性分子的吸附劑。
3 實驗分析
3.1 實驗水質:
本實驗取用二級海水淡化膜后的濃鹽水做為實驗水,實驗水在原水的基礎上進行了約15倍的濃縮,濃鹽水經過預處理后進更高壓力的膜設備,在進高壓膜設備之前需要進一步去除廢水中的硬度,因為硬度太高,影響后續設備的正常運行;實驗的水質情況詳見表1。

表1 濃鹽水水質
3.2 實驗器材
實驗所用的器材為:磁力攪拌儀,雷磁pH檢測儀,哈希DR6000,電子天平及玻璃燒杯。
3.3 實驗方法
在同等實驗條件下各取100 mL濃鹽水分別加入不同的藥劑進行實驗,探索同等條件下不同藥劑對濃鹽水中的硬度的影響,其中各種藥劑的量都是過量,具體各種藥劑的實驗步驟如下。
(1)阻垢劑法去除硬度實驗:取100 mL水投加過量反滲透阻垢劑溶液、控制pH值為10,磁力攪拌10 min,靜止沉淀觀察上清液情況并過濾后檢測硬度。
(2)石灰軟化法去除硬度實驗:取100 mL濃鹽水投加過量5%氧化鈣溶液,靜止沉淀觀察上清液情況并過濾后檢測硬度、控制pH值為10。
(3)石灰純堿軟化法去除硬度實驗:取100 mL濃鹽水投加過量5%氧化鈣溶液后繼續投加過量的5%碳酸鈉溶液、控制pH值為10、磁力攪拌10 min,靜止沉淀觀察上清液情況并過濾后檢測硬度。
(4)混凝沉淀法去除硬度實驗:取100 mL濃鹽水投加過量鋁礬土固體加入適量的PAM溶液、控制pH值10、磁力攪拌10 min,靜止沉淀觀察上清液情況并過濾后檢測硬度。
(5)沸石法吸附處理去除硬度實驗:制作簡易過濾柱,將沸石投入其中,控制流速0.3 L/h~0.5 L/h,處理100 mL濃鹽水,反應結束后檢測硬度、控制pH值為10。
(6)氧化鋁法吸附處理去除硬度實驗:制作簡易過濾柱,將氧化鋁投入其中,控制流速0.3 L/h~0.5 L/h,處理100 mL水樣,反應結束后檢測硬度、控制pH值為10。
3.4 結果與討論
3.4.1 除硬度方法篩選
按照實驗過程分別實驗后,檢測結果見表2。

表2 硬度檢測數據
從表2中數據可知:阻垢劑法是使成垢陽離子形成螯合物,達到去除硬度的目的,去除率達到83.1%石灰軟化法是把鎂硬度轉換成相應的鈣硬度,總硬度沒有得到很好的去除,去除率為23.4%;石灰純堿軟化法是利用石灰補充堿度投加碳酸鈉,很好的使陳垢陽離子形成沉淀去除,使總硬度降低,去除率達到97.8%;混凝沉淀法主要去除膠體粒子及懸浮物,去除率19.9%,說明濃鹽水中影響硬度的物質中膠體粒子少,從而去除率不高;沸石法是利用陽離子的交換作用去除硬度,去除率73.5%;氧化鋁法的去除率32.6%,說明能被吸附的硬度不高;在同等實驗條件下,石灰純堿軟化法的效果最好。
3.4.2 廢水鹽分對去除硬度的影響
在上述實驗的基礎上,在高鹽分廢水中去除硬度的方法是石灰純堿軟化法,針對篩選出來的方法是否具有推廣意義,選取不同濃度的鹽分的廢水進行實驗。各取100 mL廢水,TDS分別為10000 mg/L、15000 mg/L、20000 mg/L、25000 mg/L、30000 mg/L、35000 mg/L、40000 mg/L,分別加入過量5%氧化鈣溶液后繼續投加過量的5%碳酸鈉溶液,控制廢水的PH10,采用磁力攪拌器勻速攪拌10分鐘后靜止,分層后分別取上清液檢測硬度,數據如表3。
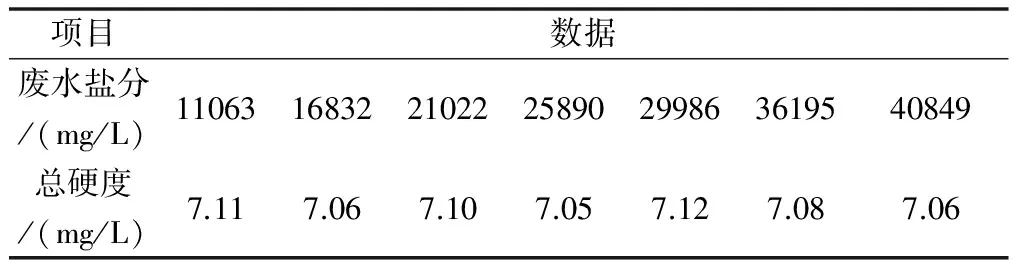
表3 硬度檢測數據
從表3數據分析來看,實驗的廢水鹽分從11063mg/L至40849 mg/L變化,在同等條件下,測試廢水后的硬度變化不大,鹽分對去除硬度沒有影響。
根據上述實驗可以得到,處理高鹽廢水去除硬度最理想的方法是石灰純堿軟化法,并且此方法不受廢水鹽分的濃度影響,能夠穩定去除硬度。
4 最佳工藝運行參數探討
根據上述實驗確定了最佳工藝即石灰純堿軟化法,接下來探討其最佳運行參數。
4.1 實驗廢水水質
廢水水質見表4。

表4 廢水水質情況
4.2 實驗步驟
4.2.1 氧化鈣投藥量影響因素
取100 mL水樣加6%氧化鈣5 mL,反應完全測其上清液; 取100 mL水樣加6%氧化鈣5 mL,繼續加5%碳酸鈉9 mL,反應完全測其上清液; 取100 mL水樣加6%氧化鈣10 mL,反應完全測其上清液; 取100 mL水樣加6%氧化鈣10 mL,繼續加5%碳酸鈉9 mL,反應完全測其上清液; 取100 mL水樣加6%氧化鈣15 mL,反應完全測其上清液; 取100 mL水樣加6%氧化鈣15 mL,繼續加5%碳酸鈉9 mL,反應完全測其上清液; 取100 mL水樣加6%氧化鈣15 mL,反應完全測其上清液; 取100 mL水樣加6%氧化鈣15 mL,繼續加5%碳酸鈉9 mL,反應完全測其上清液; 數據見表2。
從表中數據可知:加入氧化鈣會去除部分鈣硬度及鎂硬度,但是加入過量會導致結果升高,投加碳酸鈉除去多余的氧化鈣同時堿度提高,硬度的去除率也同時提高。適合本實驗廢水的最佳氧化鈣投藥量為100 mL廢水需要0.6氧化鈣。
4.2.2 碳酸鈉投藥量影響因素
在前文的基礎上探討碳酸鈉的最佳投藥量,實驗過程如下: 100 mL廢水投加6%氧化鈣10 mL,繼續投加5%碳酸鈉6 mL,反應完全測其上清液; 100 mL廢水投加6%氧化鈣10 mL,繼續投加5%碳酸鈉9 mL,反應完全測其上清液; 100 mL廢水投加6%氧化鈣10 mL,繼續投加5%碳酸鈉12 mL,反應完全測其上清液; 100 mL廢水投加6%氧化鈣10 mL,繼續投加5%碳酸鈉15 mL,反應完全測其上清液。數據見表6。

表5 氧化鈣加藥量實驗數據(在同一條件下實驗,保持一個參數變化)

表6 碳酸鈉投藥量實驗數據
從表中數據可知,在同等條件下,加5%碳酸鈉12 mL,效果最佳。
4.2.3 最佳pH值影響因素
在前文的基礎上確定最佳pH值反應條件。實驗過程如下: 取100 mL原液調節pH到8.5,投加6%氧化鈣10 mL,繼續投加5%碳酸鈉12 mL反應完全取其上清液進行檢測; 100 mL原液調節pH到9.5,投加6%氧化鈣10 mL,繼續投加5%碳酸鈉12 mL反應完全取其上清液進行檢測; 100 mL原液調節pH到10.5,投加6%氧化鈣10 mL,繼續投加5%碳酸鈉12 mL反應完全取其上清液進行檢測; 100 mL原液調節pH到11.5,投加6%氧化鈣10 mL,繼續投加5%碳酸鈉12 mL反應完全取其上清液進行檢測,見表7。
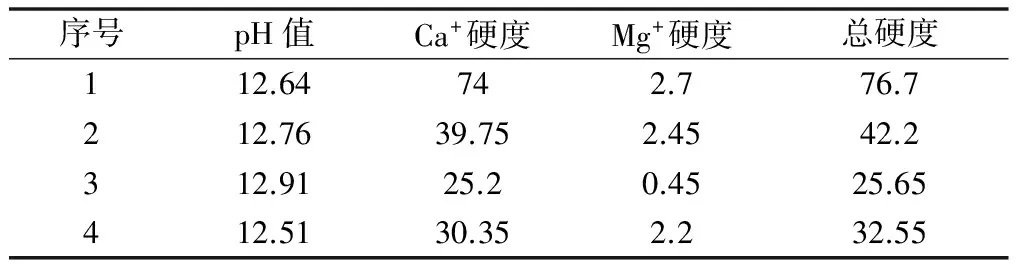
表7 最佳pH值實驗結果
從表7中數據知最佳反應pH值為10.5。
5 結果與討論
本文就高鹽廢水去除硬度的方法選擇進行了篩選,并且探索了高鹽廢水鹽分對去除硬度的影響因素,最終得出對于高鹽廢水去除硬度最理想的方法是石灰純堿軟化法,并且此方法不受廢水鹽分的濃度影響,能夠穩
定去除硬度。同時探討石灰純堿軟化法除硬度最佳運行參數,從實驗數據知適合該電鍍園區濃鹽水最佳pH值為10.5,100 mL濃鹽水需要0.6g氧化鈣,0.6g碳酸鈉。
[1]孫迎雪,胡洪營,高 岳,等.城市污水再生處理反滲透系統RO濃水處理方法分析[J].西南給排水,2010(6).
[2]曹 霞.去除水中硬度處理方法探討[J].西南給排水,2011(11).
[3]杜春文,王 萍,劉雯文.BI沸石去除硬度與重金屬離子的交換特性[J].甘肅科學學報,2016(7).
[4]蔡月圓,費學寧,苑宏英,等.濃鹽水處理技術研究發展[J].環境科學與管理,2001(6).

