Hg脅迫下水楊酸對金針菇液體培養生理生化的影響
佘婷婷 吳映明 生書晶 駱 敏 嚴雪群
(廣東第二師范學院生物與食品工程學院,廣東廣州510303)
金針菇(Flammulina velutipes)是一種著名的食藥用真菌,具有“一高二低三豐富”的特點,所特有的真菌多糖具有良好的防癌和抗癌功效,能夠顯著的改善人體免疫機能和提高人體免疫力[1-3],非常符合現代人的保健需求,備受消費者的親睞,因而消費量也不斷提高[4]。隨著現代工業的迅猛發展,Hg污染問題已日益嚴重,食用菌通過栽培料對重金屬離子具有一定的富集或生物轉化作用,經常食用可通過食物鏈進入人體,從而影響食用者的健康[5]。水楊酸(SA)是一種廣泛存在于植物體內的小分子酚類物質,對植物生長代謝具有廣泛的調節作用,是一種高效的、廉價的、無毒的植物生長調節劑。前人研究表明SA能誘導植物重金屬抗性、緩解重金屬元素對于許多作物生長的脅迫作用[6],但關于SA能否提高金針菇菌絲抗逆性卻未見報道。研究在于為中度汞污染下金針菇培養的原位修復及尋找既能滿足人類對食用菌的需求又能消除重金屬對人類健康的危害的問題提供理論依據。
1 材料與方法
1.1 供試菌株白金針菇,編號GIM5.50,由廣東省微生物菌種保藏中心提供。
1.2 試劑與儀器設備①試劑:氯化汞(分析純,泰興市化學試劑廠),水楊酸(分析純,廣州化學試劑廠),愈創木酚(分析純,阿拉丁),羧甲基纖維素酶(分析純,阿拉丁),葡萄糖(分析純,阿拉丁),牛血清蛋白質(分析純,阿拉丁);②儀器設備:CHA-S恒溫振蕩器(常州澳華儀器有限公司),TDL-60B離心機(上海安亭科學儀器廠),DNM-9602A酶標分析儀(北京普朗新技術有限公司),756MC型分光光度計(上海菁華科技儀器有限公司),DDS-11A電導率儀(上海儀電科學儀器股份有限公司),pH計(上海儀電科學儀器股份有限公司)。
1.3 試驗方法
1.3.1 培養方法
1.3.1.1 制備培養基[7]PDA培養基:馬鈴薯20%,瓊脂1.5%,葡萄糖2%;液體培養基:馬鈴薯20%,蛋白胨0.2%,KH2PO40.1%,MgSO4·7H2O 0.1%,維生素B10.002%,葡萄糖2%。
1.3.1.2 菌種活化 挑取菌株接種于PDA平板培養基上培養14 d。
1.3.1.3 SA調控處理方法 在液體培養基中加入HgCl 1 mg/L,SA試驗設計1、10、20、50、100 mg/L和200 mg/L 6個水平,以不添加SA的液體培養基CK為對照。使用250 mL的錐形瓶裝液50 mL,取1 cm2的菌種接到各培養液中,25℃,150 r/min的搖床振蕩培養。
1.3.2 樣品制備 接種后3 d、6 d、9 d、12 d、15 d、18 d各取3個重復樣品培養液,過濾經4000 r/min離心機離心15 min上清液即為粗酶液。取少量粗酶液沸水煮10 min,冷卻為空白對照。
1.4 胞外酶活力測定方法測定方法包括:淀粉酶活力測定[8];愈創木酚氧化酶活性測定[9,10];羧甲基纖維素酶(CMC酶)活性的測定[9];漆酶活性的測定[12]采用ABTS法;蛋白質含量的測定[13]采用考馬斯亮藍染色法;還原糖的測定[13]。
1.5 pH與相對電導率的測定分別用pH計和電導率儀對培養液進行測定。
1.6 數據分析采用SPSS數據處理軟件對試驗數據進行差異顯著性和方差分析。
2 結果與分析
2.1 SA對Hg脅迫下金針菇液體培養液中胞外淀粉酶活性的影響圖1顯示,SA能促進Hg脅迫下金針菇胞外淀粉酶活性,而且SA質量濃度越高與空白對照的差異越顯著,SA質量濃度200 mg/L的酶活是所有處理中最高,隨著培養時間的增長,淀粉酶活性先增后減,基本在接種后12 d時活性達到最高;SA低質量濃度(10 mg/L、20 mg/L)處理組均出現小高峰,這與楊暉[8]研究的低質量濃度的水楊酸能促進鎘脅迫下香菇菌絲液體胞外酶活性影響是一致的。
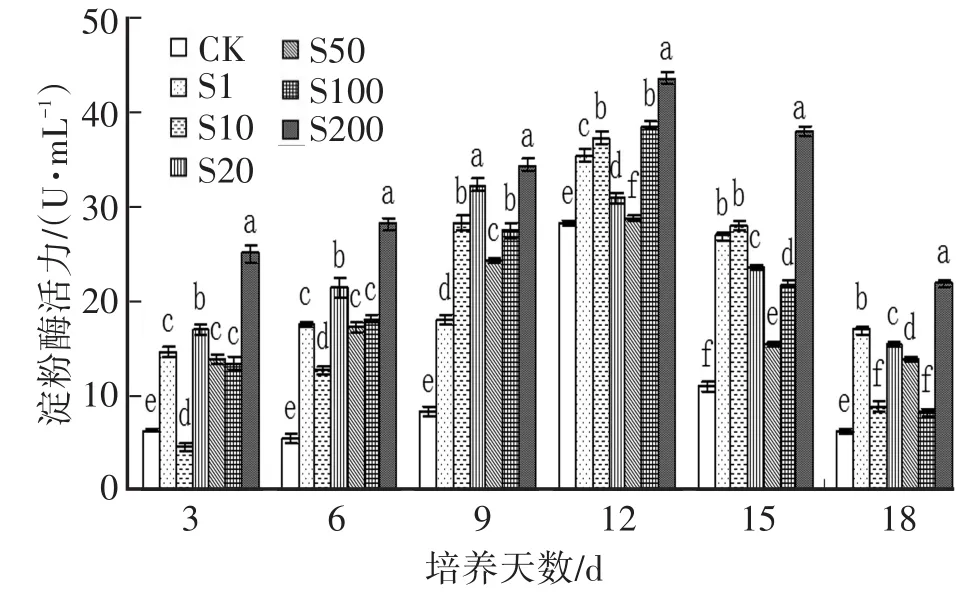
圖1 SA對Hg脅迫下金針菇胞外淀粉酶活性的影響

圖2 SA對Hg脅迫下金針菇胞外愈創木酚酶活性的影響
2.2 SA對Hg脅迫下金針菇液體培養液中胞外愈創木酚酶活性的影響圖2可見,金針菇胞外愈創木酚酶活性各處理組峰值分別出現在12~15 d。高質量濃度SA(≥50 mg/L)對酶活的促進作用最為顯著,50 mg/L處理組酶活性最強,在接種后第12天時出現活力數值8.5 U/mL,低質量濃度SA處理組,酶活力基本都低于空白組;胞外愈創木酚酶活性,各組在第12天出現了峰值。王宜磊等[14]研究表明彩絨革蓋菌在PDY液體培養基中的愈創木酚氧化酶活性第16天高峰有所差異,這也說明不同菌種生長特性各不相同、不同的菌種的愈創木酚氧化酶活時間存在著一定的差異。
2.3 SA對Hg脅迫下金針菇液體培養液中胞外羧甲基纖維素酶(CMC酶)活性的影響CMC酶與金針菇菌絲體對纖維素物質的利用有關,圖3顯示在各處理組CMC酶活分別于接種9~12 d出現了峰值。以SA為20 mg/L在接種12 d時的酶活最高(4.61 U/L);SA為10、50、100 mg/L處理組也表現了較高的酶活性;而1、200 mg/L SA處理組顯著低于對照組。低質量濃度SA(≤50 mg/L)處理組的酶活性均高于對照組,能提高Hg脅迫下金針菇胞外CMC的酶活,其中以20 mg/L SA處理組促進金針菇胞外CMC的誘導最為顯著。

圖3 SA對Hg脅迫下金針菇胞外羧甲基纖維素酶活性的影響
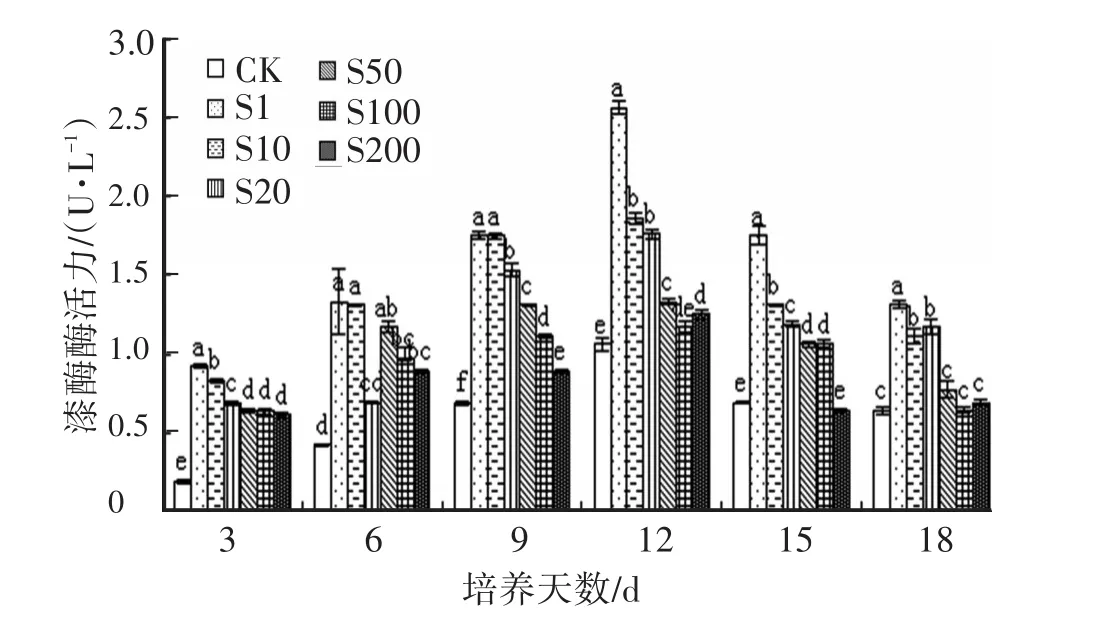
圖4 SA對Hg脅迫下金針菇胞外漆酶活性的影響
2.4 SA對Hg脅迫下金針菇液體培養液中胞外漆酶活性的影響漆酶屬于多銅氧化酶家族中的一大類,在木質素代謝過程中起著重要的作用,酶活性變化和金針菇利用木質素類物質密切相關。圖4可見,各組漆酶的酶活力均在12 d出現了峰值,其中以1 mg/L SA處理組的漆酶的酶活性最高(2.56 U/L),顯著高于對照組和其他處理組,低質量濃度(≤20 mg/L)的SA顯著提高Hg脅迫下金針菇胞外漆酶的活性,這與孫淑靜[15]研究的酶活力峰值相近。
2.5 SA對Hg脅迫下金針菇液體培養液中蛋白質含量的變化粗酶液中的蛋白質主要為酶蛋白。蛋白質濃度的變化可以從總體上反映金針菇胞外酶系的變化過程,各種酶隨著菌絲體適應環境而生長后在其調節機制下迅速生成,對應的蛋白質濃度也會相應增加。各處理組蛋白質質量濃度在接種后第6~12天出現峰值(圖5),低濃度處理能顯著提高汞脅迫下金針菇胞外蛋白含量,且以SA質量濃度為20 mg/L作用最為顯著;SA質量濃度≥50 mg/L處理組的蛋白含量峰值出現在第6天,而對照組和低質量濃度的SA處理組(≤20 mg/L)的蛋白含量峰值出現在第9~12天,低質量濃度處理組要顯著高于空白對照組,其中以20 mg/L,在接種第12天時胞外蛋白質含量最高(0.057 mg/L)。各處理組胞外蛋白的含量峰值與胞外酶活性最強時間基本同步。
2.6 SA對Hg脅迫下金針菇液體培養液中還原糖濃度的變化各個處理組還原糖質量濃度最低值出現在第6~9天,峰值出現在第15天,中高質量濃度SA(≥20 mg/L)處理組,還原糖均顯著高于空白組;SA對Hg脅迫下金針菇各處理組的還原糖質量濃度呈現先下降后上升再下降的趨勢。其原因可能與淀粉酶、CMC酶等在SA的作用下的活性增大有關,第18天隨著各種酶活力的下降培養液中還原糖含量逐漸下降。這與曹春蕾等[16]研究的桑木層孔菌在第9天含量基本為零是一致的。隨著培養時間的推移和生長速度的加快還原糖迅速降低。
2.7 SA對Hg脅迫下金針菇培養液相對電導率和pH變化情況培養過程中酶液的導電性越強,測定的電導率數值就越大,即表示菌液里溶解物就越多[17]。各處理組酶液的相對電導率波動在6980~14 600 s/m,其中以SA質量濃度為20 mg/L接種第12天時測得電導率數值最大;各處理組pH波動在4.8~5.9,高質量濃度SA處理組pH都比空白對照要低,20 mg/L處理組pH始終要比其他的處理組高,這與該濃度下各種酶活的強弱程度成正相關,與培養液里還原糖、蛋白質含量有直接關系,特別是蛋白質含量保持一致趨勢。
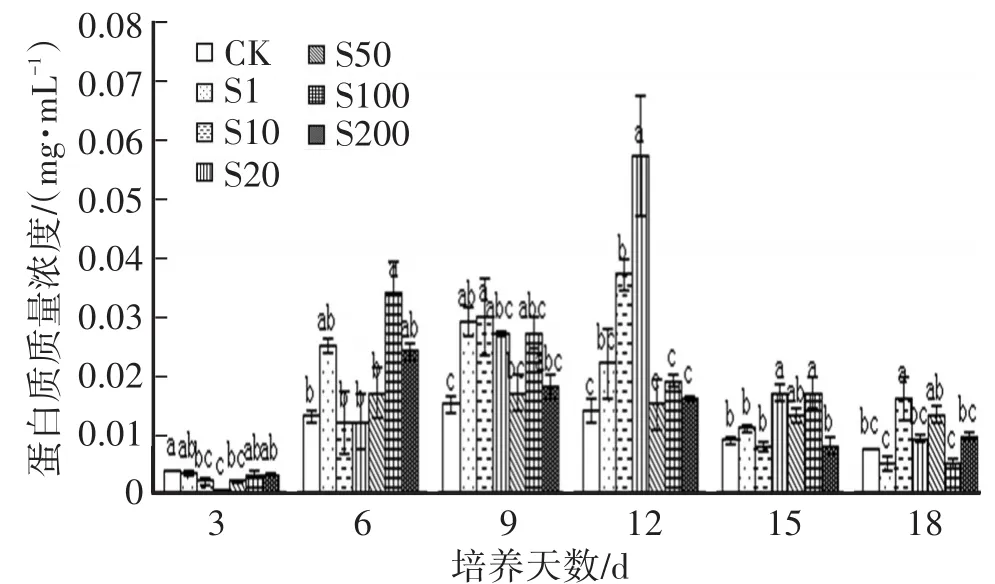
圖5 SA對Hg脅迫下金針菇培養液蛋白質含量變化的影響
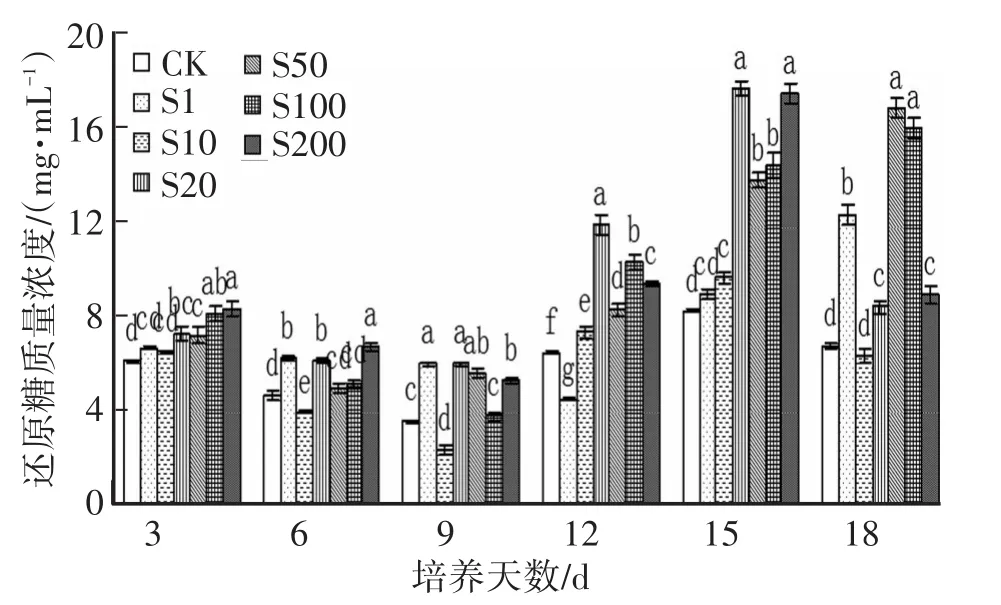
圖6 SA對Hg脅迫下金針菇培養過程中還原糖濃度的變化

圖7 SA對Hg脅迫下金針菇培養液電導率的變化情況
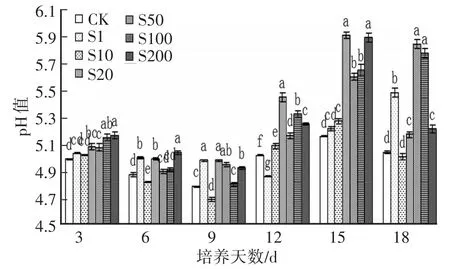
圖8 SA對Hg脅迫下金針菇培養過程中pH的變化
3 小結與展望
在Hg脅迫下SA對金針菇液體培養的胞外酶活性以及還原糖、蛋白質含量等影響起到重要作用,對胞外酶活性有促進作用并且峰值出現在第12~15天。外施SA能緩解Hg對植物的毒害,常云霞等[18]研究表明外施SA能緩解Hg脅迫對幼苗生長的抑制作用;楊暉等[8]研究表明,低質量濃度的SA能促進鎘脅迫下香菇菌絲液體培養胞外酶活性。試驗結果表明:中高質量濃度SA(≥50 mg/L)能顯著地提高金針菇在Hg脅迫下胞外淀粉酶、愈創木酚酶,還原糖含量隨著胞外酶的變化而變化;中低質量濃度SA(≤20 mg/L)能顯著地提高胞外羧甲基纖維酶、漆酶的活性,相對電導率、pH和蛋白質含量均保持著較高的水平;中低質量濃度SA可以緩解重金屬汞對金針菇菌絲的生長抑制作用,且以20 mg/L SA為最理想的緩解中度重金屬對金針菇毒害的濃度。試驗所采用電導法具有分析快速,操作簡便,不消耗樣品與試劑的優勢,在植物研究方面電導法的運用已非常普遍且卓有成就,如植物抗寒性和耐熱性比較等[17],但在食用菌液體培養方面研究較少。水楊酸對鋅、鉻、鎘等重金屬污染下金針菇的生長影響也是有待研究;電導法和pH變化的進一步研究可以為食用菌液體培養研究注入新的方法。

