siRNA抑制Caspase-3表達對內(nèi)毒素誘導肝細胞凋亡的影響
王雪銀,宋獻美,馬云云
(河南醫(yī)學高等專科學校,鄭州451191)
siRNA抑制Caspase-3表達對內(nèi)毒素誘導肝細胞凋亡的影響
王雪銀,宋獻美,馬云云
(河南醫(yī)學高等專科學校,鄭州451191)
目的觀察利用小干擾RNA(siRNA)抑制Caspase-3表達對內(nèi)毒素誘導肝細胞凋亡的影響。方法針對Caspase-3的DNA序列843~1 634 bp設計引物,常規(guī)分子克隆至慢病毒表達載體pLenti-7.1,同時設置空載體為陰性對照;利用Lipofectamine 2000轉(zhuǎn)染至293T細胞,48 h后收獲抑制Caspase-3表達病毒質(zhì)粒V-Caspase-3和空載體病毒質(zhì)粒V-control。將肝細胞HL7702隨機分為觀察組和對照組,分別加入V-Caspase-3、V-control培養(yǎng)4 h,均與終濃度為20 mg/L的內(nèi)毒素共培養(yǎng)12 h。采用Western blotting 法檢測Caspase-3蛋白,流式細胞術(shù)測算細胞凋亡率,原位末端標記技術(shù)測算細胞凋亡指數(shù)(AI),MTT法觀察細胞增殖活力。結(jié)果觀察組HL7702細胞Caspase-3相對表量為17.32±2.16,低于對照組的62.14±4.36(P<0.01);觀察組HL7702細胞凋亡率為28.75%,低于對照組的72.67%(P<0.01);觀察組HL7702細胞AI為23.52±1.24,低于對照組的54.26±1.87(P<0.01);觀察組HL7702細胞增殖率為65.47%±6.24%,高于對照組的41.39%±4.87%(P<0.01)。結(jié)論通過siRNA抑制Caspase-3表達能有效降低內(nèi)毒素誘導的HL7702細胞凋亡,從而增強細胞增殖活性。
小干擾RNA;半胱氨酸蛋白酶3;內(nèi)毒素;肝細胞;細胞凋亡;細胞增殖
肝衰竭是內(nèi)毒素血癥的一個嚴重并發(fā)癥,其發(fā)生率高達85%[1],目前臨床缺乏有效治療措施。內(nèi)毒素是革蘭陰性菌細胞壁外膜的成分,其主要組成部分是脂多糖(LPS)。細菌內(nèi)毒素可誘導多種細胞凋亡,尤其是肝細胞代謝旺盛時最易損傷[2]。研究證實,Caspase-3 是凋亡過程中最重要的蛋白酶, 是多條凋亡途徑的共同下游效應部分,同樣也參與了內(nèi)毒素導致的肝細胞凋亡過程[3,4]。小干擾RNA(siRNA)是對轉(zhuǎn)錄后調(diào)控最重要的手段,因在體內(nèi)的轉(zhuǎn)錄效率和穩(wěn)定性不佳而限制了進一步的開發(fā)利用[5]。慢病毒由于高效的感染效率和體內(nèi)外安全性,已成為新的RNA干擾研究工具。2016年5~12月,我們利用慢病毒介導的siRNA抑制內(nèi)源性的Caspase-3,觀察對內(nèi)毒素所致肝細胞凋亡的影響,為臨床治療提供新的策略。
1 材料與方法
1.1 主要試劑 正常肝細胞株HL7702、293T細胞由本室保存,siRNA慢病毒表達載體pLenti-7.1及包裝載體購自Progema公司,抑制Caspase-3的慢病毒由本室包裝保存,Lipofectamine 2000購自Life Technologies公司;Caspase-3一抗、GAPDH抗體購自Abcam公司,原位末端標記技術(shù)(TUNEL)試劑盒購自羅氏公司,RIPA裂解緩沖液購自Thermo Fisher Scientific公司,BCA蛋白濃度檢測試劑盒購自武漢博士德公司。 RPMI 1640干粉、四氮唑藍(MTT)購自GIBCO公司,LPS(50 mg/瓶)、降脂烷、SDS-PAGE購自Sigma公司,胎牛血清購自天津TBD公司,胰蛋白酶購自華美生物工程有限公司,二甲基亞砜(DMSO)購自生工生物工程(上海)有限公司。
1.2 實驗方法
1.2.1 靶向Caspase-3的siRNA序列設計及病毒質(zhì)粒的制備 利用生物信息學工具選取Caspase-3的DNA序列843~1 634 bp設計引物,上下游引物分別為5′-CGTCGATTTTTGTGATGCTCGTCAG-3′和3′-GAAGCATTTATCAGGGTTATTGTCTCATG-5′;常規(guī)分子克隆至慢病毒表達載體pLenti-7.1,同時設置空載體為陰性對照。利用Lipofectamine 2000轉(zhuǎn)染至293T細胞,48 h后收獲抑制Caspase-3表達病毒質(zhì)粒V-Caspase-3和空載體病毒質(zhì)粒V-control。
1.2.2 HL7702細胞分組轉(zhuǎn)染與內(nèi)毒素干擾 取狀態(tài)良好的HL7702細胞,調(diào)整細胞密度為5×105/mL,隨機分為觀察組和對照組;將細胞接種至12孔板,培養(yǎng)體積為1 mL/孔,置于37 ℃培養(yǎng)箱過夜。取凍存的V-Caspase-3和V-Control,觀察組和對照組均滴加滴度為1010的病毒質(zhì)粒5 μL/孔,37 ℃培養(yǎng)4 h后吸棄培養(yǎng)上清,每孔添加培養(yǎng)基1 mL。兩組均添加內(nèi)毒素使終濃度為20 mg/L,37 ℃培養(yǎng)12 h。
1.2.3 HL7702細胞Caspase-3檢測 采用Western blotting 法。取1.2.2中內(nèi)毒素處理后培養(yǎng)12 h的兩組細胞,按照RIPA裂解緩沖液說明提取細胞總蛋白,利用BCA法測定蛋白濃度。取40 μg細胞總蛋白進行12%的SDS-PAGE電泳,常規(guī)轉(zhuǎn)膜,抗Caspase-3和GAPDH抗體作為一抗4 ℃孵育過夜;常規(guī)二抗室溫避光孵育1 h,TBST洗膜3次。采用Odensey激光紅外掃描儀檢測,以目的蛋白與內(nèi)參條帶的灰度值比值表示蛋白的相對表達量。
1.2.4 HL7702細胞凋亡率測算 采用流式細胞儀。取1.2.2中內(nèi)毒素處理后培養(yǎng)12 h的兩組細胞,進行胰酶消化離心后收集細胞入Eppendorf管;用結(jié)合液2 000 μL洗滌1次后,將細胞懸浮于50 μL結(jié)合液中;加FITC-Annexin V及PI染液各5 μL,混勻后避光冰浴15 min;結(jié)合液洗滌2次后,上流式細胞分析儀檢測凋亡細胞,計算細胞凋亡率。
1.2.5 HL7702細胞的凋亡指數(shù)(AI)測算 采用TUNEL法。取1.2.2中內(nèi)毒素處理后培養(yǎng)12 h的兩組細胞,以5×105/mL接種于12孔板;將細胞用4%多聚甲醛室溫固定10 min,PBS室溫洗3×5 min;每孔細胞滴加TdT標記緩沖液避光室溫孵育60 min,用TdT終止緩沖液室溫作用5 min,PBS室溫洗3×5 min。每孔細胞滴加1 mL的碘化丙啶溶液,室溫孵育15 min,PBS清洗3×5 min。吸棄細胞上清,熒光顯微鏡下被染上熒光的為凋亡細胞,計算各組平均值即為AI。
1.2.6 HL7702細胞增殖能力觀察 采用MTT法。 將對數(shù)生長期的HL7702細胞隨機分為觀察組和對照組,以含10%胎牛血清的RPMI 1640培養(yǎng)液稀釋為8×105/mL,按每孔100 μL接種于96孔板。觀察組和對照組分別加入V-Caspase-3和V-Control病毒顆粒0.6 μL/孔,37 ℃培養(yǎng)6 h;兩組均添加內(nèi)毒素使終濃度為20 mg/L,37 ℃培養(yǎng)12 h;每孔添加10 μL MTT(8 mg/mL),4 h后追加110 μL/孔酸化SDS,12 h后酶聯(lián)免疫檢測儀測A570。細胞增殖率=(1-實驗孔A570/對照孔A570)×100%。
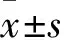
2 結(jié)果
2.1 兩組HL7702細胞Caspase-3表達比較 觀察組HL7702細胞Caspase-3相對表量為17.32±2.16,低于對照組的62.14±4.36(P<0.01)。
2.2 兩組HL7702細胞凋亡率比較 觀察組HL7702細胞凋亡率為28.75%,低于對照組的72.67%(P<0.01)。
2.3 兩組HL7702細胞AI比較 觀察組HL7702細胞AI為23.52±1.24,低于對照組的54.26±1.87(P<0.01)。
2.4 兩組HL7702細胞增殖率比較 觀察組HL7702細胞增殖率為65.47%±6.24%,高于對照組的41.39%±4.87%(P<0.01)。
3 討論
內(nèi)毒素可以通過細菌裂解或黏附在其他細胞上時釋放出來[6],通過激活線粒體依賴途徑和非線粒體依賴途徑誘導多種細胞凋亡。肝臟是體內(nèi)最重要的清除內(nèi)毒素的器官,同時也最容易受到內(nèi)毒素攻擊而產(chǎn)生損傷。內(nèi)毒素誘導的肝臟損傷是多種肝病的主要病理基礎(chǔ)[7],可通過引起大量肝細胞凋亡而導致肝衰竭。
細胞凋亡是細胞在一定的環(huán)境下,由遺傳基因控制的適應性反應,也是保證機體內(nèi)環(huán)境穩(wěn)定的重要手段[8]。適度的細胞凋亡是生理發(fā)育過程中的必要程序,但某些病理條件導致的過度凋亡會引起嚴重的病理過程[9]。細胞凋亡受到多種因素的調(diào)節(jié),腫瘤壞死因子α、轉(zhuǎn)移生長因子、一氧化氮等生物活性介質(zhì)都能影響細胞凋亡的發(fā)生和發(fā)展[10]。研究[11]發(fā)現(xiàn),肝細胞大量凋亡是肝衰竭病理過程中的重要事件。早期的研究[12]發(fā)現(xiàn),內(nèi)毒素可以通過Toll 樣受體4激活單核吞噬細胞產(chǎn)生細胞因子導致肝細胞凋亡;另有研究[13]表明,內(nèi)毒素可以在體外直接誘導肝細胞發(fā)生凋亡。我們前期的研究發(fā)現(xiàn),內(nèi)毒素可以通過激活凋亡受體引起肝細胞凋亡[14]。內(nèi)毒素誘導肝細胞凋亡的具體機制現(xiàn)在還不清楚,因此臨床上仍然缺乏有效的治療方法。
細胞的凋亡程序一旦啟動,胞內(nèi)的相關(guān)凋亡蛋白被激活。Caspase酶家族是凋亡激活過程中最重要的蛋白,其成員包括凋亡起始者Caspase-8、9、10和效應者Caspase-3。Caspase-3是多條細胞凋亡信號的共同下游信號分子,一旦被激活后,可以通過激活一系列的DNA損傷蛋白導致細胞凋亡。我們前期研究也證實,內(nèi)毒素能夠通過激活Caspase-3誘導肝細胞凋亡。因此,干擾內(nèi)源性Caspase-3的功能,減輕內(nèi)毒素誘導的肝細胞凋亡有望為肝損傷的臨床治療提供一種新的策略。本研究利用具有高效穩(wěn)定的慢病毒表達系統(tǒng)成功獲得了能夠抑制內(nèi)源性Caspase-3的病毒質(zhì)粒V-Caspase-3,經(jīng)一系列的生物化學檢測證實抑制內(nèi)源性Caspase-3后可有效降低內(nèi)毒素誘導的HL7702細胞凋亡, 減輕內(nèi)毒素對HL7702細胞增殖活力的影響。因此,抑制內(nèi)源性Caspase-3表達可以有效減輕內(nèi)毒素誘導的肝細胞凋亡,我們也將通過動物實驗進一步證實此觀點,為臨床上治療肝臟損傷提供新的策略。
[1] Bantel H, Schulze-Osthoff K. Mechanisms of cell death in acute liver failure[J]. Front Physiol, 2012,3(2):79-86.
[2] Perego J, Bourbon C, Chasson L, et al. Guanabenz prevents d-galactosamine/lipopolysaccharide-induced liver damage and mortality[J]. Front Immunol, 2017,8(6):679-689.
[3] Fuchs Y, Steller H. Programmed cell death in animal development and disease[J]. Cell, 2011,147(4):742-758.
[4] Hengartner MO. The biochemistry of apoptosis[J]. Nature, 2014,407(6805):770-776.
[5] Zhang Y, Fang L, Zhang Q, et al. An oncolytic adenovirus regulated by a radiation-inducible promoter selectively mediates hSulf-1 gene expression and mutually reinforces antitumor activity of I131-metuximab in hepatocellular carcinoma[J]. Mol Oncol, 2013,7(3):346-358.
[6] Enomoto N, Ikejima K, Bradford BU,et al. Role of Kupffer cells and gut-derived endotoxins in alcoholic liver injury[J]. J Gastroenterol Hepatol, 2012,15(4):20-25.
[7] Kudo H, Takahara T, Yata Y, et al. Lipopolysaccharide triggered TNF-alpha-induced hepatocyte apoptosis in a murine non-alcoholic steatohepatitis model[J]. J Hepatol, 2011,51(1):168-175.
[8] Green DR. The end and after: how dying cells impact the living organism[J]. Immunity, 2011,35(4):441-444.
[9] Green DR, Fitzgerald P. Just so stories about the evolution of apoptosis[J]. Curr Biol, 2016,26(13):620-627.
[10] Rezakhani L, Khazaei MR, Ghanbari A, et al. Crab shell extract induces prostate cancer cell line (LNcap) apoptosis and decreases nitric oxide secretion[J]. Cell J, 2017,19(2):231-237.
[11] Zhang P, Zhang M, Wan M, et al. Tamoxifen attenuates lipopolysaccharide/galactosamine-induced acute liver failure by antagonizing hepatic inflammation and apoptosis [J]. Immunol Invest, 2017,46(3):284-294.
[12] Li T, Hu J, Thomas JA, et al. Differential induction of apoptosis by LPS and taxol in monocytic cells[J]. Mol Immunol, 2005,42(9):1049 -1055.
[13] Chen M, Zhou J, Li H, et al. Effects of endotoxin on liver Smac apoptosis channel[J]. J Huazhong Univ Sci Technolog Med Sci, 2008,28(6):660-664.
[14] 王雪銀,白慧玲,馬遠方,等.死亡受體5在內(nèi)毒素誘導人肝細胞凋亡中的作用[J].現(xiàn)代免疫學,2008, 28(3):89-93.
Effect of siRNA-induced inhibition of Caspase-3 expression on apoptosis of hepatocytes induced by endotoxin
WANGXueyin,SONGXianmei,MAYunyun
(HenanMedicalCollege,Zhengzhou451191,China)
ObjectiveTo investigate the effect of siRNA-induced inhibition of Caspase-3 expression on the apoptosis of hepatocytes induced by endotoxin.MethodsPrimers were designed for DNA sequence 843-1634 bp of Caspase-3. The target sequences was cloned into the lentivires expression vector pLenti-7.3 and empty lentivirus vector was set as a negative control. The virus vector and empty vector were transfected into 293T cells with Lipofectamine2000 liposomes. The virus of V-caspase-3 and V-control was harvested after 48 h. The hepatocytes HL7702 were randomly divided into the observation group and the control group, which were cultured with V-caspase-3 and V-control for 4 h, and then both groups were cultured with 20 mg/L endotoxin for 12 h. The protein expression of Caspase-3 was detected by Western blotting. The apoptosis rate of HL7702 cells was tested by flow cytometry (FACS). The apoptosis index (AI) was detected by terminal deoxynucleotidyl transferase mediated dUTP nick end labeling (TUNEL). The proliferative activity of cells was determined by MTT.ResultsThe relative expression of Caspase-3 in HL7702 cells of the observation group was 17.32±2.16, which was lower than that in the control group (62.14±4.36) (P<0.01). The apoptotic rate of HL7702 cells in the observation group was 28.75%, which was lower than that of the control group (72.67%) (P<0.01). The AI of the observation group was 23.52±1.24, which was higher than that of the control group (54.26±1.87) (P<0.01). The proliferation rate of HL7702 cells in the observation group was 65.47%±6.24%, which was higher than that of the control group (41.39%±4.87%) (P<0.01).ConclusionInhibition of caspase-3 by siRNA can effectively decrease the level of apoptosis of endotoxin-induced hepatocytes HL7702, thereby enhance the cell proliferation activity.
small interfering RNA; Caspase-3; endotoxin; hepatocytes; apoptosis; cell proliferation
10.3969/j.issn.1002-266X.2017.34.003
R575
A
1002-266X(2017)34-0009-03
2017-05-31)
河南省高等學校重點科研項目計劃(15B310006)。
王雪銀(1978-),女,講師,研究方向為免疫學基礎(chǔ)與臨床。E-mail: Wangxueyin219@163.com

