三七總皂苷對擬缺血損傷腦微血管內皮細胞PLA2G4A表達及其下游產物的影響?
蘇 靖,李興廣,李衛紅,胡艷紅,馬家寶,張 賽,胡京紅,王淑艷,姜昭妍
(北京中醫藥大學,北京 100029)
三七總皂苷對擬缺血損傷腦微血管內皮細胞PLA2G4A表達及其下游產物的影響?
蘇 靖,李興廣△,李衛紅△,胡艷紅,馬家寶,張 賽,胡京紅,王淑艷,姜昭妍
(北京中醫藥大學,北京 100029)
目的:觀察三七總皂苷(panax notoginseng saponins,PNS)對擬缺血損傷腦微血管內皮細胞胞漿型磷脂酶 A2IVA (phospholipase A2 group IVA,PLA2G4A)表達及其功能的影響。方法:培養大鼠原代腦微血管內皮細胞,氧糖剝奪法制備擬缺血模型,用三七總皂苷及PLA2G4A抑制劑進行干預,通過RT-PCR和Western blotting法檢測各組PLA2G4A基因及蛋白表達水平,ELISA法檢測各組花生四烯酸(arachidonic acid,AA)、20-羥二十烷四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)、血栓素A2 (thromboxanea2,TXA2)/前列環素(prostaglandin I2,PGI2)表達水平。結果:三七總皂苷可顯著下調PLA2G4A的基因和蛋白表達,對AA、20-HETE、TXA2/PGI2也有下調作用。結論:三七總皂苷可以下調擬缺血損傷腦微血管內皮細胞PLA2G4A及其下游產物的表達,這可能是三七總皂苷在腦缺血損傷中發揮化瘀通絡作用的機制之一。
三七總皂苷;腦微血管內皮細胞;PLA2G4A;AA;20-HETE
傳統中藥三七具有化瘀通絡的功效,臨床廣泛應用于缺血性中風的治療。三七總皂苷(panax notoginseng saponins,PNS)是三七的主要有效組分,研究顯示可以有效改善缺血性腦梗死腦血流狀態,并減少梗死灶體積[1]。本課題組前期通過基因芯片技術篩選,發現PNS對擬缺血損傷的腦微血管內皮細 胞 (brain microvascular endothelialcells,BMECs)胞漿型磷脂酶 A2IVA(phospholipase A2 group IVA,PLA2G4A)mRNA具有顯著下調效果。因此本研究在前期實驗基礎上,觀察了 PNS對BMECs的PLA2G4A基因和蛋白表達的影響,并以PLA2G4A抑制劑為對照,觀察PNS對PLA2G4A下游產物花生四烯酸(arachidonic acid,AA)、20-羥二十烷四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)、血栓素A2(thromboxaneA2,TXA2)/前列環素(prostaglandin I2,PGI2)的調節作用,以期揭示PNS在腦缺血中發揮化瘀通絡作用的分子機制。
1 方法
1.1 大鼠原代BMECs培養
按本課題組已建立的方法進行原代BMECs培養[2],用SD大鼠幼鼠(斯貝福公司)進行取材,將幼鼠鍘頭后取出大腦皮質,研磨并用200目濾膜過濾,刮取濾膜上的濾出物,離心沖洗后得到原代BMECs細胞種于培養瓶中,傳至第三代純度達90%以上時使用。
1.2 氧糖剝奪法(oxygen-glucose-deprived,OGD)制備擬缺血損傷模型
按本課題組已建立的方法制備BMECs擬缺血損傷模型[3],向第三代BMECs中加入無糖Kerb’s液,后置于氣體成分為94%N2、5%CO2、1%O2的三氣培養箱中培養6 h。
1.3 PLA2G4A抑制劑濃度篩選
PLA2G4A抑制劑選用Pyrrophenone(Cayman),其可特異抑制PLA2G4A活性并下調下游產物花生四烯酸的(Arachidonic Acid,AA)生成[4]。實驗設置1、2、4、8、16、32、64 μg/ml 7個濃度,每個濃度設8個復孔,同時設置模型組與空白組。將第三代BMEC均勻接種于24孔板,貼壁面積達90%以上使用。OGD造模前2 h給藥,造模結束后用ELISA法測各組AA含量,計算出Pyrrophenone對AA的半數抑制量為12.86 μg/ml。
1.4 分組與處理
首先將培養至第三代的BMECs分為正常組、模型組、PNS組3組。正常組不做處理,其余2組按上述方法造模。PNS組造模前2 h給予22 μg/ml PNS(前期實驗證實PNS最佳濃度為22 μg/ml[5]),觀察PNS對擬缺血BMECs PLA2G4A mRNA及蛋白表達的影響,以驗證基因芯片結果。然后利用PLA2G4A抑制劑Pyrrophenon做對照,觀察PNS對PLA2G4A下游的影響。將內皮細胞分為正常組、模型組、Pyrrophenon組、PNS組4組。Pyrrophenon組在造模前2 h按照12.86 μg/ml濃度加入 Pyrrophenone,PNS組加藥情況同上。
1.5 RT-PCR法檢測PLA2G4A mRNA表達量
3組細胞處理結束后用Trizol提取總RNA,通過cDNA逆轉錄試劑盒(Thermo Scientific)進行逆轉錄,之后擴增后在PCR檢測儀上測定PLA2G4A的mRNA表達水平,結果用2-△△ct法表示。PCR引物如下,PLA2G4AF端:TTTGGGAGTTTCTGG CTCAC,R 端 TCTTCATTCTCGGTGCCTTT;內 參 F端: TATCGGCAATGCCTCTTGAATG,R端:AGCACT GTTGGCATAGAGG。
1.6 Western Blotting檢測PLA2G4A蛋白表達
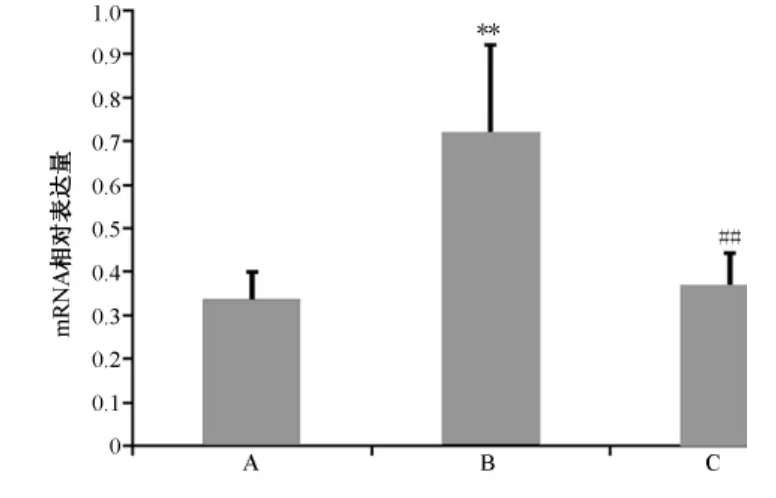
圖1 各組細胞PLA2G4A mRNA表達量
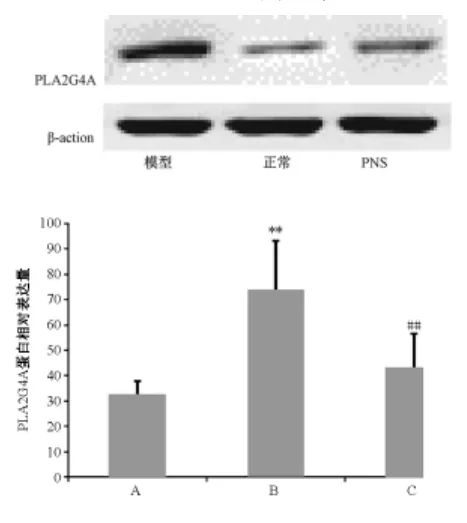
圖2 各組細胞PLA2G4A蛋白表達量
3組細胞處理結束后,使用裂解液收集細胞,用超聲細胞破碎機破碎后4℃離心處理并收集上清,BCA法測定蛋白濃度。配聚丙烯酞胺膠后蛋白上樣電泳并轉膜,用5%脫脂牛奶封閉1 h,洗膜后加入1∶1000稀釋的PLA2G4A山羊一抗(Sigma)4℃過夜,次日洗膜后加入1∶5000稀釋的兔抗山羊二抗(Sigma)孵育顯色并照相,使用ImageJ軟件進行灰度分析。
1.7 ELISA法測定AA、20-HETE、TXA2/PGI2表達
按照elisa試劑盒(Abcam)說明書加入細胞裂解液后離心提取上清,提取樣本后測定各組AA、20-HETE、TXA2、PGI2濃度。
1.8 統計學方法
采用SPSS 20.0統計軟件進行統計分析,數據以均差±標準差(ˉ±s)表示,P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞PLA2G4A mRNA表達
圖1顯示,與正常組比較,模型組PLA2G4mRNA表達明顯上升(P<0.01);與模型組比較;PNS組PLA2G4A mRNA的表達明顯下降(P <0.01)。
2.2 各組BMECs PLA2G4A蛋白表達
圖2顯示,與正常組比較,模型組PLA2G4A蛋白表達量明顯增加(P<0.01);與模型組比較,PNS 組PLA2G4A蛋白表達明顯降低(P<0.01)。
2.3 Elisa法測BMECs的AA含量
圖3顯示,與正常組比較,模型組AA表達量明顯增加(P<0.01);與模型組比較,PNS組AA表達明顯降低(P<0.01)。
2.4 各組BMECs的TXA2/PGI2變化
圖4顯示,與正常組比較,模型組TXA2/PGI2比例增高(P<0.05);與模型組比較,PNS組及抑制劑組TXA2/PGI2比例降低(P<0.05)
2.5 各組BMECs的20-HETE含量
圖5顯示,與正常組比較,模型組20-HETE表達明顯增高(P<0.01);與模型組比較,PNS組及抑制劑組20-HETE表達明顯降低(P<0.01)
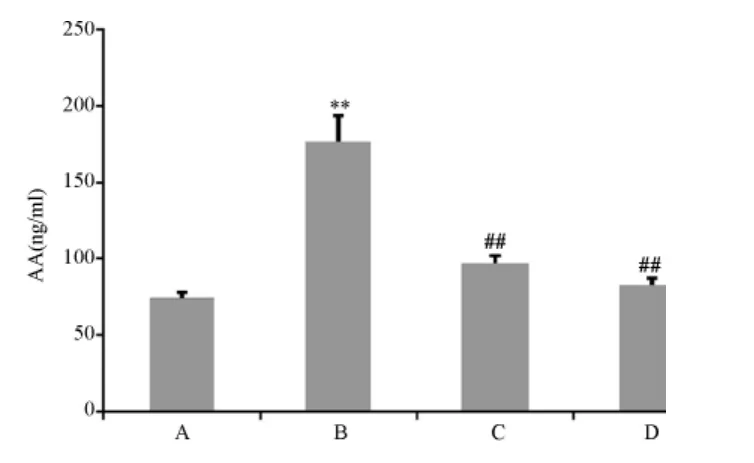
圖3 各組細胞AA蛋白表達量
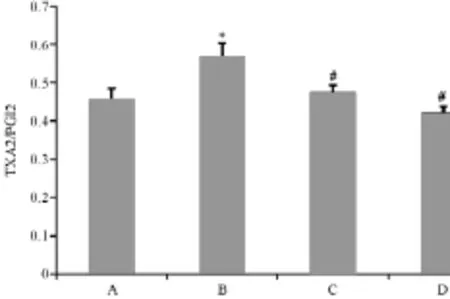
圖4 各組細胞TXA2/PGI2
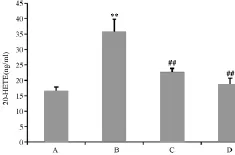
圖5 各組細胞20-HETE表達量
3 討論
PLA2G4A是胞漿型磷脂酶 A2的最主要亞型[6],也是催化包膜磷脂水解生成AA的關鍵蛋白[7]。隨著研究深入,其在腫瘤、炎癥等領域的作用相繼被發現[8-9],但該蛋白在腦微血管內皮的研究卻鮮有報道。
本課題組通過基因芯片篩查發現,BMECs經OGD造模后,PLA2G4A mRNA表達升高。因此本實驗采用PCR、Western bolting法測定PLA2G4A的基因蛋白表達。結果顯示該蛋白在造模后表達上調,提示其可能參與缺血后的病理進程。再以ELISA法檢測其下游產物 AA、20-HETE、TXA2/ PGI2的表達情況
AA是細胞膜被PLA2G4A分解后的產物,在腦缺血時過表達,其下游代謝產物廣泛參與凝血、炎癥等多種病理進程。20-HETE是AA的代謝產物,具有強烈收縮血管作用,Marija Renic等發現抑制20-HETE表達可改善梗死后腦血流狀態并減少梗死灶體積[10]。TXA2/PGI2是一對呈拮抗作用的AA代謝產物,分別具有促/抗凝血作用,其比例影響著血小板的黏附性,該比例使血小板黏附性增強,血液黏度增大。
實驗結果顯示,OGD造模后 BMECs中PLA2G4A基因、蛋白及其下游產物AA、20-HETE、TXA2、PGI2均過表達,提示PLA2G4A基因的高表達可能導致PLA2G4A蛋白的合成增加,加速胞膜水解生成AA。AA含量升高進一步導致其下游產物20-HETE、TXA2、PGI2過表達。20-HETE過表達會導致血管痙攣收縮,引起血管管徑狹窄形狀迂曲,增加血流阻力降低血液流速;TXA2/PGI2比例升高會使血小板黏附性增強,增加血液黏度,以上變化最終導致血液流動性變差,血液黏度變大,使腦缺血時腦血管內凝血及血栓形成率上升,也提示PLA2G4A的過表達可能是導致腦缺血后血管痙攣及血液高凝狀態的內在機制之一。實驗中,PNS則表現出下調PLA2G4A基因、蛋白及其下游產物AA、20-HETE、 TXA2/PGI2的作用,提示PNS對該通路的下調作用可能可以發揮緩解血管痙攣、降低血液黏度的效果,這可能是PNS在腦缺血治療中發揮化瘀通絡作用的機制之一。
[1]韓淑燕,李海霞,文宗曜,等.三七總皂苷對急性血瘀大鼠血液流變學的改善作用[J].中國藥理學與毒理學雜志,2009,3:183-187.
[2]李衛紅,李澎濤,華茜,等.不同內皮細胞條件培養液對皮層神經元線粒體功能的影響及通絡救腦注射液的保護作用[J].中國中西醫結合雜志,2007,2:131-134.
[3]朱元,李澎濤,李衛紅,等.不同狀態的大鼠星形膠質細胞條件培養液對腦微血管內皮細胞血腦屏障特征性酶的影響[J].世界科學技術:中醫藥現代化,2012,2:1393-1398.
[4]N FLAMAND,S PICARD,L LEMIEUX,et al.Effects of pyrrophenone,an inhibitor of groupIV Aphospholipase A2,on eicosanoid and PAF biosynthesis n human neutrophils[J].British Journal of Pharmacology,2006,149:385-392.
[5]郭曉謹,李興廣,李衛紅,等.三七、梔子組分配伍對擬缺血損傷腦微血管內皮細胞氧化應激反應的影響[J].中國中醫基礎醫學雜志,2014,2:215-216.
[6] AKHLAQ A.FAROOQUI,WEI-YIONG,LLOYD A.Horrocks. Inhibitors of Brain Phospholipase A2 Activity:Their Neuropharmacological Effects and Therapeutic Importance for the Treatment of Neurologic Disorders[J].Pharmacol Rev,2006,58:591-620.
[7] YOSHIHIRO KITA,TAKAYO OHTO,NAONORI UOZUMI,et al.Biochemicalproperties and pathophysiologicalroles of cytosolic phospholipase A2s[J].Biochim Biophys Acta,2006,1761(11):1317-22.
[8]RISTO KERKEL?,et al.Cytosolic phospholipaseA2α protects against ischemia/reperfusion injury in the heart[J].Clin Transl Sci,2011,4(4):236-242.
[9] LINKOUS AG,YAZLOVITSKAYA EM,HALLAHAN DE. Cytosolic phospholipase A2 and lysophospholipids in tumor angiogenesis[J].Natl Cancer Inst,2010,102(18):1398-1412.
[10] MARIJA RENIC,JUDITH A KLAUS,TOMOHIRO OMURA. Effect of 20-HETE inhibition on infarct volume and cerebral blood flow after transient middle cerebral artery occlusion[J].Cereb Blood Flow MeTab,2009,29(3):629.
The Effects of PNS on the PLA2G4A And it’s Downstream Products in Mimic Ischemic Brain Microvascular Endothelial Cells
SU Jing,LI Xing-guang△,LI Wei-hong△,HU Yan-hong,MA Jia-bao,ZHANG Sai,HU Jing-hong,WANG Shu-yan,KANG So-yeon
(Beijing University of Chinese Medicine,Beijing 100029,China)
Objective to evaluate the effects of Panax Notoginseng Saponins(PNS)on the PLA2G4A in Mimic ischemia brain microvascular endothelial cells(BMECs).Methods:primary rat BMECs were used and mimic cerebral ischemia in vitro was established by oxygen-glucose-deprived(OGD)method.OGD-induced BMECs were treated with PNS and Pyrrophenone(PLA2G4A inhibitor)respectively.The expression of PLA2G4A in mRNA and protein were detected by RT-PCR and Western blot methods.The expression of AA 20-HETE TXA2/PGI2 were detected by Elisa method.Results: both mRNA and protein expression of PLA2G4A in OGD-induced BMECs were down-regulated by PNS.AA 20-HETE TXA2/PGI2 were also decreased in administration group.Conclusion:PNS can down regulate the expression and function of PLA2G4A,which may be the internal mechanism of PNS’s Anticoagulant effect in cerebral ischemia.
Panax Notoginseng Saponins;brain microvascular endothelial cells;PLA2G4A;AA;20-HETE
R285.5
B
1006-3250(2017)02-0196-03
2016-07-19
國家自然科學基金資助項目(81273885)
蘇 靖(1989-),男,在讀碩士,從事中藥藥理的臨床與研究。
△
李興廣,男,教授,主任醫師,碩士研究生導師,Tel:13621008162,E-mail:lixingguan@hotmail.com;李衛紅,女,副教授,副主任醫師,碩士研究生導師,Tel:010-64286982,E-mail:liweihong.403@163.com。

