新疆油雞H9N2亞型禽流感病毒PB1基因的克隆與序列分析
[KH-*D]武軍元,黃忠武,康強,姚禮文
(1.塔里木大學,新疆阿拉爾843300;2.新疆生產建設兵團塔里木畜牧科技重點實驗室,新疆阿拉爾843300;3.新疆庫車縣動物疾病預防控制中心,新疆庫車842000;4.阿克蘇地區動物疫病控制診斷中心,新疆阿克蘇843000;5.新疆阿瓦提縣畜禽改良站,新疆阿瓦提843200)
新疆油雞H9N2亞型禽流感病毒PB1基因的克隆與序列分析
[KH-*3D]武軍元1,2,黃忠武3,康強4,姚禮文5
(1.塔里木大學,新疆阿拉爾843300;2.新疆生產建設兵團塔里木畜牧科技重點實驗室,新疆阿拉爾843300;3.新疆庫車縣動物疾病預防控制中心,新疆庫車842000;4.阿克蘇地區動物疫病控制診斷中心,新疆阿克蘇843000;5.新疆阿瓦提縣畜禽改良站,新疆阿瓦提843200)
為了闡明新疆油雞H9亞型流感病毒PB1基因的分子特征與進化趨勢,本研究采用RT-PCR技術對新疆油雞分離株A/ Chicken/XinjiangBaicheng/1/2014(H9N2)的PB1基因進行了克隆、測序及分子進化分析,將PB1基因的核苷酸序列和對應的氨基酸序列與Genbank中已經公布的參考序列進行同源性比較。結果表明,新疆油雞分離株的PB1基因由2274個堿基組成,編碼757個氨基酸,與AIV A/chicken/Henan/89/2013(H7N9)的PB1基因處于同一分支,其核苷酸和氨基酸水平的同源性依次為99.2%和99.4%,新疆油雞分離株的PB1基因不屬于歐亞分支G1、A/CK/BJ/94和Y439的任何譜系。
流感病毒;油雞;聚合酶PB1基因;克隆;序列分析
A型流感病毒是威脅人類健康的重要病原體之一,根據其表面蛋白血凝素(Hemagglutinin,HA)和神經氨酸酶(Neuraminidase,NA)的不同,可以將其分為多種血清型。流感病毒的8個基因片段分別編碼11種不同的蛋白質,RNA聚合酶是由流感病毒基因組3個最大的片段PB1、PB2和PA編碼的異源三聚體復合物,其中,PB1是病毒RNA聚合酶的催化亞基,負責病毒RNA的復制以及轉錄[1]。在流感病毒的重配中,PB1蛋白及病毒表面糖蛋白經常發生重排,這種重排能通過提高流感病毒的適應性而成為感染動物乃至人類的優勢毒株[2]。20世紀,導致人類4次流感大流行的病毒株中有2次是因PB1基因來自于禽類而形成重排病毒引起[3],因此,禽源流感病毒PB1基因的進化趨勢在流感病毒的分子流行病學研究中具有重要的作用。本研究對從新疆油雞當中分離到的1株H9N2亞型禽流感病毒的PB1基因進行了克隆測序及分子進化分析,以了解新疆油雞H9N2亞型AIV PB1基因的遺傳進化情況。
1 材料與方法
1.1 供試材料
1.1.1 病毒H9N2亞型禽流感病毒新疆油雞分離株A/Chicken/XinjiangBaicheng/1/2014(H9N2) (簡稱Xj14)于新疆生產建設兵團塔里木畜牧科技重點實驗室分離保存。
1.1.2 主要試劑及儀器設備High Pure Viral RNA Kit(Cat.No.11858882001)購自Roche公司、PrimeScriptTMII First-strand cDNA Synthesis Kit(Cat.No:6210A)購自寶生物工程(大連)有限公司、HiPure Gel Pure DNA Kits購自Magen公司、pGEM-T Easy Vector購自Promega公司、Trans 2K DNA Markers,Trans Taq-T DNA Polymerase購自北京全式金生物技術有限公司、TIANprep Mini Plasmid Kit購自天根生化科技有限公司。梯度PCR儀、全自動凝膠成像分析系統、高速離心機為德國Eppendorf公司。
1.2 試驗方法
1.2.1 引物設計參照已知的AIV序列設計了1條反轉錄通用引物Uni 12,用于AIV各片段的反轉錄擴增,序列如下:Uni 12:5'-AGCAAAAGCAGG-3'。
參考NCBI公布的H9N2亞型AIV的PB1基因序列,利用Primer premier 5.0軟件設計一對基因特異性引物,引物由上海生工生物工程技術服務有限公司合成,序列如下:Bm-PB1-1:5'-TATTCGTCTCAGGGAGCAAAAGCAGGCA-3';Bm-PB1-2:5'-ATATCGTCTCGTATTAGTAGAAACAAGGCATTT-3'。
1.2.2 病毒RNA提取及PB1基因RT-PCR擴增取200 μl尿囊液,按照Roche公司的High Pure Viral RNA Kit(Cat.No.11858882001)說明書提取病毒RNA,用流感病毒反轉錄通用引物Uni-12,按照PrimeScriptTMII First-strand cDNA Synthesis Kit(Cat.No:6210A)說明書反轉錄合成cDNA。用所設計的PB1的基因特異性引物進行PCR擴增,采用50 μl的反應體系,組成如下:10×PCR緩沖液5 μl,10 mM dNTPs 4 μl,Taq DNA聚合酶(5 U)0.5 μl,上下游引物各1 μl(10 μM),cDNA模板1 μl,無RNA酶的水37.5 μl。反應條件:95℃,5 min;隨后進行如下35個循環:95℃40 s,53℃40 s,72℃3.5 min;最后一個循環結束時72℃10 min。PCR反應結束后,取5 μl反應產物在1.2%瓊脂糖凝膠上電泳,在紫外燈下觀察結果。
1.2.3 PB1基因克隆與序列測定參照HiPure Gel Pure DNA Kits說明書將RT-PCR產物純化回收,回收產物克隆到pGEM-T Easy Vector上,將連接產物轉化DH5a感受態細胞,選擇PCR鑒定為陽性的重組質粒送北京擎科武漢測序部進行序列測定。
1.2.4 PB1基因進化生物學分析應用序列分析軟件DNAStar對測序結果進行拼接處理,將所得序列與GenBank中公布的H9N2亞型流感病毒典型代表株(表1)的PB1基因序列進行同源性比較,用MEGA6軟件的neighbour-joining方法構建進化樹,分析其遺傳進化關系。
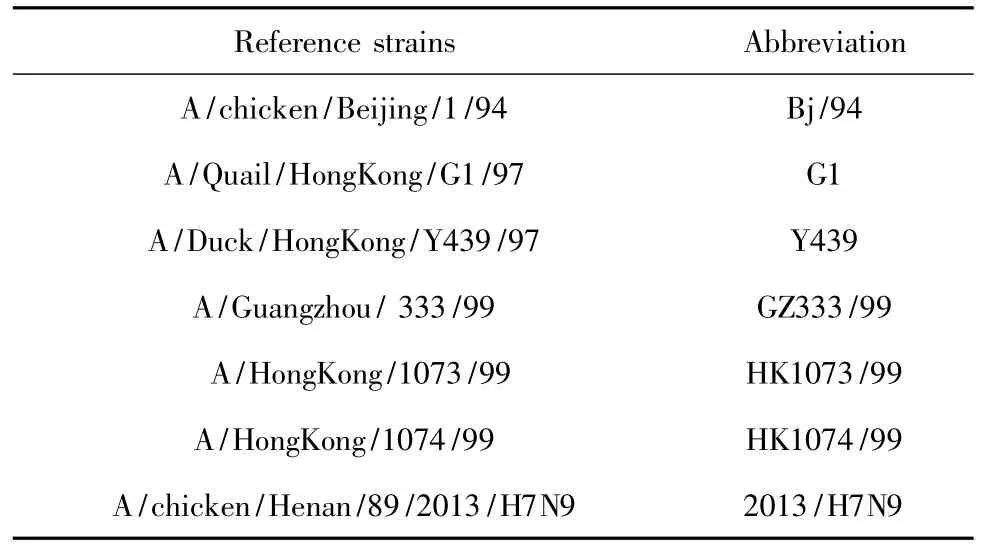
表1 同源性分析的參考毒株Table 1Reference strains used in nucleotide sequence identity analysis
2 結果與分析
2.1 PB1基因的RT-PCR擴增
利用設計針對PB1基因的特異性引物Bm-PB1-1/Bm-PB1-2進行PCR,擴增產物經1.2%的瓊脂糖凝膠電泳檢測,結果顯示,分離株PB1基因在2300 bp左右有一條特異條帶,與預期大小一致(圖1)。
2.2 PB1基因的核苷酸及氨基酸序列同源性分析
測序結果表明,本研究擴增的PB1基因開放閱讀框由2274個堿基組成,編碼757個氨基酸,將擴增的核酸序列提交NCBI數據庫獲得GenBank登錄號KX602186。將本研究分離毒株與GenBank公布的其它毒株進行核苷酸和氨基酸序列同源性比較,結果發現,本研究分離毒株的核苷酸和氨基酸序列均與A/chicken/Henan/89/2013(H7N9)具有較高的同源性,其核苷酸和氨基酸水平的同源性依次為99.2%和99.4(表2)。
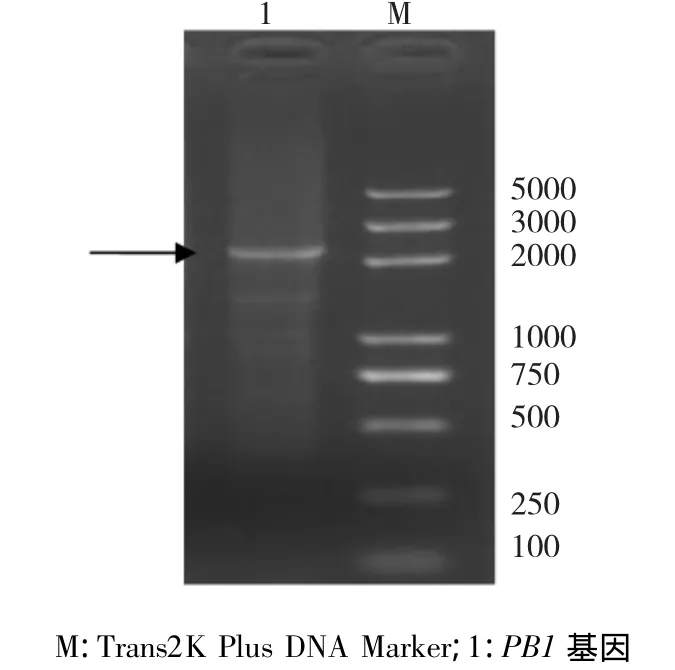
圖1 PB1基因的RT-PCR擴增Fig.1RT-PCR amplification of PB1 gene
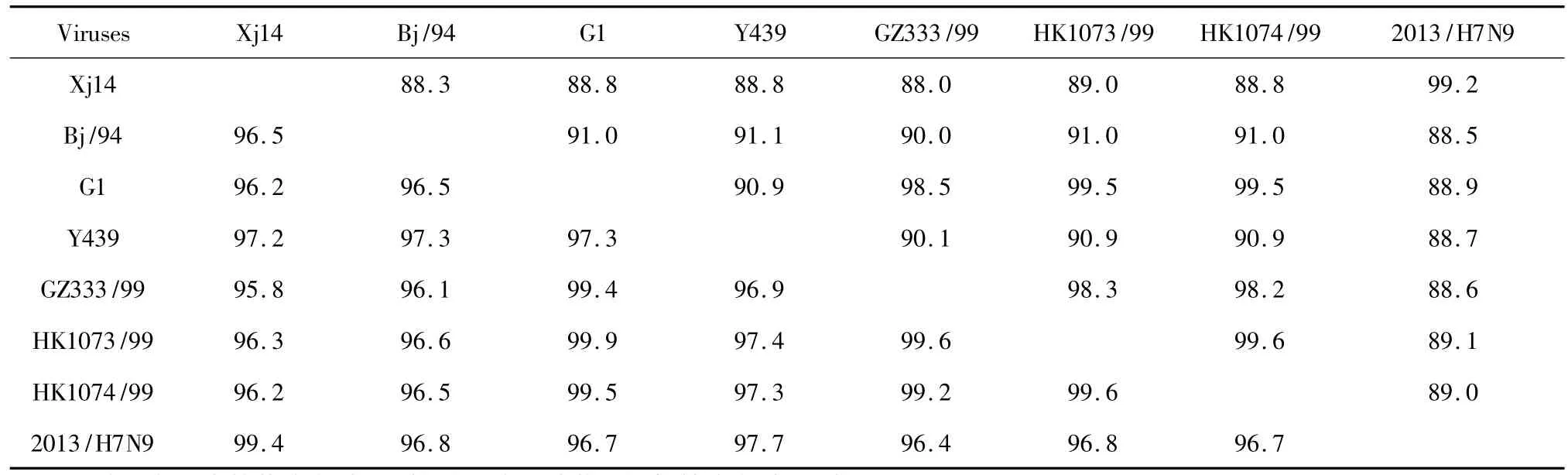
表2 分離毒株與參考毒株PB1基因核苷酸和氨基酸同源性比較Table 2Homology of PB1 genes of isolated strain and reference strains(%)
2.3 PB1基因的系統進化分析
將本研究分離毒株與國內流行毒株的PB1基因進行多序列比對并繪制系統發育進化樹(圖2),分離毒株Xj14的PB1基因與國內參考毒株A/ chicken/Henan/89/2013(H7N9)的親緣關系最近。
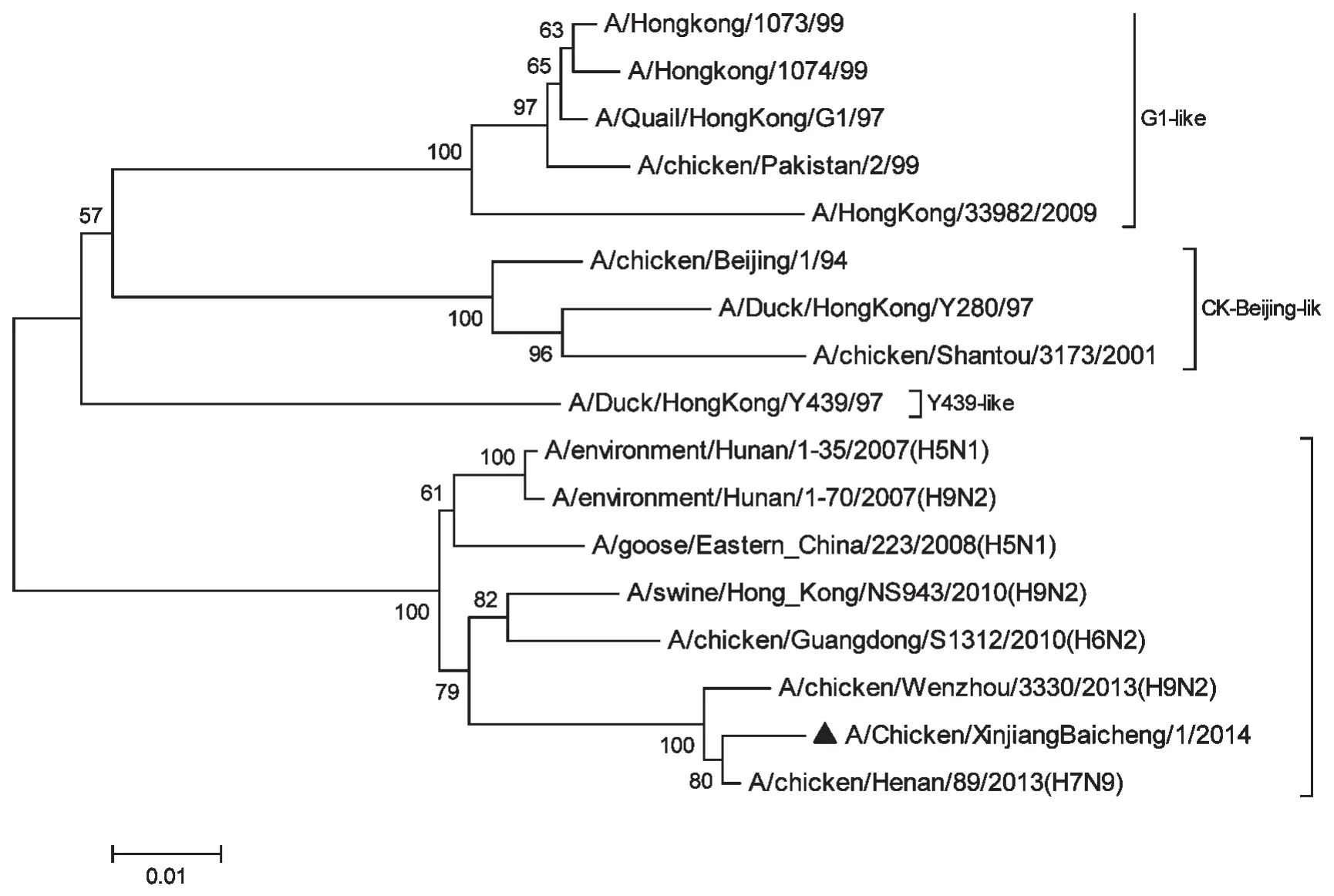
圖2 PB1基因系統進化樹Fig.2Phylogenetic tree based on PB1 gene
3 討論
禽流感(Avian influenza,AI)是由A型流感病毒(Avian influenza virus,AIV)引起的病毒性傳染病,血清亞型眾多,遺傳變異程度極其頻繁,中國1994年首次從廣東省的發病雞群中分離到H9N2亞型禽流感病毒[4-5],1998年我國首先報道H9N2亞型AIV可以感染人[6],1999年中國香港地區發生了人感染H9N2的病例[7]。進一步研究表明,1997年中國香港地區感染人的H5N1病毒的內部蛋白基因片段來源于H9N2亞型AIV[8],2013年發生于中國上海等地的重配病毒H7N9其6個內部基因均來自H9N2亞型AIV[9],劉金華[10]等近期發表在PNAS的研究揭示單一基因型H9N2流感病毒在我國雞群中的優勢流行為H7N9流感病毒的重排提供了充分條件。由此可見,H9N2流感病毒可以通過基因重組或重配產生新的對哺乳動物甚至人類高致病力的病毒株,因此,加強對H9N2亞型AIV的檢測,密切關注其重配情況,進一步對其生物學特性以及分子流行病學研究,對于預測和防控流感大流行的發生具有不可忽視的作用。
禽流感病毒依據HA和NA基因的分子進化特征可以分為北美和歐亞兩大譜系,歐亞譜系又進一步分為A/CK/BJ/94、G1/97和Y439/97 3個亞分支[11],AIV的HA、NA、NP、M、PB1、PB2和PA進化情況相似。本室前期的研究結果顯示新疆油雞分離株Xj14的HA和NA基因均屬于國內穩定存在的BJ/94亞分支,且從分子水平上證實Xj14為低致病力的毒株,只是HA在關鍵位點出現Q234L的突變,NA基因在3個紅細胞吸附區域發生多處突變,HA和NA基因的糖基化位點均有所增加,這種受體結合位點的改變和潛在糖基化位點的增加可能使之在進化過程中獲得跨種傳播的能力[12]。本研究發現,新疆油雞分離毒株Xj14的PB1基因與2013年家禽中分離的A/chicken/Henan/89/2013(H7N9)具有高度同源性,遺傳進化處于同一分支,而與國內流行的歐亞譜系分支A/CK/BJ/94、G1/97和Y439/97均不處在相同的分支,遺傳進化距離較遠。以往認為,H7亞型流感病毒只在禽類中流行,2013年2月底,我國東部省市地區首次陸續發現了H7N9甲型禽流感病毒感染人的病例[13],進一步研究表明,H7N9亞型流感病毒能夠發生人與人之間的感染[14]。新疆油雞分離株Xj14是歐亞譜系以及來自歐亞譜系之外的不同病毒重排的新毒株,其內部基因片段PB1與目前感染人的H7N9亞型流感病毒遺傳距離最接近,這一進化趨勢很有可能是本研究分離毒株獲得致病性的主要原因。
綜上所述,應當加強邊疆新疆地區H9N2亞型AIV監控的力度,慎防重排的H9N2亞型致病毒株感染人群。
[1]Li M L,Rao P,Krug R.The active sites of the influenza capdependent endonuclease are one different polymerase subunits[J].EMBO J, 2001,20:2078-2086.
[2]Gíria M,de Andrade H.Genetic evolution of PB1 in the zoonotic transmission of influenza A(H1)virus[J].Infect Genet Evol,2014,27:234-243.
[3]Kawaoka Y,Krauss S,Webster R G.Avian-to-human transmission of the PB1 gene of influenza A viruses in the 1957 and 1968 pandemics[J].J Virol,1989,63:4603-4608.
[4]Wang J Y,Ren J J,Liu W H,et al.Complete genome sequence of a new H9N2 avian influenza virus isolated in China[J].Genome Announc,2013,1(3):eoo261-13.
[5]陳伯倫,張澤紀,陳偉斌.禽流感研究I.雞A型禽流感病毒的分離與血清學初步鑒定[J].中國獸醫雜志,1994(10):3-5.
[6]Guo Yuan-ji,Li Jian-guo,Cheng Xiao-wen.Discovery of humans infected by avian influenza A(H9N2)virus[J].Chin J Exp Clin Virol,1999,15:105-108.
[7]Peiris M,Yuen K Y,Leung C W,et al.Human infection with influenza H9N2[J].The Lancet,1999,354(9182):916-917.
[8]Liu J H,Okazaki K,Ozaki H,et al.H9N2 influenza viruses prevalent in poultry in China are phylogenetically distinct from A/quail/Hong Kong/G1/97 presumed to be the donor of the internal protein genes of the H5N1 Hong Kong/97 virus[J].Avian Pathology,2003,32 (5):551-560.
[9]Gao R,Cao B,Hu Y,et al.Human influenza with a novel avian-origin influenza A(H7N9)virus[J].N Engal J Med,2013,368(20):1888-1897.
[10]Pu J,Wang S,Yin Y,et al.Evolution of the H9N2 influenza genotype that facilitated the genesis of the novel H7N9 virus[J].Proc Natl Acad Sci USA,2015,112(2):548-553.
[11]Bi J,Deng G,Dong J,et al.Phylogenetic and molecular characterization of H9N2 influenza isolates from chickens in Northern China from 2007-2009[J].PLoS One,2010,5(9):13063.
[12]武軍元,康強.新疆油雞H9N2亞型禽流感病毒分離株HA和NA基因的克隆及進化生物信息分析[J].中國獸醫學報,2016,36(4):623-629.
[13]劉春艷,艾軍紅.甲型H7N9禽流感病毒的病毒學特征[J].中國當代兒科雜志,2013,15(6):405-408.
[14]Koopmans M,de Jong M D.Avian influenza A H7N9 in Zhejiang,China[J].Lancet,2013,381(9881):1882-1883.
(責任編輯 陳虹)
Cloning and Sequence Analysis of PB1 Gene of H9N2 Subtype Avian Influenza Viruses Isolated from Xinjiang Soy Sauce Chicken
WU Jun-yuan1,2,HUANG Zhong-wu3,KANG Qiang4,YAO Li-wen5
(1.Tarim University,Alar,Xinjiang 843300,China;2.Key Laboratory of Tarim Animal Husbandry Science and Technology of Xinjiang Production&Construction Corps,Xinjiang Alar 843300,China;3.Animal Centers for Disease Control and Prevention of Kuche County,Kuche,Xinjiang 842000,China;4.Animal Centers for Disease Control and Prevention of Aksu,Xinjiang Aksu 843000,China;5.Animal Hatchery of Awati County,Xinjiang Awati 843200,China)
In this study,the PB1 gene of H9N2 subtype avian influenza viruses isolated from Xinjiang soy sauce chicken was amplified by RT-PCR,and molecular characteristics were analyzed to reveal the evolutionary trend of PB1 genes.The homology of nucleotide sequences and putative amino acid sequences were compared with several reference strains.The result showed that the cDNA contains whole open reading frame of PB1 gene,2274 nucleotide,coding 757 amino acides.The PB1 gene isolated strain was on the same branch with A/chicken/ Henan/89/2013(H7N9),the nucleotide and amino acids homologies of PB1 gene between isolated strain and A/chicken/Henan/89/2013 (H7N9)were 99.2%and 99.4%,and the isolated strain belong to none of the branch G1,A/CK/BJ/94 and Y439 of Eurasian lineage.
Influenza viruse;Soy sauce chicken;PB1 polymerase gene;Clone;Sequence analysis
S852.65
A
1001-4829(2017)1-0222-04
10.16213/j.cnki.scjas.2017.1.038
2016-07-27
國家自然科學基金(31160513)
武軍元(1980-),男,副教授,博士,從事預防獸醫學教學與科研工作,*為通訊作者,E-mail:wjyn-w@126。

