銀杏內酯B對阿爾茨海默病大鼠海馬c-fos、Caspase-3和Caspase-8的影響
郝 莉,徐玉英,田新紅,游言文,奚肇慶
銀杏內酯B對阿爾茨海默病大鼠海馬c-fos、Caspase-3和Caspase-8的影響
郝 莉1,2,徐玉英2,田新紅2,游言文2,奚肇慶1
目的 探討銀杏內酯B(GB)對阿爾茨海默病(AD)大鼠c-fos、Caspase-3和Caspase-8的影響。方法 將大鼠隨機分為正常組、假手術組、模型組和銀杏內酯B組,采用 Morris水迷宮檢測學習記憶,免疫組織化學分析海馬c-fos陽性神經元光密度值,熒光定量PCR和Western blot檢測海馬Caspase-3 和Caspase-8的mRNA和蛋白水平。結果 5 mg/kg的銀杏內酯B可縮短AD大鼠逃避潛伏期,增加穿越平臺次數,提高海馬c-fos的表達,下調凋亡相關基因 Caspase-3和Caspase-8 mRNA和蛋白表達。結論 銀杏內酯B可改善AD大鼠學習記憶能力,這種改善可能與上調AD大鼠海馬組織c-fos表達,下調Caspase-3和Caspase-8 mRNA和蛋白水平有關。
阿爾茨海默病;銀杏內酯B;學習記憶;c-fos;Caspase-3;Caspase-8
學習記憶障礙是阿爾茨海默病(Alzheimer’s disease,AD)的主要臨床表現,Aβ沉積形成老年斑、神經纖維纏結、神經元與突觸的丟失是AD的主要病理學改變。Aβ引起的神經元與突觸丟失是AD學習記憶障礙的主要原因[1-2]。c-fos存在于海馬組織[3-5],與認知記憶和神經元凋亡相關。凋亡是神經元與突觸丟失的主要方式,Caspase-3、Caspase-8是凋亡關鍵因子。已有研究表明:中藥銀杏葉提取物可改善AD相關學習記憶力下降,而銀杏內酯B是銀杏葉提取物的主要活性成分,具有保護神經元、促進學習和改善記憶的作用[6]。實驗證實銀杏內酯B(Ginkgolide B,GB)可改善AD相關的學習記憶缺陷[7],然而其具體作用機制尚未闡明。所以本研究建立AD大鼠模型并采用銀杏內酯B治療,從行為學、組織學與分子生物學等方面探討銀杏內酯B保護海馬神經元、改善AD相關學習記憶力及c-fos、Caspase-3、Caspase-8的作用,為中藥單體防治AD提供理論和實驗依據。
1 材料與方法
1.1 動物與試劑儀器 雄性清潔級 Sprague-Dawley(SD)大鼠,體重180 g~220 g,由河南實驗動物中心提供[合格證號:SCXK(豫)2010-0002]。銀杏內酯B購自中國食品藥品檢定研究院;Aβ1-42購自Sigma公司;鼠單克隆一抗c-fos購自Abcam公司;兔多克隆一抗Caspase-8購自Santa Cruz公司;兔多克隆一抗Caspase-3購自Cell Signaling公司;辣根過氧化物酶標記羊抗鼠二抗購自北京中杉金橋公司;萊卡顯微成像系統購自萊爾公司;全自動凝膠成像系統購自天能公司;Morris水迷宮為中國醫學科學院研制。
1.2 方法
1.2.1 AD動物模型建立 SD大鼠用10%水合氯醛腹腔注射麻醉,頭固定于腦立體定位儀上,參考大鼠腦立體定位圖譜:正中做一切口暴露出前囟,以前囟為原點,向后4 mm,旁開2.5 mm 左右各鉆一孔,硬腦膜下3 mm至兩側海馬。由微量注射器將2 μL(10 μg)Aβ1-42在10 min內注射完畢,留針10 min,使得Aβ1-42充分浸潤局部組織,術后均注射抗生素防止感染。假手術組大鼠注射等量的生理鹽水。
1.2.2 分組及治療 將SD大鼠隨機分為4組:正常組、假手術組、AD模型組和銀杏內酯B組,每組15只。造模3 d后,銀杏內酯B組腹腔注射GB 5 mg/(kg·d),正常組、假手術組和AD模型組給予等量的生理鹽水,均為15 d。
1.2.3 Morris水迷宮檢測學習記憶能力 測試期間室內保持安靜,水池內注入清水并加入墨汁至水不透明,水面高出平臺2 cm。第1天進行預實驗,讓大鼠適應環境,同時將其引導到平臺。其后4 d,每天將大鼠分別從兩個不同入水點面向池壁放入水中,記錄其找到平臺所需要的時間即逃避潛伏期。若大鼠入水后未能找到平臺,則將其置于平臺上停留10 s,引導其學習記憶。逃避潛伏期記錄為60 s。第6天撤除平臺,將大鼠面向池壁從任一入水點放入水池,測試60 s內穿越原平臺位置的次數。Morris 水迷宮檢測期間仍對大鼠進行GB治療。
1.2.4 免疫組織化學檢測c-fos表達 水迷宮實驗結束后1 h,部分大鼠用10%水合氯醛麻醉,打開胸腔暴露心臟,剪開右心耳,灌注生理鹽水及預冷的4%多聚甲醛。快速斷頭取腦,放于4%多聚甲醛中固定24 h,梯度乙醇脫水、二甲苯透明、石蠟包埋切片。脫蠟、修復、PBS清洗;血清封閉,37 ℃孵育20 min;滴加一抗(鼠單抗c-fos,稀釋1∶200),37 ℃孵育過夜;加HRP標記二抗,孵育、DAB顯色;中性樹膠封片。選取海馬CA1區不重疊的5個高倍視野,計算其陽性積分光密度值,取均值統計分析。
1.2.5 熒光定量PCR檢測海馬組織Caspase-3和Caspase-8 mRNA表達 按照Trizol試劑盒說明書從冰凍海馬組織中快速提取總RNA并逆轉錄成 cDNA。Caspase-3:上游引物為5′-CTGGACTGCGGTATTGAGAC-3′,下游引物為5′-CCGGGTGCGGTAGAGTAAGC-3′;Caspase-8:上游引物為5′-GTTCTCTCAGTTGCCTTTC-3′,下游引物為5′-AGCTGTAACCTGTCGCCGAGTCCC-3′;磷酸甘油醛脫氫酶(GAPDH):上游引物為5′-CTACCCACGGCAAGTTCAAT-3′,下游引物為5′-GGATGCAGGGATGATGTTCT-3′,均由上海生工生物有限公司合成。按照試劑盒說明書進行擴增,PCR反應總體積為25 μL,反應條件:95 ℃預變性5 min,94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸40 s,35個循環;72 ℃延伸10 min。由系統軟件自動生成Ct值,△Ct=CtCaspase-3/Caspase-8-CtGAPDH,△△Ct=(Ct Caspase-3/Caspase-8-CtGAPDH)試驗組-(CtCaspase-3/Caspase-8-CtGAPDH)對照組。每個樣品均做3個平行孔,取平均值作為該樣品的Ct值。
1.2.6 Western-blot檢測海馬組織Caspase-3和Caspase-8蛋白表達 水迷宮實驗結束后1 h,部分大鼠冰上快速分離海馬放入離心管,加組織裂解液、勻漿。離心取上清用BCA法檢測樣品蛋白濃度,并計算所需蛋白量。配制聚丙烯酰胺凝膠,微量加樣器加樣電泳。300 mA恒流轉膜3 h,取出PVDF膜,封閉液室溫封閉1.5 h。用一抗Caspase-3和Caspase-8(1∶1 000)或小鼠抗GAPDH (1∶2 000),孵育過夜。辣根過氧化物酶標記的山羊抗兔IgG(1∶3 000)或山羊抗小鼠IgG(1∶3 000),室溫孵育2 h。ECL反應后用全自動凝膠成像系統成像檢測。
2 結 果
2.1 各組大鼠 Morris 水迷宮結果(見表1) 與正常組相比,模型組大鼠的逃避潛伏期明顯延長,去掉平臺后,模型組穿越原平臺的次數減少(P<0.05);腹腔注射銀杏內酯B 15 d后,逃避潛伏期時間縮短,穿越原平臺次數明顯增加(P<0.05),這提示銀杏內酯B具有改善 AD 大鼠學習記憶障礙的能力。
表1 各組大鼠 Morris水迷宮實驗結果比較(±s)
2.2 各組大鼠海馬CA1區c-fos表達 免疫組織化學檢測結果顯示:c-fos的陽性表達部位主要在細胞核,c-fos陽性細胞核呈現褐色(見圖1)。與正常組相比,模型組大鼠海馬CA1區c-fos蛋白表達呈弱陽性,有降低的趨勢(P>0.05)。腹腔注射銀杏內酯B 15 d后,c-fos蛋白表達呈強陽性,差異有統計學意義(P<0.05)。提示銀杏內酯B具有提高 AD 大鼠海馬CA1區c-fos表達的能力。詳見表2。

圖1 各組大鼠海馬CA1區和前額葉皮層c-fos蛋白表達(400×)
表2 各組海馬CA1區c-fos陽性區平均積分光密度值比較(±s)
2.3 各組大鼠海馬Caspase-3和Caspase-8 mRNA水平表達(見表3) Real time-PCR結果顯示:與正常組相比,模型組海馬組織Caspase-3、Caspase-8 mRNA水平表達上調(P<0.05);與模型組相比,銀杏內酯B治療后Caspase-3、Caspase-8 mRNA表達下降(P<0.05),說明銀杏內酯B可降低AD大鼠海馬組織Caspase-3、Caspase-8 mRNA表達水平。
表3 各組大鼠海馬Caspase-3和Caspase-8 mRNA表達(±s)
2.4 各組大鼠海馬Caspase-3和Caspase-8蛋白表達 與正常組相比,模型組海馬Caspase-3和Caspase-8蛋白表達增加(P<0.05或P<0.01)。腹腔注射銀杏內酯B 15 d后,大鼠海馬Caspase-3和Caspase-8蛋白表達水平下降(P<0.05),提示銀杏內酯B具有降低AD 大鼠海馬組織Caspase-3和Caspase-8蛋白表達的能力。詳見圖2、表4。

圖2 各組大鼠海馬Caspase-3和Caspase-8蛋白表達
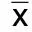
表4 各組大鼠海馬Caspase-3和Caspase-8蛋白表達(±s)
3 討 論
Morris水迷宮主要用于研究和空間學習記憶相關的中樞腦區功能評價。它通過讓受試動物在水環境中尋找隱匿平臺并分析其找到平臺所需時間(逃避潛伏期)及動物穿越隱匿平臺的次數來判斷空間學習記憶的能力。逃避潛伏期越短、穿越隱匿平臺的次數越多,表明受試動物的空間學習記憶能力越好。本研究在Morris水迷宮實驗中發現:AD 大鼠給予銀杏內酯B治療后,逃避潛伏期時間明顯縮短,穿越隱匿平臺次數明顯增加,說明銀杏內酯B可改善Aβ1-42誘導的AD大鼠學習記憶能力。
即刻早期基因c-fos及其蛋白產物既參與細胞的生長、分化及信息傳遞,也與學習記憶過程相關[3]。c-fos參與神經元信號轉導及認知,是保持空間記憶所必需的[4]。Kubik等[8]認為c-fos蛋白是神經元突觸可塑性的最常見標志之一。除此以外,已有實驗證實c-fos表達還參與誘導神經元細胞凋亡[5]。神經元凋亡是造成 AD 神經元與突觸丟失的主要途徑,同時也是引起進行性學習記憶能力減退的主要原因。海馬是參與學習記憶功能的重要結構,也是AD病人腦中最易受累的區域之一。本研究在行為學實驗結束后檢測了各組大鼠海馬CA1區c-fos蛋白的表達水平。結果顯示:與正常組相比,模型組AD大鼠海馬CA1區的c-fos蛋白水平有降低趨勢。出現這種結果的原因是:AD大鼠機體細胞生長、分化及增殖能力減弱,海馬神經元突觸的信號轉導減少,長時程增強(LTP)下降,所以AD大鼠記憶力下降的同時伴隨著c-fos蛋白水平的降低。而使用銀杏內酯B治療后,AD大鼠海馬CA1區c-fos蛋白水平增加。這提示銀杏內酯B改善AD大鼠學習記憶力可能與其能夠提高海馬CA1區c-fos蛋白表達水平有關。
細胞凋亡受高度程序化調控,分為死亡受體途徑(外源性途徑)和線粒體途徑(內源性途徑),Caspase-8是兩個途徑的共同部分。外源性途徑中,酶原形式的Caspase-8活化后可通過激活Caspase-3或其他Caspase誘導細胞凋亡。內源性途徑中,Caspase-8下游包含了bcl-2家族的調節分子,因此Caspase-8是凋亡途徑中的關鍵因子。無論哪種途徑,細胞凋亡最終都是通過凋亡執行蛋白 Caspase-3實現的[9]。為了進一步探討c-fos在銀杏內酯B改善AD大鼠學習記憶力中的作用,本實驗檢測了大鼠海馬Caspase-3、Caspase-8 mRNA和蛋白表達。結果顯示:模型組Caspase-3和Caspase-8 mRNA和蛋白表達水平高于正常組,提示AD海馬細胞凋亡基因被激活,AD可引起細胞凋亡,影響動物的空間學習和記憶能力。銀杏內酯B治療可下調 Caspase-3 和Caspase-8的表達,從而抑制 Aβ誘導的海馬神經元凋亡,這可能是銀杏內酯B抗細胞凋亡作用機制的環節之一。同時也說明c-fos蛋白水平增高可能與Caspase-3和Caspase-8相關。
綜上所述,銀杏內酯B通過上調海馬c-fos,降低凋亡執行蛋白Caspase-3和Caspase-8的表達等過程,對抗Aβ誘導的海馬神經元凋亡,提高 AD大鼠學習記憶能力。為中藥單體銀杏內酯B治療 AD 以及闡明其中的作用機制提供理論和實驗依據。
[1] Li W,Yu J,Liu Y,et al.Elevation of brain magnesium prevents synaptic loss and reverses cognitive deficits in Alzheimer’s disease mouse model[J].Molecular Brain,2014,7(19):8423-8441.
[2] Pozueta J,Lefort R,Shelanski ML.Synaptic changes in Alzheimer’s disease and its models[J].Neuroscience,2013,251:51-65.
[3] Lüscher Dias T,Fernandes Golino H,Moura de Oliveira VE,et al.c-Fos expression predicts long-term social memory retrieval in mice[J].Behav Brain Res,2016,313:260-271.
[4] Tsai YW,Yang YR,Wang PS,et al.Intermittent hypoxia after transient focal ischemia induces hippocampal neurogenesis and c-Fos expression and reverses spatial memory deficits in rats[J].Plos One,2011,6(8):e24001.
[5] Contestabile A,Ciani E,Sparapani M,et al.Activation of the ornithine decarboxylase-polyamine system and induction of c-fos and p53 expression in relation to excitotoxic neuronal apoptosis in normal and microencephalic rats[J].Exp Brain Res,1998,120(4):519-526.
[6] Bate C,Tayebi M,Williams A.Ginkgolides protect against amyloid-β1-42-mediated synapse damage in vitro[J].Mol Neurodegeneration,2008,3(43):1.
[7] Yang P,Cai X,Zhou K,et al.A novel oil-body nanoemulsion formulation of ginkgolide B: pharmacokinetics study and in vivo pharmacodynamics evaluations[J].J Pharm Sci,2014,103(4):1075-1084.
[8] Kubik S,Miyashita T,Guzowski JF.Using immediate-early genes to map hippocampal subregional functions[J].Learn Mem,2007,14(11):758-770.
[9] Kamada S,Kikkawa U,Tsujimoto Y,et al.Nuclear translocation of caspase-3 is dependent on its proteolytic activation and recognition of a substrate-like protein (s) [J].J Biol Chem,2005,280(2):857-860.
(本文編輯郭懷印)
The Influence of Ginkgobalide B on the Expression of C-fos,Caspase-3 and Caspase-8 in the Hippocampus of Alzheimer’s Disease Rats
Hao Li,Xu Yuying,Tian Xinhong,You Yanwen,Xi Zhaoqing
The First Affiliated Hospital,Nanjing University of Traditional Chinese Medicine,Nanjing 210023,Jiangsu,China;Basic Medical College,Henan University of Traditional Chinese Medicine,Zhengzhou 450008,Henan,China
Xi Zhaoqing (The First Affiliated Hospital,Nanjing University of Traditional Chinese Medicine,Nanjing 210023,Jiangsu,China)
Objective To evaluate the efficiency of ginkgobalide B on the expression of c-fos,caspase-3 and caspase-8 in the hippocampus of Alzheimer’s disease rats.Methods Rats were randomly divided into four groups:normal group,sham group,model group and Ginkgobalide B group.The Morris water maze (MWM) test was used to assess behaviors of the rats,Imunohistochemical staining was used to test c-fos in the hippocampal CA1.Real-time PCR and western blot were used to examine caspase-3 and caspase-8 mRNA and protein levels.Results MWM test result showed that escape latency was significantly shower and the times of crossing the platform increased.Imunohistochemical staining showed that c-fos increased in the hippocampal CA1 after ginkgobalide B (5 mg/kg) treatment.Real-time PCR and western blot manifested that compared with the model group,caspase-3 and caspase-8 decreased in the hippocampus after ginkgobalide B (5 mg/kg) treatment.Conclusion Ginkgobalide B can improve learning and memory in Alzheimer disease’s rats,and its mechanism might be associated with neuronal apoptosis.
Alzheimer’s disease;ginkgobalide B;learning and memory;c-fos;caspase-3;caspase-8
河南中醫藥大學博士基金資助項目(No.BSJJ2015-04)
1.南京中醫藥大學第一附屬醫院(南京 210023);2.河南中醫藥大學基礎醫學院(鄭州 450008)
奚肇慶,E-mail:xzq49@163.com
R743 R285.5
A
10.3969/j.issn.1672-1349.2017.07.009
1672-1349(2017)07-0798-04
2016-09-21)
引用信息:郝莉,徐玉英,田新紅,等.銀杏內酯B對阿爾茨海默病大鼠海馬c-fos、Caspase-3和Caspase-8的影響[J].中西醫結合心腦血管病雜志,2017,15(7):798-801.

