恩替卡韋治療慢性乙型肝炎合并肝脂肪變的效果評價
吳艷琴, 沈黎俊, 于集虹, 孫玉山
(新疆巴州人民醫院 a.感染性疾病科;b.CT室;c.醫學超聲科, 新疆 庫爾勒 841000)
論著/病毒性肝炎
恩替卡韋治療慢性乙型肝炎合并肝脂肪變的效果評價
吳艷琴a, 沈黎俊a, 于集虹b, 孫玉山c
(新疆巴州人民醫院 a.感染性疾病科;b.CT室;c.醫學超聲科, 新疆 庫爾勒 841000)
目的 探討慢性乙型肝炎(CHB)合并肝脂肪變患者經恩替卡韋抗病毒治療后的效果。方法 納入新疆巴州人民醫院2014年6月-2015年6月就診的HBeAg陽性CHB患者164例,根據肝小葉內肝脂肪變的肝細胞數占總肝細胞數的比例將其分為3組:脂肪變肝細胞占比<5%(對照組,89例),脂肪變肝細胞占比5%~30%(A組,43例),脂肪變肝細胞占比>30%組(B組,32例)。患者均給予恩替卡韋治療。檢測患者治療前和治療后24、48周血清病毒學指標和肝功能指標變化。計量資料組間比較采用單因素方差分析,進一步兩兩比較采用Bonferroni法;計數資料組間比較采用χ2檢驗。結果 肝脂肪變不影響恩替卡韋治療24周時的病毒學應答(P>0.05),但恩替卡韋治療48周時,B組HBeAg陰轉率(34.4% vs 60.2%)和HBV DNA陰轉率(40.6% vs 67.4%)均明顯低于對照組,差異具有統計學意義(P值分別為0.012和0.008);恩替卡韋治療24和48周時,A組、B組的ALT復常率明顯低于對照組,差異均有統計學意義(A組:P值分別為0.013、0.001;B組:P值分別為0.001、<0.001),而血清AST、ALP及GGT水平顯著高于對照組,差異均有統計學意義(A組:P24值分別為<0.001、0.031、0.001,P48值分別為<0.001、0.021、<0.001;B組:P24值分別為<0.001、0.028、0.001;P48值分別為<0.001、0.017、<0.001)。結論 肝脂肪變細胞占比>30%與恩替卡韋治療48周時病毒學應答降低相關,肝脂肪變會影響CHB患者恩替卡韋治療24周和48周時的生化學應答。
肝炎, 乙型, 慢性; 脂肪肝; 恩替卡韋; 治療結果
慢性乙型肝炎(CHB)的發生是機體HBV持續復制與機體免疫應答相互影響的結果[1],抗病毒是治療CHB的關鍵措施。臨床報道[2]指出,CHB患者較健康人群更容易發生肝脂肪變。不同地區的患病例數也存在較大差異,14%~70%的CHB患者合并肝脂肪變[3]。雖然目前已有CHB防治指南,但是肝脂肪變是否會影響CHB患者的治療效果還存在爭議。一些研究[4-5]表明CHB患者肝脂肪變的發生主要與宿主的代謝因素(如年齡、肥胖、血脂水平和代謝綜合征等)相關,而與病毒因素(如HBeAg和HBV DNA載量等)關系不密切。Cindoruk等[6]認為肝脂肪變與病毒載量無關,且不會影響CHB患者的治療效果。而國內劉淑娥等[5]指出CHB合并肝脂肪變會導致單純抗病毒治療效果不佳。因此,本文通過病例對照研究對合并肝脂肪變的HBeAg陽性CHB患者進行恩替卡韋抗病毒治療,探討CHB合并肝脂肪變患者進行抗病毒治療的合理性,以期為此類患者抗病毒治療提供新的臨床思路和依據。
1 資料與方法
1.1 研究對象 隨機選取本院2014年6月-2015年6月收治的CHB患者164例。納入標準:(1)診斷符合中華醫學會制訂的《慢性乙型肝炎防治指南(2010年版)》[7];(2)均經血清免疫學及PCR法檢測HBV指標陽性,合并HBeAg陽性6個月以上,血清HBV DNA載量≥ 1.0×105拷貝/ml;(3)血清ALT>2倍正常值上限且維持1個月以上。排除標準:(1)合并其他肝炎病毒(HAV、HCV、HDV及HEV)感染者;(2)自身免疫性肝病、藥物性肝炎、酒精性肝病、不明原因性肝病及原發性肝癌患者。在接受抗病毒治療前,結合病理形態學檢查,并參照2010 年版《非酒精性脂肪性肝病診療指南》[8]中所提出的分級原則,根據肝小葉內脂肪變的肝細胞數占總肝細胞數的比例將患者分為3組。其中脂肪變肝細胞占比<5%的患者為對照組(89例,單純CHB患者),脂肪變肝細胞占比5%~30%的患者為A組(43例),脂肪變肝細胞占比>30%者為B組(32例)。所有患者均給予口服恩替卡韋治療,1次/d,0.5 mg/次。
1.2 研究方法
1.2.1 人體學指標測定 人體學指標包括性別、年齡、病程、身高、體質量、腰圍和臀圍,并計算BMI和腰臀比(waist-to-hip ratio, WHR)。其中WHR=腰圍(cm)/臀圍(cm)。
1.2.2 生化指標檢測 采用羅氏全自動生化發光分析儀測定患者空腹血糖(fasting blood glucose,FBG)、胰島素、TG、TC、ALT、AST、GGT、ALP以及TBil水平。計算胰島素抵抗指數(homeostasis model assessment of insulin resistance,HOMA-IR)。HOMA-IR=空腹血糖×空腹胰島素/22.5。
1.2.3 HBV血清學標志物及DNA檢測 采用羅氏Elecsys檢測HBV血清學標志物HBeAg。采用羅氏熒光定量PCR儀(瑞士羅氏公司)測定患者HBV DNA載量。血清HBV DNA載量≥103拷貝/ml為HBV DNA陽性。1.2.4 肝組織學檢查 患者于入組后1周內,采用美國巴德公司提供的MAXCORE一次性全自動活組織檢查針(16 G)行肝臟穿刺活組織檢查,肝組織標本長度1~1.5 cm,直徑1 cm。4%甲醇固定,脫水后石蠟包埋,切片,并行網狀纖維染色、HE染色及Masson染色,同時由2位有經驗的病理醫師進行雙盲閱片。

2 結果
2.1 一般資料 164例患者年齡18~70歲,病程(3.5±1.2)年。3組間年齡、性別和病程等一般資料差異均無統計學意義,具有可比性(P值均>0.05)。而3組間BMI、WHR、FBG、空腹胰島素、HOMA-IR、TG及TC水平差異均有統計學意義(P值均<0.05)(表1)。2.2 3組患者的肝功能指標比較 恩替卡韋治療前,3組患者在ALT、AST、ALP、GGT水平上差異無統計學意義(P值均> 0.05)。治療24周和48周時各肝功能指標在3組間差異均有統計學意義(P值均<0.05),其中A組、B組的ALT復常率明顯低于對照組,差異均有統計學意義(A組:P值分別為0.013、0.001;B組:P值分別為0.001、<0.001),而血清AST、ALP及GGT水平顯著高于對照組(A組:P24值分別為<0.001、0.031、0.001,P48值分別為<0.001、0.021、<0.001;B組:P24值分別為<0.001、0.028、0.001;P48值分別為<0.001、0.017、<0.001)(表2)。
2.3 3組患者的病毒學指標比較 治療24周時,HBeAg陰轉率和HBV DNA陰轉率在3組間差異均無統計學意義(P值均>0.05);治療48周時,HBeAg陰轉率和HBV DNA陰轉率在3組間差異均有統計學意義(P值均<0.05),其中B組的HBeAg陰轉率和HBV DNA陰轉率顯著低于對照組(P值分別為0.012和0.008)(表3)。
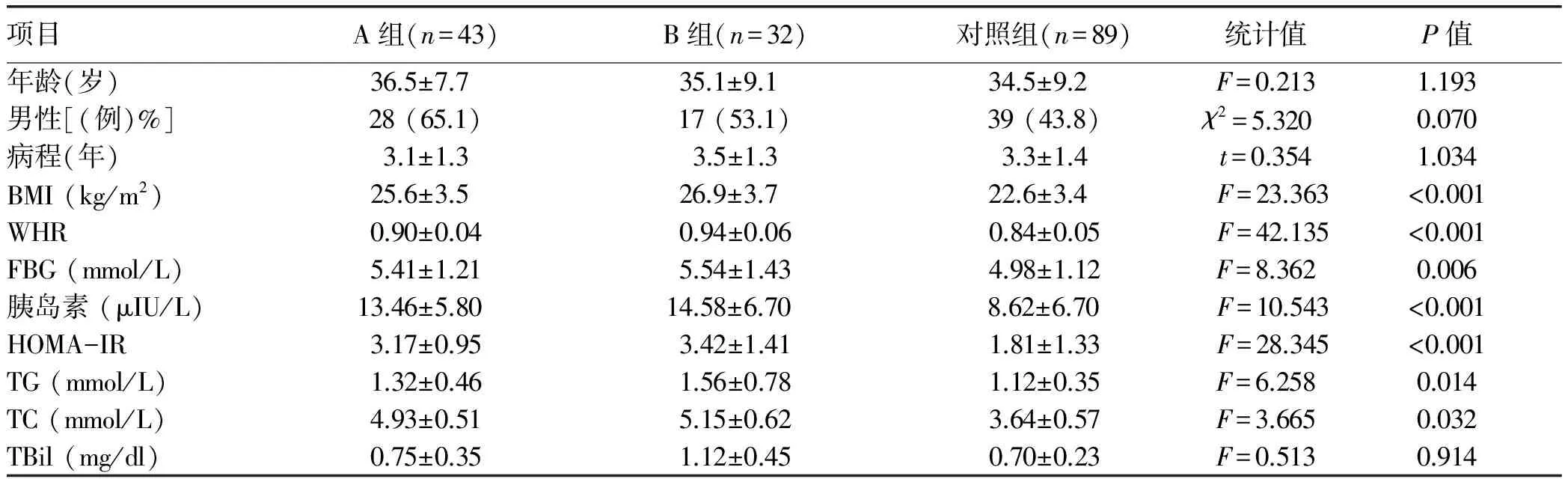
表1 患者的基線資料比較
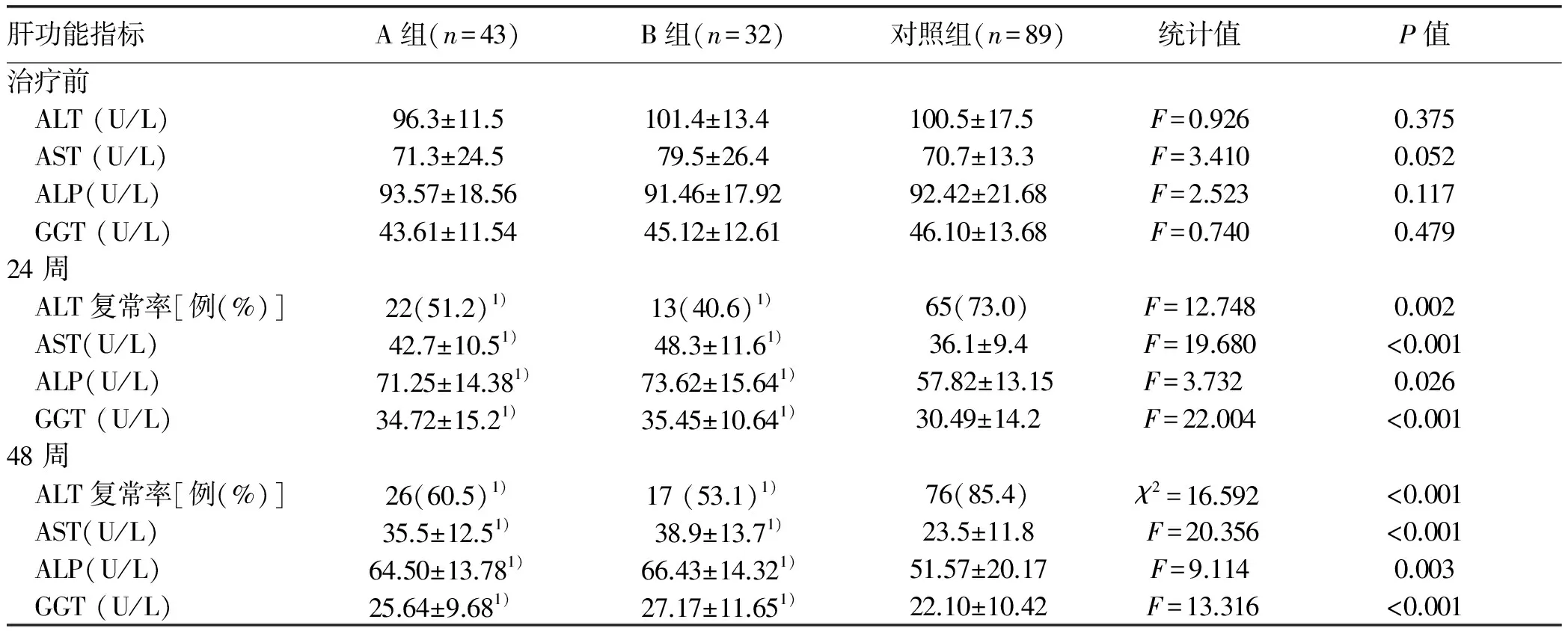
表2 3組患者抗病毒治療前后肝功能指標比較
注:與對照組比較,1)P<0.05

表3 3組患者的病毒學指標比較[例(%)]
注:與對照組同一治療時間比較,1)P<0.05
3 討論
肝脂肪變是否會影響CHB患者的抗病毒治療效果存在爭議。本研究表明經核苷類藥物恩替卡韋治療后,與單純CHB患者相比,脂肪變肝細胞占比>30%時與恩替卡韋治療48周時病毒學應答降低相關。而脂肪變肝細胞占比>5%時會影響CHB患者恩替卡韋治療24周和48周時的生化學應答。
目前CHB患者合并脂肪肝的發病機制尚不明確。相關研究[9]指出,HBV X蛋白可通過上調固醇調節元件結合蛋白-1c及過氧化物酶體增殖物激活受體γ(脂肪細胞分化的重要調節因子)誘導肝脂肪變。本研究表明,CHB合并肝脂肪變患者BMI、WHR、TG、TC水平及HOMA-IR相比單純CHB患者有顯著性差異,提示代謝因子與CHB合并肝脂肪變的發生有關,研究結果與之前的報道一致[10-11]。
核苷類藥物和IFNα是兩種公認的CHB治療藥物。然而,肝脂肪變是否會影響CHB患者的抗病毒療效存在爭議。Ates等[12]對84例CHB患者研究發現,與單純CHB患者相比,CHB合并脂肪肝患者經PEG-IFNα治療24周后病毒學應答無明顯差異。Shi等[13]研究表明CHB合并肝脂肪變對PEG-IFNα治療48 周時的病毒學應答無影響,但可降低其生化學應答。本研究通過對肝脂肪變程度進行分級發現,脂肪變肝細胞占比為5%~30%時并不影響恩替卡韋抗病毒治療24周和48周時的HBV DNA水平和HBeAg陰轉率。但脂肪變肝細胞占比>30%時,恩替卡韋抗病毒治療48周時的HBV DNA水平和HBeAg陰轉率明顯降低。同時,脂肪變肝細胞占比>5%會降低24周和48周時的ALT復常率、AST、ALP和GGT水平。本研究結果與Shi等的研究結果有一定差異,但與一項前瞻性研究[14]結果一致,即肝脂肪變降低CHB患者核苷類藥物抗病毒治療48、96周的病毒學及生化學應答。筆者認為,樣本量、抗病毒藥物種類和肝脂肪變的定義標準均會影響臨床研究結果。分析肝細胞脂肪變降低CHB患者的抗病毒療效的原因有以下3點:(1)脂肪的堆積與細胞色素P450活性的降低有關,從而影響藥物的利用率[15];(2)脂肪的堆積會導致自然殺傷性T淋巴細胞的活化,促進組織炎癥、免疫耐受和肝脂肪變[16];(3)近期研究[17]指出非酒精性脂肪性肝病患者體內Toll樣受體1-5(一種抗病毒信號分子)水平升高,提示肝脂肪變可抑制非特異性免疫應答的強度。
綜上所述,臨床上治療CHB合并肝脂肪變患者時應考慮肝脂肪變程度對療效的影響,抗病毒治療的同時有效改善肝脂肪變可能會達到更好的效果。本研究表明肝脂肪變影響了抗病毒療效,而抗病毒效果是否會對肝脂肪變產生影響需進一步探討。
[1] BOONSTRA A, WOLTMAN AM, JANSSEN HL. Immunology of hepatitis B and hepatitis C virus infections[J]. Best Pract Res Clin Gastroenterol, 2008, 22(6): 1049-1061.
[2] PENG D, HAN Y, DING H, et al. Hepatic steatosis in chronic hepatitis B patients is associated with metabolic factors more than viral factors[J]. J Gastroenterol Hepatol, 2008, 23(7 Pt 1): 1082-1088.
[3] MACHADO MV, OLIVEIRA AG, CORTEZ-PINTO H. Hepatic steatosis in hepatitis B virus infected patients: meta-analysis of risk factors and comparison with hepatitis C infected patients[J]. J Gastroenterol Hepatol, 2011, 26(9): 1361-1367.
[4] SHI JP, FAN JG, WU R, et al. Prevalence and risk factors of hepatic steatosis and its impact on liver injury in Chinese patients with chronic hepatitis B infection[J]. J Gastroenterol Hepatol, 2008, 23(9): 1419-1425.
[5] LIU SE, HAO MN, REN YN, et al. Analysis of diagnosis and treatment towards CHB patients complicated with fatty liver with complete virological response while biochemical suboptimal response[J]. Chin J Hepatol, 2015, 23(5): 333-338. (in Chinese) 劉淑娥, 郝美娜, 任亞楠, 等. 慢性乙型肝炎患者合并脂肪肝導致單純抗病毒治療生物化學應答不佳診療分析[J]. 中華肝臟病雜志, 2015, 23(5): 333-338.
[6] CINDORUK M, KARAKAN T, UNAL S. Hepatic steatosis has no impact on the outcome of treatment in patients with chronic hepatitis B infection[J]. J Clin Gastroenterol, 2007, 41(5): 513-517.
[7] Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis B (2010 version)[J]. J Clin Hepatol, 2011, 27(1): Ⅰ-ⅩⅥ. (in Chinese) 中華醫學會肝病學分會, 中華醫學會感染病學分會. 慢性乙型肝炎防治指南(2010年版)[J]. 臨床肝膽病雜志, 2011, 27(1): Ⅰ-ⅩⅥ.
[8] Group of Fatty Liver and Alcoholic Liver Diseases, Society of Hepatology, Chinese Medical Association.Guidelines for management of non-alcoholic fatty liver disease[J]. J Clin Hepatol, 2010, 26(2): 120-124.(in Chinese) 中華醫學會肝臟病學分會脂肪肝和酒精性肝病學組. 非酒精性脂肪性肝病診療指南[J]. 臨床肝膽病雜志, 2010, 26(2): 120-124.
[9] KIM KH, SHIN HJ, KIM K, et al. Hepatitis B virus X protein induces hepatic steatosis via transcriptional activation of SREBP1 and PPARγ[J]. Gastroenterology, 2007, 132(5): 1955-1967.
[10] ZHENG RD, CHEN JN, ZHUANG QY, et al. Clinical and virological characteristics of chronic hepatitis B patients with hepatic steatosis[J]. Int J Med Sci, 2013, 10(5): 641-646.
[11] ZHENG RD, XU CR, JIANG L, et al. Predictors of hepatic steatosis in HBeAg-negative chronic hepatitis B patients and their diagnostic values in hepatic fibrosis[J]. Int J Med Sci, 2010, 7(5): 272-277.
[12] ATES F, YALNIZ M, ALAN S. Impact of liver steatosis on response to pegylated interferon therapy in patients with chronic hepatitis B[J]. World J Gastroenterol, 2011, 17(40): 4517-4522.
[13] SHI JP, LU L, QIAN JC, et al. Impact of liver steatosis on antiviral effects of pegylated interferon-alpha in patients with chronic hepatitis B[J]. Chin J Hepatol, 2012, 20(4): 285-288. (in Chinese) 施軍平, 陸璐, 錢建成, 等. 肝脂肪變對慢性乙型肝炎患者聚乙二醇干擾素α治療臨床療效的影響[J].中華肝臟病雜志, 2012, 20(4): 285-288.
[14] JIN X, CHEN YP, YANG YD, et al. Association between hepatic steatosis and entecavir treatment failure in Chinese patients with chronic hepatitis B[J]. PLoS One, 2012, 7(3): e34198.
[15] LECLERCQ I, HORSMANS Y, DESAGER JP, et al. Reduction in hepatic cytochrome P-450 is correlated to the degree of liver fat content in animal models of steatosis in the absence of inflammation[J]. J Hepatol, 1998, 28(3): 410-416.
[16] WU L, PAREKH VV, GABRIEL CL, et al. Activation of invariant natural killer T cells by lipid excess promotes tissue inflammation, insulin resistance, and hepatic steatosis in obese mice[J]. Proc Nati Acad U S A, 2012, 109(19): e1143-e1152.
[17] KANURI G, LADURNER R, SKIBOVSKAYA J, et al. Expression of toll-like receptors 1-5 but not TLR 6-10 is elevated in livers of patients with non-alcoholic fatty liver disease[J]. Liver Int, 2015, 35(2): 562-568.
引證本文:WU YQ, SHEN LJ, YU JH, et al. Clinical effect of entecavir in treatment of chronic hepatitis B complicated by hepatic steatosis[J]. J Clin Hepatol, 2017, 33(5): 849-852. (in Chinese) 吳艷琴, 沈黎俊, 于集虹, 等. 恩替卡韋治療慢性乙型肝炎合并肝脂肪變的效果評價[J]. 臨床肝膽病雜志, 2017, 33(5): 849-852.
(本文編輯:王 瑩)
Clinical effect of entecavir in treatment of chronic hepatitis B complicated by hepatic steatosis
WUYanqin,SHENLijun,YUJihong,etal.
(DepartmentofInfectiousDiseases,BazhouPeople′sHospital,Kuerle,Xinjiang841000,China)
Objective To investigate the effect of antiviral therapy with entecavir in the treatment of chronic hepatitis B (CHB) complicated by hepatic steatosis. Methods A total of 164 HBeAg-positive CHB patients who visited Bazhou People′s Hospital from June 2014 to June 2015 were enrolled, and according to the percentage of hepatocytes with steatosis in the hepatic lobules in all hepatocytes, they were divided into control group (<5% of hepatocytes with steatosis, 89 patients), group A (5%-30% of hepatocytes with steatosis, 43 patients), and group B (>30% of hepatocytes with steatosis, 32 patients). All patients were treated with entecavir. The serum virological parameters and liver function parameters were measured before treatment and at weeks 24 and 48 of treatment. A one-way analysis of variance was used for comparison of continuous data between groups, and the Bonferroni method was used for comparison between any two groups; the chi-square test was used for comparison of categorical data between groups. Results Hepatic steatosis did not affect the virologic response at week 24 of entecavir treatment (P>0.05). However at week 48 of entecavir treatment, compared with the control group, group B had significantly lower HBeAg clearance rate (34.4% vs 60.2%,P=0.012) and HBV DNA clearance rate (40.6% vs 67.4%,P=0.008). At weeks 24 and 48 of entecavir treatment, compared with the control group, groups A and B had a significantly lower alanine aminotransferase normalization rate than the control group (group A:P=0.013 and 0.001; group B:P=0.001 andP<0.001) and significantly higher levels of aspartate aminotransferase, alkaline phosphatase, and gamma-glutamyl transpeptidase (group A:P24<0.001,P24=0.031, andP24=0.001,P48<0.001,P48=0.021, andP48<0.001; group B:P24<0.001,P24=0.028, andP24=0.001,P48<0.001,P48=0.017,P48<0.001). Conclusion A percentage of hepatocytes with steatosis of >30% is associated with the reduction in virologic response at week 48 of entecavir treatment. Hepatic steatosis affects the biochemical response in CHB patients at weeks 24 and 48 of entecavir treatment.
hepatitis B, chronic; fatty liver; entecavir; treatment outcome
10.3969/j.issn.1001-5256.2017.05.011
2016-11-23;
2016-12-09。
春雨工程感染科專項科研基金(2014-05)
吳艷琴(1972-),女,主任醫師,主要從事肝病及感染性疾病研究。
吳艷琴,電子信箱:wuyanq_xj@163.com。
R512.62; R575.5
A
1001-5256(2017)05-0849-04

